XAV939对结肠癌耐药细胞迁移能力的影响
朱瑶丹,韩锡萍,陈 震,张 鹏,马 鑫
(江南大学药学院和医学院,江苏 无锡 214122)
在世界范围内,结肠癌是最为严重的恶性肿瘤之一[1]。目前在临床上治疗结肠癌最有效的方法是化疗,5-氟尿嘧啶(5-fluorouracil, 5-Fu)作为结肠癌治疗的基本化疗药物被广泛应用[2],但是化疗后的远期生存率仍不理想。高死亡率很大程度上与肿瘤转移有关[3],主要是因为患者对化疗药物产生了耐药性[4]。尽管对肿瘤转移和耐药的研究已经进行了很长时间,但是其复杂机制尚未完全明晰。
有研究报道,Wnt/β-catenin信号通路参与了多种肿瘤的发生、发展[5],而在结肠癌中,Wnt/β-catenin信号通路也介导了结肠癌细胞的耐药[4]。在超过80%的结肠癌中可以观察到由于Wnt/β-catenin通路激活而导致细胞核中β-catenin积聚的现象,值得注意的是,该现象可能与结肠癌患者的不良预后有关[1]。
肿瘤转移过程中的关键步骤之一是肿瘤细胞的迁移与侵袭[6],尽管大量研究发现很多物质如蛋白[7]、miRNA[8]、长链非编码RNA[9]等可以通过Wnt信号通路,影响细胞的迁移与侵袭能力,然而,抑制Wnt信号通路能否影响结肠癌细胞对化疗药物的耐受性,进而对细胞的迁移能力产生影响尚不可知。因此,本研究选用耐5-Fu人结肠癌细胞株HCT-8/5-Fu,并给予Wnt通路小分子抑制剂XAV939处理,探究Wnt信号通路与结肠癌耐药及迁移的可能关系。
1 材料与方法
1.1材料
1.1.1细胞株 人结肠癌野生型细胞株HCT-8/WT、耐5-Fu人结肠癌细胞株HCT-8/5-Fu,购自南京凯基生物科技发展有限公司。
1.1.2试剂 XAV939、5-Fu购自Sigma公司;RPMI 1640培养基、胎牛血清(fetal bovine serum, FBS)购自Gibco公司;c-Myc、cyclin D1多克隆抗体购自万类生物公司;β-catenin、TATA结合蛋白 (TATA binding protein, TBP)单克隆抗体,购自Abcam公司;GAPDH抗体购自Bioworld 公司;羊抗鼠、羊抗兔辣根过氧化酶标记二抗购自Proteintech公司;MTT细胞增殖及细胞毒性检测试剂盒、细胞核蛋白与细胞质蛋白抽提试剂盒、超敏ECL化学发光试剂盒,均购自碧云天生物技术有限公司。
1.1.3仪器 全功能微孔板检测仪(Bio Tek公司);全能型凝胶成像分析系统(美国Bio-Rad公司);正置显微镜(日本Olympus公司)。
1.2方法
1.2.1细胞培养 将HCT-8/WT、HCT-8/5-Fu细胞培养于含10% FBS、100 kU·L-1青霉素、100 g·L-1链霉素溶液的RPMI 1640完全培养基中,置于37℃、5% CO2及饱和湿度的培养箱中培养。
1.2.2MTT法检测细胞活力 将HCT-8/WT、HCT-8/5-Fu细胞按每孔8 000个的数量接种于96孔板,Wnt通路抑制剂组中每孔含有终浓度10 μmol·L-1的XAV939。培养24 h后吸弃孔中培养基,加入倍比稀释的5-Fu,抑制组中每孔仍含10 μmol·L-1的XAV939。培养48 h后,每孔加入10 μL MTT溶液,避光继续培养4 h,每孔加入100 μL甲臜溶解液,孵育4 h后,取出96孔板于全功能微孔板检测仪检测570 nm处的吸光度值。
1.2.3Transwell实验检测细胞迁移 将孔径8 μm的Transwell小室(BD Bioscience公司)放入配套的24孔板中,HCT-8/WT、HCT-8/5-Fu细胞重悬于无血清的RPMI 1640培养基,使其终浓度为109·L-1,在上室加入100 μL细胞悬液,在下室加入500 μL含有10% FBS的RPMI 1640完全培养基,Wnt通路抑制剂组的下室添加10 μmol·L-1XAV939,培养48 h后取出小室,4%多聚甲醛室温固定30 min,结晶紫染色20 min,PBS缓冲液洗涤干净后,风干,用显微镜观察穿入下室中的细胞,随机记录4个视野下的细胞数,取平均值。
1.2.4划痕实验 将细胞铺于12孔板,每孔细胞数为105个,Wnt通路抑制剂组中添加10 μmol·L-1XAV939。待培养至细胞融合度达90%,进行划线操作,PBS洗去漂浮细胞,每孔加入含2% FBS的RPMI 1640培养基继续培养,在0 h和24 h给细胞拍照取样。采用边缘迁移距离法计算迁移率,即细胞迁移率=(边缘距离0 h-边缘距离24 h)/边缘距离0 h×100%。
1.2.5Western blot检测β-catenin、c-Myc、cyclin D1蛋白表达 参照陈淑娴等[10]方法,收集细胞,PBS离心洗涤细胞3次,加入RIPA裂解细胞,提取细胞总蛋白质;细胞核蛋白、细胞质蛋白提取参照试剂盒说明书。检测蛋白浓度,加入SDS-PAGE蛋白上样缓冲液后,沸水热变性5 min,进行SDS-PAGE凝胶电泳,将蛋白质转移至PVDF膜上,加入封闭液(TBST配制的5%脱脂奶粉)室温封闭4 h,分别加入抗β-catenin、c-Myc、cyclin D1、GAPDH、TBP一抗孵育过夜。TBST洗涤3次,每次10 min,加入二抗室温孵育2 h,TBST洗涤,按ECL说明书显色,成像仪拍照。
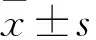
2 结果
2.1HCT-8细胞耐药对迁移能力的影响MTT检测HCT-8/WT和HCT-8/5-Fu细胞对5-Fu的敏感性,由Fig 1A可见,HCT-8/WT细胞对5-Fu的IC50为40.31 mg·L-1,而HCT-8/5-Fu细胞对5-Fu的IC50为472.5 mg·L-1,耐药指数近11.7(P<0.05)。为探讨HCT-8细胞耐药性的差异是否影响其迁移能力,用Transwell实验和划痕实验检测HCT-8/WT和HCT-8/5-Fu细胞的迁移能力。结果显示,与HCT-8/WT细胞相比,HCT-8/5-Fu细胞(蓝紫色)迁移数量明显增多(Fig 1B),且划痕24 h后,HCT-8/5-Fu细胞迁移能力比HCT-8/WT细胞强(Fig 1C)。以上结果说明HCT-8细胞对5-Fu的耐受性越强,其迁移能力越强。
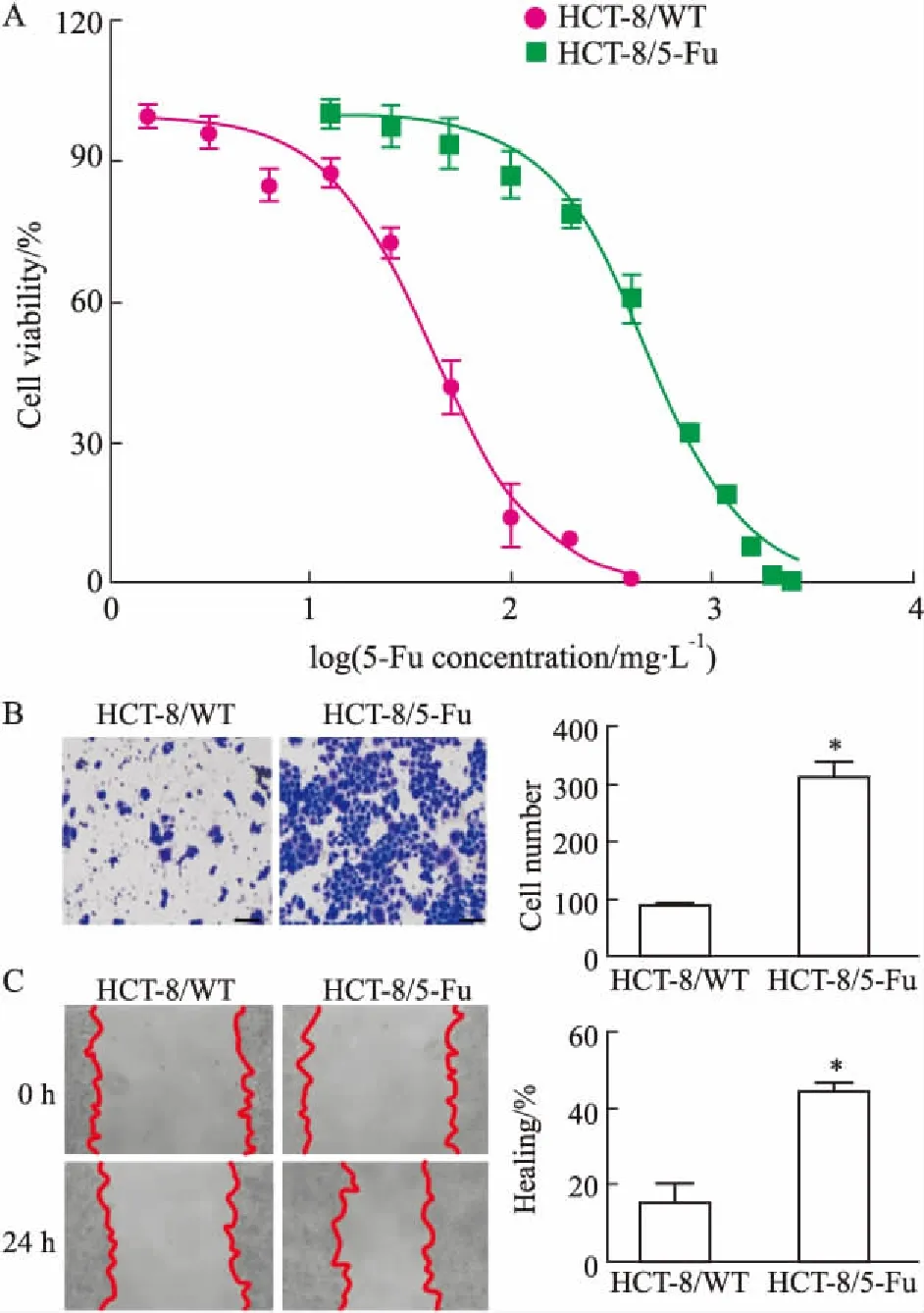
Fig 1 Effect of drug resistance of HCT-8 cells
2.2Wnt/β-catenin通路在HCT-8细胞耐药中的作用Western blot检测HCT-8/WT和HCT-8/5-Fu细胞中β-catenin、c-Myc、cyclin D1蛋白的表达。由Fig 2A可见,β-catenin在HCT-8/WT细胞中主要表达在细胞质,而在HCT-8/5-Fu细胞中主要表达在细胞核,说明β-catenin在细胞耐药的过程中发生了细胞质至细胞核的转移,且Wnt/β-catenin通路下游因子c-Myc、cyclin D1在HCT-8/5-Fu细胞中的表达水平明显高于HCT-8/WT细胞(Fig 2B)。当Wnt通路小分子抑制剂XAV939作用于HCT-8/5-Fu细胞后, HCT-8/5-Fu细胞核中β-catenin、细胞中c-Myc和cyclin D1蛋白表达量均降低(Fig 2C、2D),且HCT-8/5-Fu细胞对5-Fu的耐受性下降(Fig 2E)。以上结果说明,Wnt/β-catenin通路可能参与并介导了HCT-8细胞的耐药。
Fig 2 Effect of Wnt/β-catenin pathwayon drug resistance of HCT-8/5-Fu n=4)
2.3XAV939作用后HCT-8/5-Fu细胞迁移能力的变化由Fig 3A可见,与HCT-8/5-Fu细胞相比,HCT-8/5-Fu+XAV939细胞的迁移能力明显减弱(P<0.05),划痕实验结果也显示一致(Fig 3B),说明XAV939通过影响HCT-8/5-Fu对5-Fu的耐受性,进而影响了细胞的迁移能力。
3 讨论
自20世纪80年代以来,结肠癌在中国的发病率迅速上升[11],而肿瘤转移是导致治疗失败的主要原因之一[12]。Wnt信号通路在结肠癌的发生和转移中起着重要作用[13],同时也介导了结肠癌细胞的耐药[4]。本实验选用人结肠癌野生型细胞株HCT-8/WT和耐5-Fu人结肠癌细胞株HCT-8/5-Fu,首先探讨了两株细胞对5-Fu的耐受性,进而观察耐药的差异对细胞迁移能力的影响,结果发现HCT-8细胞对5-Fu敏感性越低,其迁移能力越强。为探讨Wnt信号通路能否影响结肠癌细胞对化疗药物的耐受性,进而对细胞的迁移能力产生影响,本研究用Western blot实验检测HCT-8/WT和HCT-8/5-Fu细胞中β-catenin、c-Myc、cyclin D1蛋白的表达水平,并在Wnt通路抑制剂XAV939处理HCT-8/5-Fu细胞后,用Western blot、MTT、Transwell和划痕实验分别检测了细胞中上述蛋白的表达水平、细胞对5-Fu的耐受性和细胞的迁移能力。结果显示,Wnt/β-catenin通路可能参与并介导了HCT-8细胞的耐药,其小分子抑制剂XAV939可通过抑制该通路,进而减弱耐药细胞的迁移。
5-Fu是治疗结肠癌最常用的药物之一,但临床上经常观察到患者对药物产生耐受性[14],延长治疗会导致高转移癌细胞的进展或复发[15]。因此,理解结肠癌耐药与转移之间的关系可以为肿瘤的治疗提供靶点。本研究发现,HCT-8细胞对5-Fu耐受性的不同会导致细胞迁移能力的差异。
Wnt信号通路参与调节了细胞的自我更新和多种器官的形成,而该通路的紊乱会导致肿瘤的形成[13]。有研究报道,Wnt/β-catenin信号通路参与了结肠癌细胞的耐药,而Wnt通路小分子抑制剂XAV939可以通过降解β-catenin,进而破坏Wnt/β-catenin信号通路[4,14-15]。本研究发现,HCT-8细胞在耐药的过程中,其细胞核中β-catenin由细胞质转移至细胞核,且下游因子c-Myc、cyclin D1蛋白表达水平升高,当XAV939作用于HCT-8/5-Fu细胞后,该细胞核中β-catenin蛋白表达减少,细胞中c-Myc、cyclin D1随之减少,并且HCT-8/5-Fu细胞对5-Fu的敏感性提高。以上结果提示,Wnt/β-catenin通路可能参与并介导了HCT-8细胞的耐药。
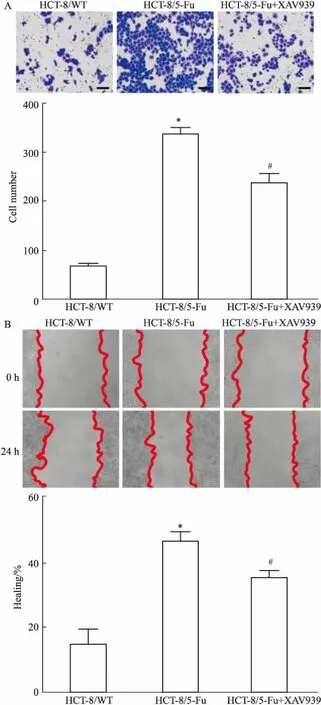
Fig 3 Effect of XAV939 on migrationability of HCT-8/5-Fu cells n=5)
有研究报道,很多物质通过Wnt信号通路影响了细胞的转移,如小GTPase超家族亚族成员RhoA蛋白的失活会导致β-catenin在细胞核中累积,增强Wnt/β-catenin信号转导,导致增殖、侵袭和去分化,促进结直肠癌的进展和转移[7]。microRNA-301a可以通过直接靶向同源性磷酸酶-张力蛋白(phosphatase and tensin homolog, PTEN),激活Wnt/β-catenin通路,调节乳腺癌的发展和转移[8]。长链非编码RNA CASC11与异构核糖核蛋白K(heterogeneous ribonucleoprotein K, hnRNP-K)相互作用,并激活Wnt/β-catenin通路,促进结直肠癌的生长和转移[9]。本研究发现,Wnt通路小分子抑制剂XAV939作用于HCT-8/5-Fu细胞后,不仅可以降低细胞对5-Fu的耐受性,而且减弱了耐药细胞的迁移能力。
综上所述,人结肠癌细胞株HCT-8对5-Fu敏感性的差异影响了细胞的迁移能力,Wnt/β-catenin通路可能介导了HCT-8/5-Fu细胞的耐药,其小分子抑制剂XAV939可减弱耐药细胞的迁移,这一结果为临床上结肠癌化疗耐药的治疗提供了新思路。