鲤春病毒血症病毒逆转录环介导等温扩增(RT—LAMP)检测方法的建立
吴业颖+张国彬

摘 要:根据鲤春病毒血症病毒(spring viraemia of carp virus,SVCV)核蛋白N编码基因的序列设计特异引物,以病毒全基因组RNA为模板,通过对反应条件进行优化,成功建立了SVCV的逆转录环介导等温扩增(RT-LAMP)检测方法。结果表明,本方法可在64℃下1h内实现目标核酸区段的大量扩增,扩增产物经凝胶电泳呈现梯形条带,反应体系中添加SYBR Green I荧光染料后,绿色阳性结果明显区别于橙色阴性结果。该检测体系具有极高的特异性,只能检测到目标病毒,与草鱼呼肠孤病毒(GCRV)和斑点叉尾鮰呼肠孤病毒(CCRV)无交叉反应,其灵敏度比RT-PCR高100倍。本研究建立的检测方法灵敏度及特异性高,且不需要昂贵仪器设备,为快速检测鲤春病毒血症病毒与诊断鲤春病毒血症提供了简捷快速的技术手段。
关键词:鲤春病毒血症病毒;逆转录;环介导等温扩增;检测
中图分类号:S941 文献标识码:A
鲤春病毒血症(spring viraemia of carp,SVC)是一种在鲤科鱼类中发生的出血性、高传染性病毒病,能感染四大家鱼和其他几种鲤科鱼类,经常在鲤科鱼类特别是鲤、锦鲤中流行,并导致患病鱼大量死亡,危害严重。该病的病原菌为鲤春病毒血症病毒(spring viraemia of carp virus,SVCV),又名鲤鱼弹状病毒(Rhabdovirus carpio),属于弹状病毒科水泡性口炎病毒属成员。历史上,该病主要流行于欧洲、中东地区和俄国,自2002年美国和2003年中国分离到该病毒的报道以来,引起了研究者及水产养殖者的广泛关注。由于该病发病快、危害大,因此快速、特异、敏感、简便的检测SVCV对鲤春病毒血症防控具有重要的意义。
目前国内外学者已建立了多种检测SVCV的方法,其中中和试验、免疫荧光(IF)、酶联免疫吸附(ELISA)等免疫学方法的特异性有待提高,而RT-PCR、实时荧光定量PCR等分子生物学方法虽然特异性强,灵敏度高,但由于需要PCR仪等贵重仪器而不适于其在基层的广泛应用。
2000年Notomi等首次提出了环介导等温扩增(Loop-ediated isothermal amplification,LAMP)技术,该技术主要针对靶基因的6个区域设计2对LAMP引物,利用一种具有链置换活性和瀑布式核酸扩增功能的DNA聚合酶(Bst DNA聚合酶),在恒温条件下快速、高效、高特异、高灵敏地扩增靶序列,不需要模板的热变性、长时间温度循环、繁琐的电泳、紫外观察等过程。逆转录环介导恒温扩增(RT-LAMP)是在常规LAMP反应体系中加逆转录酶,實现了RNA模板的一步扩增。近年来,国内外已将该技术广泛应用于动物医学、人类医学及食品卫生等领域,并逐渐成为水产动物病原的主要检测方法之一。
本文针对SVCV含量最丰富的病毒粒子蛋白-核蛋白N,建立了鲤鱼春季病毒血症病毒的环介导等温扩增快速检测方法,并对反应温度、时间等参数进行了优化,旨在为基层实验检测鲤鱼春季病毒血症病毒提供无需特殊仪器,更为简单、便捷、快速、准确的检测方法。
1 材料与方法
1.1 主要仪器与试剂
超速离心机(Beckman);分光光度计(Eppendorf);PCR扩增仪(Biometra);电泳仪;凝胶成像仪(Bio-Rad);Bst DNA聚合酶(New England);Betaine(Sigma);Trizol Reagent、RNA酶抑制剂、SYBR Green I(Invitrogen);dNTP、AMV逆转录酶(Bio basic inc.)。
1.2 细胞与病毒
草鱼肾脏组织细胞系(CIK)、斑点叉尾鮰肾组织细胞系(CCK)、草鱼呼肠孤病毒GCRV-104株、斑点叉尾鮰呼肠孤病毒730株(CCRV)、鲤春病毒血症病毒(SVCV)、鲤上皮瘤细胞(EPC)来自长江水产研究所。GCRV在CIK细胞上增殖培养,CCRV在CCK细胞上增殖培养, SVCV在EPC细胞上增殖培养。
1.3 RT-LAMP引物的设计及合成
根据GenBank公布的SVCV毒株的N基因序列(U18101),应用PrimerExplorer V4(http:// primerexplorer.jp/e/v4-manual/index.html)在线软件设计1组RT-Lamp引物,委托天一辉远生物科技有限公司合成(见表1)。1.4 病毒RNA提取
待SVCV感染的EPC细胞、CCRV感染的CCK细胞、GCRV感染的CIK细胞出现90%病变后收获,同时收获正常的EPC细胞对照,于-80℃至室温反复冻融3次,5000r/min,4℃离心30 min,取沉淀,经Trizol试剂裂解后,采用氯仿、异丙醇抽提病毒RNA,分光光度计(Eppendorf biophotometer)测定RNA浓度。
1.5 SVCV阳性模板的确认
将上述RNA作为模板,进行RT-PCR检测,确认制备的检测模板呈SVCV阳性后,进行RT-LAMP检测方法的建立。
1.6 RT-LAMP反应体系的建立及优化
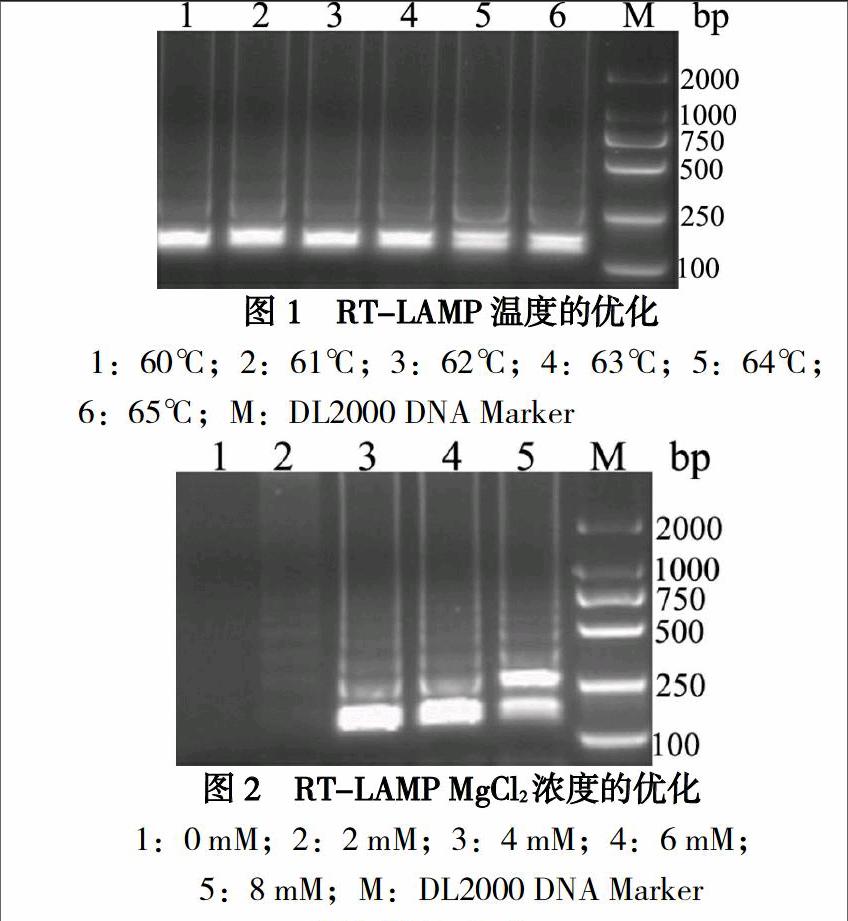
采用25μl反应体系,包括:内引物FIP和BIP各0.8μM,外引物F3和B3各0.1μM,dNTPs1mM,Betaine0.5M,DTT4mM,MgCl2,Bst DNA聚合酶8U,AMV逆转录酶5U,模板RNA5μl,1×ThermoPol Reaction Buffer混匀后于不同温度(60、61、62、63、64、65℃)温育60 min,80℃灭活2min。确定最佳温育温度后,再优化反应体系中MgCl2浓度(0、2、4、6、8mM)。
1.7 RT-LAMP扩增产物的检测
取5μl扩增产物,用2%的琼脂糖凝胶,150V电泳25min后,置于凝胶成像系统中观察。
1.8 RT-LAMP的特异性试验
检测GCRV-104株感染CIK细胞后的总RNA、SVCV感染EPC细胞后的总RNA、CCRV感染CCK细胞后的总RNA,同时设立无模板的空白对照和正常EPC细胞的总RNA阴性对照。
1.9 RT-LAMP的灵敏度试验
将提取的SVCV总RNA测其浓度,按10倍梯度稀释该RNA作为模板,采用优化好的RT-LAMP反应体系进行扩展,同时以RT-PCR方法进行比较。
2 结果
2.1 SVCV的RT-LAMP检测方法条件优化
经试验优化,确定最佳反应体系如下:内引物FIP和BIP各0.8μM,外引物F3和B3各0.1μM,dNTPs 1mM,Betaine 0.5M,DTT 4mM,MgCl2 6mM,Bst DNA聚合酶8U,AMV逆转录酶5U,模板RNA 5μl,1×ThermoPol Reaction Buffer。反应管于64℃温育1h后,80℃灭活2分钟。
2.2 RT-LAMP的特异性试验
用本实验建立的RT-LAMP(见图3)方法进行检测,只有SVCV出现典型的梯形扩增条带,而对照GCRV-104、CCRV和EPC均无扩增条带,说明设计的RT-LAMP引物具有良好的特异性。
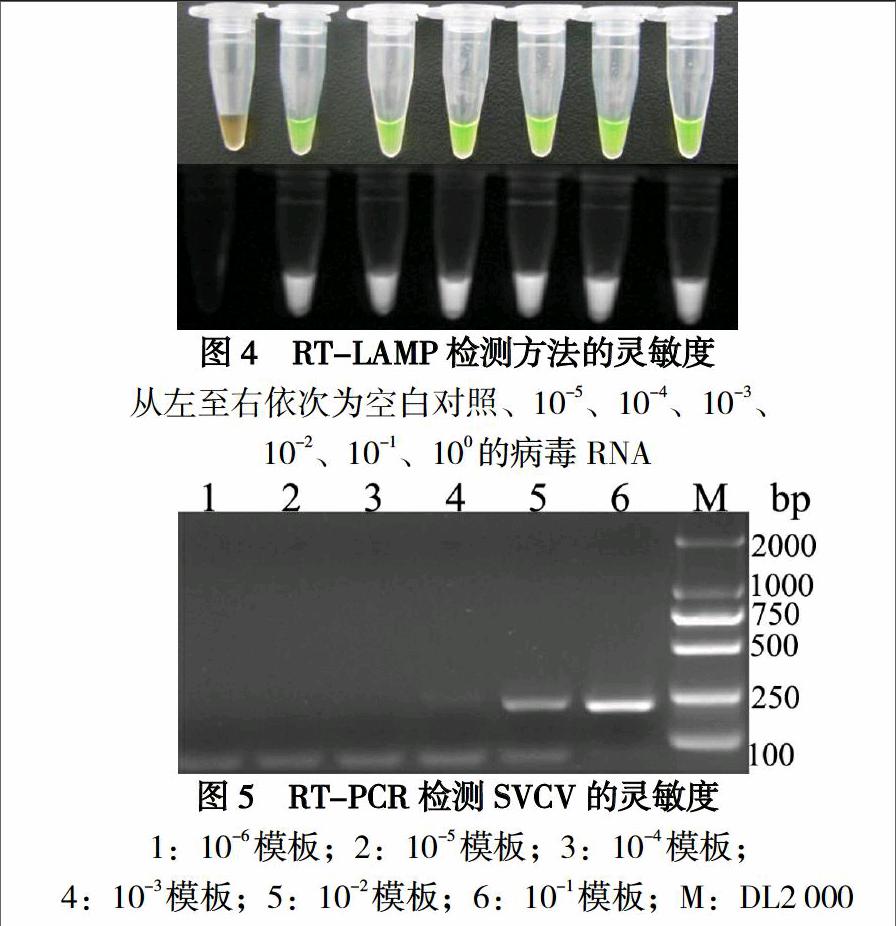
2.3 RT-LAMP和RT-PCR的灵敏度检测
将10倍系列稀释的模板分别进行RT-LAMP、RT-PCR检测,结果显示至少能够检测到10-5稀释度的模板RNA(图4),而RT-PCR只能检测到10-3稀释度的模板RNA(图5),说明RT-LAMP检测具有很高的灵敏度。
3 讨论
SVCV主要由核蛋白(N)、聚合酶(L)、磷蛋白(P)、基质蛋白(M)和糖蛋白(G)组成。其中核蛋白N是含量最丰富的病毒粒子蛋白,它与病毒RNA 相互作用形成核衣壳的双螺旋结构,在转录调节中起着重要的作用。Shivappa等和Liu等分别针对SVCV的G基因和M基因建立了病毒的LAMP检测方法。本研究针对SVCV N蛋白基因序列设计引物,为SVCV的检测提供新的靶基因。
本研究建立了1种对SVCV的LAMP快速检测方法。根据目的基因序列设计引物,合适的引物对LAMP反应的成功至关重要,特异性的区域保证了反应的特异性,引物的正确结构保证了茎环结构DNA的形成和延伸。通过对反应温度和镁离子浓度两个重要参数的优化,提高了反应灵敏度。本研究建立的反应体系在64℃恒温保持1h即可完成扩增,不需要昂贵的PCR仪,且反应时间比普通RT-PCR节省2~3h。反应后加入荧光染料SYBR Green I即可肉眼观察结果,检测灵敏度是RT-PCR方法的100倍。而且与GCRV-104、CCRV等病毒都没有交叉反应,表明设计的引物特异性好,能够满足检测需求。该方法简便快速、灵敏特异,可应用于鲤春病毒血症的现场应急诊断与检测,可为鲤春病毒血症的有效防控提供有力的技术支撐。
参考文献:
[1] Goodwin AE. First report of spring viremia of carp virus (SVCV) in North America[J].Journal of Aquatic Animal Health,2002 (3).
[2] Gao L, Shi X, Gu T, et al.Isolation of spring viraemia of carp virus(SVCV) from cultured koi(Cyprinus carpio koi) and common carp(C. carpio carpio) in P.R.China[J].BuIletin of the European Association of Fish Pathologists,2004 (4).
[3] Way K. Rapid detection of SVC virus antigen in infected cell cultures and clinically diseased carp by the enzyme-linked immunosorbent assay (ELISA)[J]. Journal of applied ichthyology,1991 (2).
[4] 高隆英,史秀杰,刘荭等.用 RT-PCR 法快速检测鲤春病毒血症病毒基因[J].水生生物学报, 2002 (5).
[5] Shivappa R B, Savan R, Kono T, et al. Detection of spring viraemia of carp virus (SVCV) by loop-mediated isothermal amplification (LAMP) in koi carp, Cyprinus carpio L[J].Journal of fish diseases, 2008 (4).
[6] Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA [J].Nucleic Acids Res, 2000 (12).
[7] Nagamine K, Hase T, Notomi T. Accelerated reaction by loop-mediated isothermal amplification using loop primers [J]. Mol Cell Probes, 2002(16).
[8] 宋克云,张如胜,欧新华等. RT-LAMP快速检测Norwalk病毒GII型[J].病毒学报, 2009 (4).
[9] 徐耀先,周晓峰,刘立德.分子病毒学[M ].武汉:湖北科学技术出版社, 2000.
[10] 付峰,刘荭,蔡生力.鲤春病毒血症病毒 (SVCV) 的研究进展[J].中国水产科学, 2006 (2).
[11] Liu Z, Teng Y, Xie X, et al. Development and evaluation of a one‐step loop‐mediated isothermal amplification for detection of spring viraemia of carp virus[J]. Journal of applied microbiology, 2008 (4).
(本文审稿 戴定兰)

