丹蛭降糖胶囊治疗肥胖引起的慢性肾病的机制研究
吴 斌,张 一,陈 勇,刘 权,李 瑞,胡冰峰,方朝晖,鲁云霞
(1.安徽医科大学生物化学教研室,安徽 合肥 230032;2.安徽卫生健康职业学院,安徽 池州 247099;3.安徽医科大学附属第一医院内分泌科,安徽 合肥 230022;4.安徽医科大学药学院临床药学专业2014级,安徽 合肥 230032;5. 安徽中医药大学附属第一医院内分泌科,安徽 合肥 230031)
慢性肾脏疾病(chronic kidney disease,CKD)是各种原因引起的慢性肾脏结构和功能障碍,其中肥胖是CKD进展的渐进性独立风险因子,但影响的具体途径尚不确切[1]。最近临床和动物实验表明,肥胖引起的CKD肾中由脂类的异位沉积、脂类代谢失调和氧化应激组成的应激信号网络共同参与CKD的发生、发展[2]。
丹蛭降糖胶囊(Danzhi Jiangtang Capsule,DJC)是安徽中医药大学第一附属医院院内制剂,由太子参、生地黄、菟丝子、牡丹皮、水蛭等药组成,具有益气、养阴、活血之功效,对2型糖尿病及其并发症有确切的疗效[3]。DJC改善糖尿病大鼠肾功能的机制可能是通过抗氧化,从而抑制 JAK2/STAT3炎症信号通路的活化,降低肾脏局部炎症因子的表达[4]。DJC也可通过下调肥胖大鼠骨骼肌细胞CD36 的表达,减轻骨骼肌脂质沉积,来改善骨骼肌胰岛素抵抗[4]。但目前关于DJC是否可作为调血脂药物,改善脂代谢紊乱和肾损伤及其机制的研究尚未见报道,因此,本文探讨DJC保护高脂血症大鼠肾损伤的作用机制,为该药用于临床治疗肥胖引起的CKD提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级SD大鼠,♂,8周龄,体质量180~200 g,购自安徽医科大学实验动物中心,生产许可证号:SCXK(皖)2006-001,适应性饲养1周。
1.1.2药物与试剂 DJC购自安徽中医药大学附属第一医院药房;RNAiso Reagent、逆转录试剂盒、Premix TaqTM购自大连宝生物工程有限公司;RIPA裂解液购自碧云天生物技术有限公司;兔抗磷酸化腺苷酸活化的蛋白激酶α(phospho-AMP-activated protein kinase α,p-AMPKα)和AMPKα单克隆抗体购自美国CST公司;兔抗过氧化物酶体增殖剂活化受体α(peroxisome proliferator-activated receptor α, PPARα)、PPARγ多克隆抗体购自美国Affinity公司;兔抗CD36多克隆抗体购自美国Santa Cruz公司;鼠抗β-actin、山羊抗鼠IgG、山羊抗兔IgG购自北京中杉金桥生物技术有限公司;ECL高灵敏度化学发光试剂盒购自美国ThermoFisher公司;甘油三酯(triglyceride,TG)、丙二醛(malondialdehyde,MDA)、总超氧化物歧化酶(total superoxide dismutase,TSOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、总一氧化氮合酶(total nitric oxide synthase,TNOS)试剂盒购自南京建成生物工程研究所。所有引物均采用Primer 5.0软件设计,由上海生工生物工程有限公司合成。
1.1.3仪器 Olympus AU640全自动生化分析仪;日本Nikon 80i荧光正置显微镜;英国Teche PCR仪;北京六一仪器厂电泳仪、电转仪;Gel Documentation system曝光系统和Chemi Scope series凝胶成像系统均购自Clinx科学仪器有限公司。
1.2方法
1.2.1动物分组与处理 将SD大鼠随机分为正常对照组(CON,n=10),高脂饮食组(HFD,n=40)。CON组喂基础饲料,HFD组喂自制的高脂饮食(由55%基础饲料、12%猪油、5%蔗糖、8%奶粉、5%花生、10%鸡蛋、3%芝麻油、2%食盐组成)。12周后,取体质量明显增加的大鼠30只,随机分为HFD组、高脂饮食+低剂量DJC治疗组(HFD+DJCL) 和高脂饮食+高剂量DJC治疗组(HFD+DJCH),每组10只。HFD组继续给予高脂饮食8周, HFD+DJCL和HFD+DJCH组在给予高脂饮食的同时,分别给予DJC 500、1 000 mg·kg-1·d-1干预8周,CON和HFD组分别灌胃等体积的蒸馏水。所有操作均遵守安徽医科大学实验动物伦理委员会要求。
1.2.2血清代谢指标分析 所有大鼠禁食12 h后称重,水合氯醛麻醉,腹主动脉取血分离血清(3 000 r·min-1,15 min),分析血清TG、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、尿素氮(blood urea nitrogen,BUN)、尿酸(uric acid,UA)、肌酐(serum creatinine,Scr)水平。
1.2.3肾匀浆TG和氧化应激指标测定 称取肾组织,冰水浴条件下,用匀浆器制备成10%的组织匀浆,4℃、3 000 r·min-1离心10 min,取上清。MDA、TSOD、CuZn-SOD、CAT、GSH-Px、TNOS测定均按照相应的试剂盒说明书进行。称取组织后,按100 g·L-1加入无水乙醇,匀浆器匀浆,4℃放置1 h,4℃、4 000 r·min-1离心15 min,取上清液进行TG的测定。
1.2.4肾脏的HE、油红O和PAS染色 将大鼠肾脏用4%的多聚甲醛溶液固定72 h,石蜡包埋,3 μm切片后行HE染色,并拍照。将-80℃冻存的肾脏取出制备冰冻切片,4%的多聚甲醛溶液固定30 min,1,2-丙二醇室温孵育2 min,油红O工作液染色60 min,苏木精染液复染后,甘油明胶封片。PAS染色按照试剂盒说明书进行,将切片用95%的乙醇固定10 min,10 g·L-1过碘酸液作用20 min,Schiff染液中染色60 min,苏木精染液复染10 min后拍照。
1.2.5肾脏免疫组化分析 石蜡包埋肾组织以4 μm连续切片,SABC法进行CD36的免疫组化分析, DAB显色,脱水、透明和封片,光镜下观察并拍照,每张切片随机选取10个视野,棕黄色颗粒区为阳性信号,并用生物图像软件计算各组免疫阳性细胞的平均光密度值(integral optical density, IOD )。
1.2.6RT-PCR RNAiso Plus提取各组大鼠肾组织的RNA,按照RT试剂盒说明书操作得到cDNA后,常规PCR反应扩增基因。PCR产物经过琼脂糖电泳后,凝胶成像系统拍照并分析灰度值。RNA的相对表达水平以目的基因灰度值与内参GAPDH的比值表示。检测的目的基因及引物序列见Tab 1。
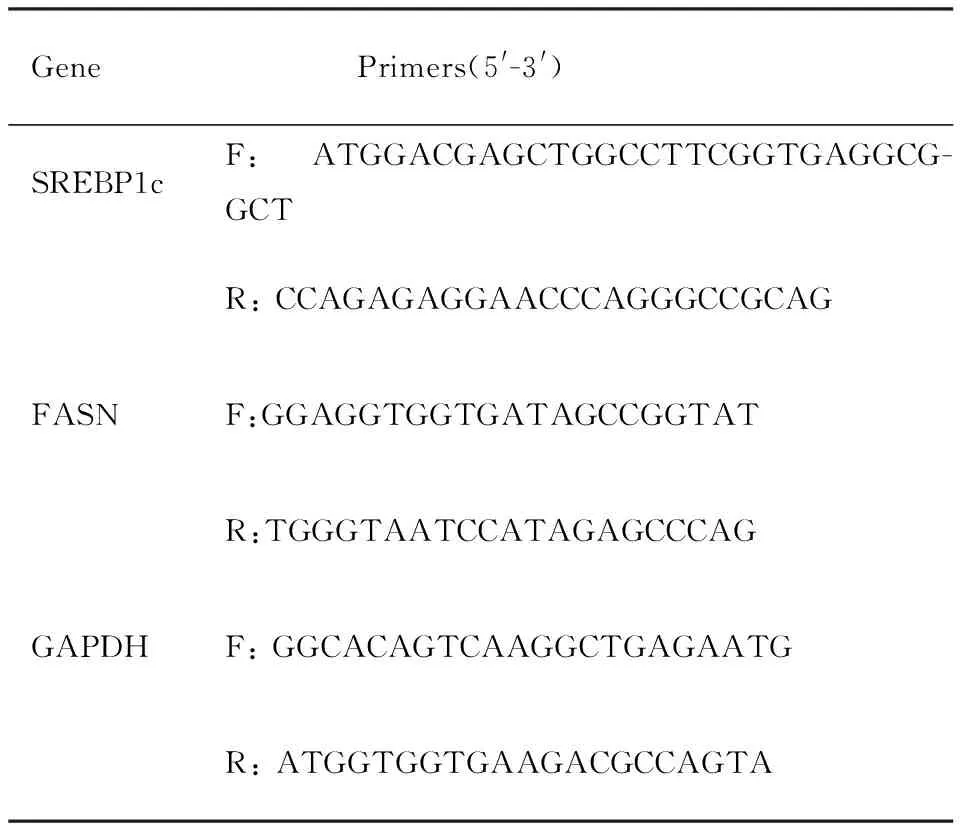
Tab 1 Primer sequences for target genes
1.2.7Western blot法检测肾组织中蛋白的表达 RIPA裂解液提取各组肾组织的蛋白质后,BCA法测定其浓度,10% SDS-PAGE电泳分离,转膜,分别以β-actin(1 ∶400)、phospho-AMPKα(1 ∶1 000)、AMPK(1 ∶1 000)、PPARα(1 ∶800)、PPARγ(1 ∶800)孵育过夜,二抗(1 ∶10 000)孵育2 h,TBST漂洗,电化学发光系统显色成像,凝胶分析软件计算目标蛋白的相对表达含量,实验重复3次。
2 结果
2.1DJC对高脂饮食大鼠体质量及血清脂代谢、肾功能的影响与CON组相比,HFD组大鼠血清TG、TC、BUN、UA、Scr浓度均升高,HDL-C浓度下降,差异有统计学意义(P<0.05或P<0.01);与HFD组相比,HFD+DJCL、HFD+DJCH组的血清TG、TC、UA、Scr水平均降低,HDL-C水平上升,差异有统计学意义(P<0.05或P<0.01),有一定的剂量效应。4组大鼠之间体质量的变化差异无统计学意义(Tab 2)。
2.2DJC对高脂血症大鼠肾匀浆TG和氧化应激指标的影响如Fig 1所示,与CON组相比,HFD组大鼠肾匀浆TG明显升高(P<0.01),而与HFD组相比,DJC 2个剂量组均可明显降低肾匀浆的TG含量(P<0.05)。与CON组相比,HFD组肾匀浆CAT、TNOS、TSOD、CuZn-SOD水平明显降低,GSH-Px、MDA水平明显上升,差异有统计学意义(P<0.05或P<0.01);DJC 组肾匀浆CAT、TNOS、TSOD、Cu Zn-SOD水平上升,GSH-Px、MDA水平明显降低,以HFD+DJCH组最为明显,并有一定的剂量效应(P<0.05,P<0.01)。见Tab 3。
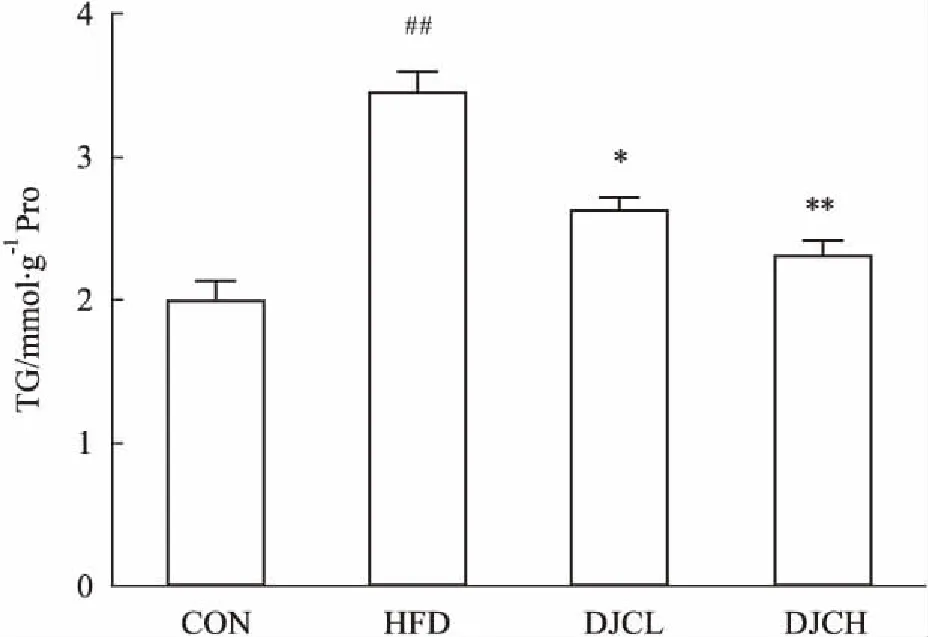
Fig 1 Effect of DJC on triglyceride levels in kidney
##P<0.01vsCON group;*P<0.05,**P<0.01vsHFD group
2.3DJC对高脂血症大鼠肾脏病理学的影响HE结果显示,与CON组对比,HFD 组大鼠肾脏的肾小球体积明显增大,系膜细胞增殖,肾小囊腔变大;DJC 治疗后肾脏的上述病变明显减轻,以HFD+DJCH组更为明显(Fig 2)。油红O结果显示,与CON组对比,HFD 组大鼠的肾小球和肾小管脂质沉积明显增多;DJC 治疗后肾小管的脂质沉积明显减轻,差异有统计学意义(P<0.05,P<0.01)。PAS染色结果显示,与CON组比较,HFD 组大鼠的肾小球系膜基质中有大量糖原沉积,而DJC 治疗组大鼠的肾小球系膜基质中的糖原含量减少,差异有统计学意义(P<0.05,P<0.01),以HFD+DJCH组病变程度更轻,有一定的剂量效应(Fig 3)。
Tab 2 Effect of DJC treatment on serum lipid and kidney metabolism
#P<0.05,##P<0.01vsCON group;*P<0.05,**P<0.01vsHFD group
Tab 3 Effect of DJC on oxidative stress indices in n=10)
#P<0.05vsCON group;*P<0.05,**P<0.01vsHFD group
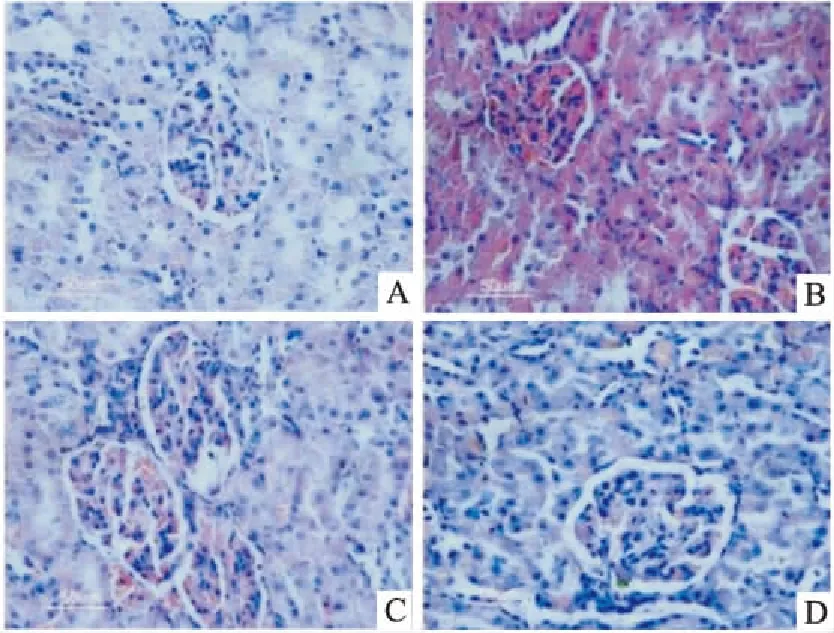
Fig 2 Effect of DJC on pathological changes in kidneyinduced by HFD(HE staining,×400)
2.4DJC对高脂血症大鼠肾脏CD36表达和定位的影响CD36主要分布在胞膜和胞质的核内体、内质网及线粒体[6]。与CON组对比,HFD 组大鼠肾脏CD36的表达明显增多,差异有统计学意义(P<0.01);DJC 治疗组肾脏CD36的表达明显降低,差异有统计学意义(P<0.01),且随着剂量的增大,CD36的表达进一步降低(Fig 4)。
2.5DJC对高脂血症大鼠肾脏脂合成基因mRNA表达的影响与CON组对比,HFD组肾脏组织中SREBP1c、FASN基因的mRNA水平表达明显上调,差异有统计学意义(P<0.01),HFD+DJC组的SREBP1c、FASN基因表达明显降低,差异有统计学意义(P<0.05,P<0.01),见Fig 5。
2.6DJC对高脂血症大鼠肾脏AMPK、PPARα、PPARγ蛋白表达的影响与CON组对比,HFD组肾脏组织中的p-AMPK、PPARα蛋白表达明显减少,PPARγ的表达明显增加,差异有统计学意义(P<0.05,P<0.01);与HFD组相比,HFD+DJC组肾脏组织p-AMPK、PPARα蛋白表达明显升高,PPARγ的蛋白水平明显降低,差异有统计学意义(P<0.05,P<0.01),且有一定的剂量效应(Fig 6)。
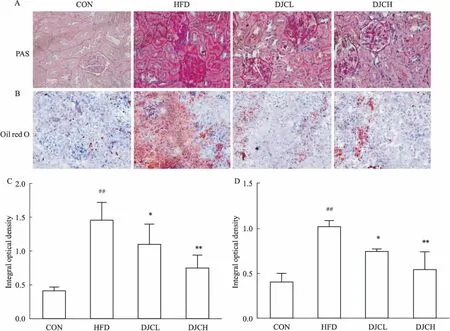
Fig 3 Effect of DJC on pathological changes in kidney induced by HFD(×400)
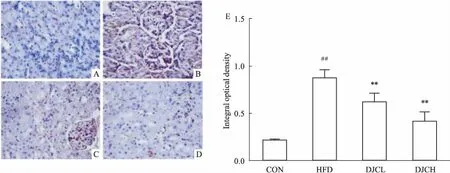
Fig 4 Effect of DJC on expression and distribution of FAT/CD36 in kidney by immunohistochemistry(×400)
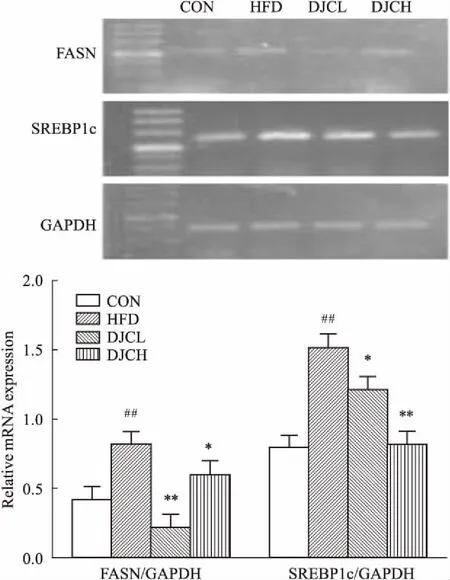
Fig 5 Effect of DJC on mRNA expression of SREBP1cand FASN in kidney by RT-PCR
##P<0.01vsCON group;*P<0.05,**P<0.01vsHFD group
3 讨论
中心性肥胖和脂代谢紊乱、高尿酸血症可引起并加重肾脏损害。在本研究中,我们应用SD大鼠高脂血症模型评价了DJC的降脂活性,并探讨了其基于AMPK信号通路的降脂作用机制。HFD组大鼠表现为高脂血症和高尿酸、肌酐、尿素氮血症,肾脏内有明显的脂质沉积;DJC治疗后,血脂、尿酸、肌酐、尿素氮和肾内脂质沉积明显降低,提示其具有改善血脂、肾功能和肾内脂质异位沉积的作用,并有一定的剂量效应。
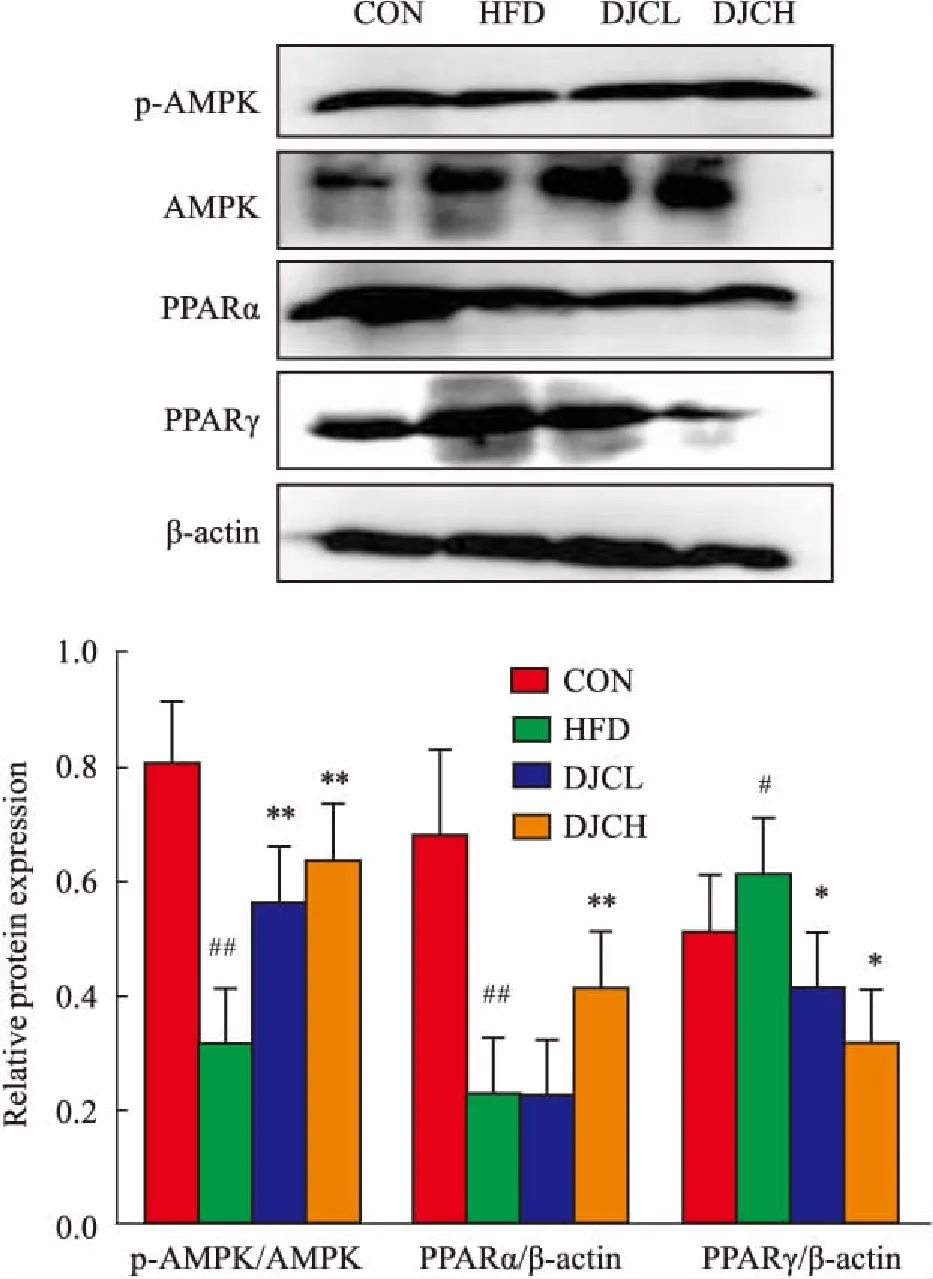
Fig 6 Effect of DJC on expression of p-AMPK/AMPK,PPARα and PPARγ in kidney by Western blot
#P<0.05,##P<0.01vsCON group;*P<0.05,**P<0.01vsHFD group
脂质在肾脏内沉积,可通过过氧化反应产生MDA和各种自由基,引起氧化应激。现代药理学研究表明,DJC组方中太子参、牡丹皮能升高SOD活性,降低MDA水平,减少氧化应激[7-8];地黄被广泛地用于滋阴养肾,其中的活性成分梓醇能降低糖尿病大鼠的血浆TC、TG水平,升高HDL-C水平,同时通过升高胰腺中SOD、GSH-Px、CAT水平,减少MDA水平来减少氧化应激[9]。因此,推测复方制剂DJC可能也有减少氧化应激的作用。本研究证实了DJC能通过增加肾脏中CAT、TSOD的表达以及激活TNOS、降低MDA水平来发挥抗氧化作用,并有一定的剂量效应。Sun等[10]的研究也证实,在糖尿病肾病模型中,DJC有抗氧化作用,与本研究的结果一致。DJC中与抗氧化作用相关的单体成分还有待进一步的分离鉴定。
CD36是介导长链脂肪酸、氧化型脂质等的结合和摄取的多功能受体。肾脏 CD36主要表达在肾小管上皮细胞、足细胞和系膜细胞中,高脂血症、高血糖和CKD患者中CD36的表达明显上调,在小鼠中阻止CD36的表达可防止CKD的进展,提示其在肾损伤中的重要作用,成为CKD的潜在治疗靶标[11]。本研究结果表明,高脂饮食确实引起了CD36在肾组织中的表达升高,这与文献报道一致,而不同剂量的DJC治疗均可减少CD36的表达,且有一定的剂量效应,提示DJC治疗CKD的作用可能与其调节CD36的表达有关。
AMPK是一种重要的细胞能量调节器,与肥胖、高脂血症、糖尿病等多种由能量代谢异常引起的疾病相关[12]。有文献报道,AMPK的激活抑制了肝SREBP1c的功能,从而抑制了肝脏脂肪的生成[13]。我们的研究则表明DJC可能通过激活高脂血症大鼠肾组织中AMPK,增加下游脂肪分解基因PPARα的表达,减少下游PPARγ、SREBP1c、FASN基因的表达,来减少肾脏脂质的沉积和减轻体重,改善肾组织内的脂代谢紊乱。
综上所述,DJC能有效降低高脂血症大鼠的血脂、肾脏TG和缓解肾脏内的氧化应激水平,并能明显改善大鼠的肾功能。机制研究表明,DJC能通过激活AMPK,进而活化下游脂肪分解基因PPARα的表达,抑制CD36和脂肪生成基因PPARγ、SREBP1c、FASN的表达,并有一定的剂量效应,这为DJC在CKD的临床治疗应用上提供了新的证据支持。
(致谢:本实验在安徽医科大学基础医学院药理学教研室、生物化学与分子生物学教研室和综合实验室完成,感谢实验室老师和同学们给予的帮助和指导!)

