迷迭香酸抑制人多发性骨髓瘤ARH-77细胞增殖的作用机制
娄 诤,赵肖涯,杜丽君,王大维
(浙江中医药大学 1. 第二临床医学院、 2. 生命科学学院、3. 基础医学院,浙江 杭州 310053)
迭香属多年生草本植物,原产地为地中海沿岸地区,三国时期传入我国。作为中药始载于《本草拾遗》,用于健脾、安神、止痛等。迷迭香的化学成分主要有酚类、萜类、黄酮类等,其应用也越来越广泛,如食品工业、香薰保健等。1958年,迷迭香酸(rosmarinic acid,RosA)被分离提纯以来,被发现有广泛的药理学作用,如抗菌、抗肿瘤、神经保护、抗抑郁等[1-6]。目前对于大多数肿瘤的治疗主要还是手术、放射疗法、化学治疗。临床应用的化疗药物大多毒副作用大,并逐渐产生耐药,因此,开发毒副作用小的有效抗肿瘤药物非常迫切。文献报道,RosA对乳腺癌、宫颈癌、结肠癌、前列腺癌等肿瘤细胞株有较好的抑制作用[4-6]。因此,RosA在抗肿瘤方面可能有较好的前景,但是RosA对人多发性骨髓瘤ARH-77细胞的作用尚未见报道。本课题以ARH-77细胞为研究对象,探讨RosA对其增殖的影响及可能机制。
1 材料与方法
1.1细胞与药物ARH-77细胞购自上海酶研生物科技有限公司,细胞用含10%胎牛血清、青霉素1×105U·L-1、链霉素100 mg·L-1的RPMI 1640完全培养基,在37℃、5% CO2饱和湿度条件下培养。RosA (纯度≥98%,HPLC)购自美国Sigma公司。RosA溶于DMSO中,配制成浓度为100 mmol·L-1的储存液,于4℃避光备用,用时以含10%胎牛血清的RPMI 1640培养基稀释。
1.2试剂胎牛血清购自美国Gemini公司;RPMI 1640培养基、青霉素/链霉素双抗购自美国Gibco公司;CCK-8试剂盒、BCA蛋白浓度测定试剂盒、PMSF、RIPA、caspase-8活性检测试剂盒,均购自碧云天生物技术有限公司;逆转录试剂盒、real-time PCR试剂盒购自TaKaRa;Annexin V-FITC/PI凋亡检测试剂盒,购自美国BD公司;引物由上海生工生物工程公司合成;抗β-actin、GAPDH、tBid、Fas、活性caspase-9的抗体,均购自英国Abcam公司。
1.3仪器Scientific Varioskan flash多功能酶标仪(美国Thermo公司);FC500流式细胞仪(美国Beckman Coulter公司);实时荧光定量PCR仪(Roche公司);Odyssey双色红外激光成像系统(LI-COR公司)。
2 方法
2.1CCK-8法检测迷迭香酸对ARH-77细胞增殖的抑制作用待ARH-77细胞处于对数生长期时,将单细胞悬液以每孔1×104个接种于96孔板。空白组为含10%胎牛血清的RPMI 1640培养基,但没有细胞。对照组为正常培养细胞,不加药。实验组的RosA终浓度分别为10、20、40、80、160、320 μmol·L-1。每组设置6个平行孔,干预的时间点分别为12、24、48 h。干预结束前1 h,加CCK-8溶液,干预结束后,于 450 nm波长检测吸光度(A450)。细胞生长抑制率= [1 -(实验组A450-空白组A450)/(对照组A450-空白组A450)]×100%。
2.2流式细胞术检测细胞凋亡取处于对数生长期的ARH-77细胞,以每孔1×106个接种于6孔板。根据增殖抑制实验的结果,将实验组设为3组,RosA的终浓度分别为20、40、80 μmol·L-1,干预时间为48 h。对照组为正常培养的细胞。干预结束后,离心收集细胞,用冷PBS洗涤2次,以100 μL 1×Binding buffer重悬细胞,每管加入FITC Annexin V 5 μL,室温避光孵育15 min,检测前每管加入PI 5 μL,1 h内检测完毕。
2.3qPCR检测凋亡相关基因mRNA的表达细胞培养、分组和干预同“2.2”。采用TRIzol法提取细胞总RNA,根据逆转录试剂盒说明书要求,将提取的总RNA逆转录成cDNA。然后以cDNA进行荧光定量PCR反应,以β-actin为内参。PCR反应体系为20 μL,反应条件:95℃预变性,5 min;95℃,10 s;58℃,30 s; 40个循环;72℃,10 min。熔解曲线初始温度为60℃,每隔30 s升高0.5℃,至95℃结束。实验组的目的基因相对于对照组的表达量,以2-△△Ct计算得出。△△Ct = (Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组。所用引物序列见Tab 1。
2.4分光光度法检测caspase-8的活性细胞培养、分组和干预同“2.2”。冰上裂解细胞提取蛋白,测蛋白浓度后,使蛋白浓度在1~3 g·L-1范围内,按照试剂盒说明书加入Ac-IETD-pNA,于37℃孵育1 h,而后于405 nm检测吸光度。按在37℃ 1 h内剪切1 nmol Ac-IETD-pNA产生1 nmol pNA的caspase-8的酶量为1个活力单位。将实验组与对照组相比,得出实验组caspase-8的相对活力。

Tab 1 Real-time quantitative PCR primers
2.5Westernblot检测凋亡相关蛋白的表达细胞培养、分组和干预同“2.2”。以GAPDH和β-actin为内参,目的蛋白为tBid、Fas、活性caspase-3和活性caspase-9。收集细胞后,加入裂解液,冰上充分裂解后,提取总蛋白。BCA法测定蛋白浓度后,加入5×上样缓冲液, 100℃ 10 min使充分变性。进行SDS-PAGE凝胶电泳、电转。封闭2 h后,加入相应的一抗4℃孵育过夜。TBST洗涤3次后,加入二抗,于室温孵育2 h,TBST再次洗涤3次后,于红外激光成像系统中扫描显影。用Image J软件分析各蛋白条带的灰度值,计算目的蛋白的灰度值与相应的内参条带的灰度值的比值。
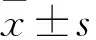
3 结果
3.1RosA对ARH-77细胞增殖的抑制作用如Fig 1所示,RosA(40~320 μmol·L-1)作用12~48 h可明显抑制ARH-77细胞的增殖,并且呈时间和剂量依赖性。

Fig 1 Inhibitory effect of RosA on proliferation

Tab 2 Apoptotic rates of ARH-77 cells induced by
*P<0.05,**P<0.01vscontrol group
3.2RosA对ARH-77细胞凋亡的影响如Fig 2、Tab 2所示,RosA(20、40、80 μmol·L-1)均能明显诱导ARH-77细胞凋亡,且均以早期凋亡为主(P<0.01)。
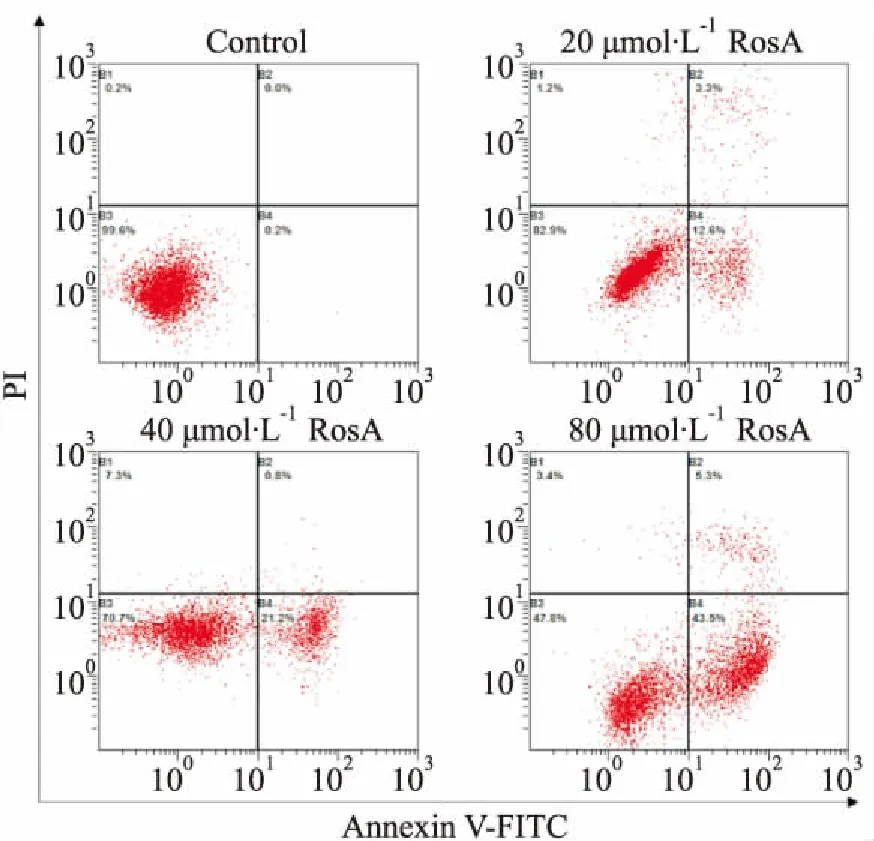
Fig 2 FCM results of RosA induced apoptosis in ARH-77 cells
3.3RosA对ARH-77细胞凋亡相关基因mRNA表达的影响如Fig 3所示,与对照组相比,caspase-8 mRNA表达在RosA(20、40、80 μmol·L-1)组均明显上调,且具有一定的剂量依赖性;RosA(40、80 μmol·L-1)组中caspase-9 mRNA表达明显上调(P<0.01,P<0.05);而Fas mRNA表达虽然随着RosA浓度的升高而升高,但仅RosA 80 μmol·L-1组与对照组比较差异有显著性(P<0.01)。
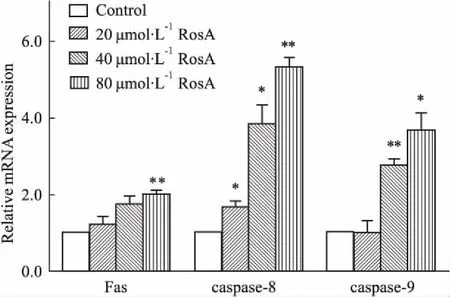
Fig 3 Effects of RosA on mRNA expression of Fas,caspase-8 and caspase-9 in ARH-77
*P<0.05,**P<0.01vscontrol group
3.4RosA对ARH-77细胞caspase-8活性的影响如Fig 4所示,ARH-77细胞caspase-8的活性随着RosA浓度的升高而升高,但是与对照组相比,仅RosA 80 μmol·L-1组差异有显著性。
Fig 4 Effect of RosA on the activity of caspase-8
**P<0.01vscontrol group
3.5RosA对ARH-77细胞凋亡相关蛋白表达的影响如Fig 5所示,与对照组相比,RosA(20、40、80 μmol·L-1)组活性caspase-3、caspase-9的水平均明显升高(P<0.01),且具有一定程度的剂量依赖性;RosA(40、80 μmol·L-1)组tBid表达明显上升(P<0.01);Fas在RosA 80 μmol·L-1组的表达明显升高(P<0.01)。
4 讨论
多发性骨髓瘤是以骨髓中浆细胞大量异常增殖为特征的一种血液系统常见恶性肿瘤,老年人多发,近年来发病率逐渐上升,且由于我国人口老龄化日益严重,此病对我国老年人健康的影响不容忽视。虽然目前针对多发性骨髓瘤的治疗手段较多,但仍无法治愈。患者年龄较高,对化疗药物的副作用难以忍受,自体干细胞移植疗法也只是使3%~10%的患者超过10年生存期[7]。因此,开发高效且毒副作用小的药物较为迫切。本研究的结果显示,RosA对人多发性骨髓瘤ARH-77细胞的增殖有较为明显的抑制作用,且在一定范围内,呈时间和剂量依赖性。Annexin V-FITC/PI双染法检测凋亡的结果显示,RosA主要引起ARH-77细胞的早期凋亡。由此推断,RosA抑制ARH-77细胞增殖的原因是诱导了早期凋亡。

Fig 5 Effects of RosA on the expression of caspase-9,caspase-3,tBid and Fas protein in ARH-77
**P<0.01vscontrol group
由于凋亡不引起机体产生明显的炎症反应,所以成为抗肿瘤药物研究的热点。文献报道,RosA衍生物可以通过PI3K/Akt和p38 MAPK信号通路,诱导胃癌MGC-803细胞凋亡[8]。本研究结果显示,RosA可上调ARH-77细胞Fas的mRNA和蛋白水平。Fas又称为CD95,是凋亡的死亡受体途径的发起者。它可与其配体FasL结合后发生三聚化,进而其胞内段的死亡结构域构象改变,与Fas相关死亡结构域蛋白的C端结合,而后者的N端可以通过死亡效应域募集procaspase-8,形成死亡诱导信号复合体[9]。随着死亡诱导信号复合体的形成,局部procaspase-8的浓度升高,procaspase-8自我催化为有活性的caspase-8。caspase-8可以催化下游的caspase,导致级联反应,使细胞凋亡[10-11]。caspase-8还可以将胞质内无活性的Bid切割成促凋亡作用很强的tBid。tBid可以通过直接结合而激活Bax和Bak,也可以通过抑制Bcl-2而间接激活Bax/Bak[12-13]。Bax/Bak在线粒体膜发生寡聚化形成孔道,使线粒体内容物释放,导致caspase-9的激活,进一步引发线粒体途径的凋亡[14-15]。本研究结果显示,RosA可使ARH-77细胞中tBid和活性caspase-9的蛋白水平明显升高,caspase-8的活性也明显升高。由此推测,RosA诱导了ARH-77细胞凋亡的死亡受体途径,也许由tBid又引发了线粒体途径。
综上所述,RosA诱导早期凋亡,抑制了ARH-77细胞增殖,其机制可能由于RosA上调了Fas的表达,引发了凋亡的死亡受体通路,其间发生了caspase-8的活化,进而使Bid被切割成活性较高的tBid。或许由于tBid而诱发了线粒体凋亡途径,使caspase-9活化。死亡受体途径和线粒体途径共同参与了RosA诱导的ARH-77细胞凋亡。然而本课题中,caspase-9的活化是否仅依赖于tBid的诱发,以及caspase-9活化和caspase-8活化的相互关系等,有待于进一步的研究,为RosA治疗多发性骨髓瘤提供更加详实的理论依据。
(致谢:本实验于浙江中医药大学基础医学院中医临床基础研究所完成,感谢研究所的老师和同学的指导和帮助。)

