大鼠背根神经节细胞中TRPV1与cAMP/PKA通路调控机制研究
高 峰,卢伟龙,王华林,吴媛媛,王 斌,李 敏
(陕西中医药大学药学院,陕西 西安 712000)
瞬时受体电位通道(transient receptor potential canonical,TRP)是一类重要的阳离子通道。辣椒素受体(transient receptor potential vanilloid 1,TRPV1)是TRP家族通道蛋白之一,为热敏感蛋白,可被高于42℃的温度、炎症、疼痛、辣椒素等体内多种因素激活[1-2],主要存在于中枢神经系统及末梢神经系统上。TRPV1目前在疼痛、炎症、中医寒热病证、中药寒热药性等方面有重要意义[3-4]。TRPV1蛋白后期的磷酸化对其功能的发挥至关重要,有研究表明,cAMP/PKA通路可促进TRPV1的磷酸化,使其激活[5-6]。另有研究发现,TRPV1活化后,促进cAMP含量升高[3],两者之间的调控作用尚不明确。课题组前期研究表明,体内cAMP/PKA信号通路的磷酸化水平与TRPV1的蛋白表达有一定相关性[7]。因此,本研究通过体外细胞实验,分别应用两者的激动剂和抑制剂干预,进一步探讨TRPV1与cAMP/PKA信号通路之间的调控作用。
1 材料
1.1实验动物新生大鼠购自第四军医大学实验动物中心,动物合格证号:SCXK(军)2012-0007。
1.2试剂胎牛血清(fetal bovine serum,FBS)、DMEM/F12培养基购自Hyclone;TRIzol(货号15596-026)购自无锡菩禾;逆转录试剂盒(货号#K1622)购自Thermo公司;cAMP/PKA信号通路激动剂8-Br-cAMP(货号ab141449)、抑制剂H-89(货号ab143787)、TRPV1激动剂辣椒素capsaicin(货号ab140100)、抑制剂i RTX(货号ab146031),均购自Abcam公司。
1.3仪器Thermo Scientific 8000细胞培养箱(美国赛默飞世尔公司);XDS-1A光学显微镜(上海精密仪器仪表有限公司);DMI3000B倒置拍照显微镜、TCS SP5 II共聚焦显微镜(德国Leica公司);ABI-7500 Real-time检测仪(ABI公司);Mini protean 3 cell电泳仪(美国Bio-Rad公司);ChemiScope一体式化学发光成像仪(上海勤翔科学仪器有限公司)。
2 方法
2.1大鼠背根神经节(dorsalrootganglion,DRG)细胞的分离与鉴定参考文献[8],新生大鼠注射15%水合氯醛处死,放入低温的DMEM不完全培养液,大鼠死后,快速分离脊髓,摘取DRG并剪碎,放入含胶原酶的DMEM/F12培养基中60~90 min。再置于含0.125%胰蛋白酶的磷酸缓冲盐 (phosphate buffer saline,PBS)溶液中15 min。用含10% FBS的DMEM/F12培养基终止消化,获取的细胞接种于神经细胞完全培养基中,d 2换液继续培养。细胞传代24 h,4%多聚甲醛固定,加入神经元特异性烯醇化酶(neuron-specific enolase,NSE),室温封闭15 min。加入对应二抗,37℃孵育1 h,洗涤,Hoechst 33258染液,室温避光孵育30 min。细胞于荧光显微镜下观察,随机计数10个视野中细胞总数和β-tubulin Ⅲ的染色阳性细胞数,计算百分比,表示细胞纯度。
2.2MTT法检测8-Br-cAMP、H-89、capsaicin、iRTX对大鼠DRG细胞的影响大鼠DRG细胞生长至对数生长期,以5×107·L-1浓度接种至24孔细胞培养板,37℃、5% CO2培养24 h。分为正常对照组、8-Br-cAMP组(200、100、50、25、12.5、6.25 μmol·L-1)、H-89组(160、80、40、20、10、5 μmol·L-1)、capsaicin组(80、40、20、10、5、2.5 μmol·L-1)、i RTX组(16、8、4、2、1、0.5 μmol·L-1),分别加入含药的无血清培养基,每孔加100 μL,设4个复孔,培养48 h,每孔加MTT溶液 20 μL,孵育4 h,终止培养,小心吸弃孔内培养上清液。每孔加150 μL DMSO,微量振荡器振荡10 min,使结晶物充分溶解,选择570 nm波长,酶标仪测定各孔光吸收值。
2.38-Br-cAMP、H-89、capsaicin、iRTX对大鼠DRG细胞TRPV1、p-PKA作用研究大鼠DRG细胞以5×107·L-1浓度,接种于12孔板,分正常对照组(control)、8-Br-cAMP 50 μmol·L-1组、H-89 20 μmol·L-1组、capsaicin 25 μmol·L-1组、i RTX 2 μmol·L-1组,每组设4 个复孔,重复3次,培养48 h 后收集细胞,检测TRPV1、p-PKA基因、蛋白表达。
2.48-Br-cAMP、H-89、capsaicin、iRTX对大鼠DRG细胞TRPV1、p-PKAmRNA表达的影响定量PCR检测TRPV1、p-PKA mRNA,所需的引物序列见Tab 1。①RNA的抽提;②逆转录cDNA:逆转录反应体系的配制;将试剂盒从-80℃冰箱取出,复溶,将5×逆转录buffer、dNTPs、 oligo(d T) 10 000 r·min-1,数秒。将经过稀释后的RNA样本进行定量PCR检测。mRNA表达的数据采用仪器自带软件ABI Prism 7500 SDS Software分析。PCR扩增后,实时荧光定量PCR仪自动分析结果,根据阴性对照调整阈值和基线以确定各标本的Ct值,并根据熔解曲线确定该Ct值是否有效。将结果导出,采用2-△△CT法分析目的基因在对照组和各浓度组之间的表达差异,计算公式如下:△Ct= Ct目的基因-Ct内参,再求得对照组△Ct的平均值,记为△Ct对照平均,用各组的△Ct分别减去△Ct对照平均,求得△△Ct值,即△△Ct=△Ct样本-△Ct对照平均,再计算各组2-△△CT值,即为各组中基因的相对表达量。

Tab 1 Required primer sequence
2.58-Br-cAMP、H-89、capsaicin、iRTX对大鼠DRG细胞TRPV1、p-PKA蛋白表达的影响收集细胞,每组分别加入500 μL的RIPA裂解液,并加入适量的PMSF,置冰上裂解2 h;4℃、12 000 r·min-1离心10 min;移上清于新的EP管中,进行蛋白质定量后贮存于-20℃冰箱。蛋白定量后,SDS-PAGE电泳、转膜。膜用5%脱脂奶粉室温封闭1 h。抗体加入封闭液中稀释到所需浓度,4℃孵育过夜。TBST洗涤3次,每次10 min。加入相应二抗,与膜37℃孵育1 h。用TBST洗涤3次,每次10 min。显色,一体式化学发光仪拍摄照片。蛋白表达水平用目的条带积分吸光度值(integrated absorbance,IA) 与内参 β-actin条带的 IA 比值表示。
3 结果
3.1DRG神经元形态学特征Fig 1相差显微镜观察,可见DRG细胞神经元胞体有一定透亮度和折光性,突起分支十分茂密,可见少量神经胶质细胞及细胞碎片,少量非神经元细胞核。DRG神经元纯度结果显示,DRG神经元β-tubulin Ⅲ阳性细胞比例达到81%,细胞分离培养效果良好。
3.28-Br-cAMP、H-89、capsaicin、iRTX对大鼠DRG细胞的影响由Tab 2可知,与正常对照组比较,8-Br-cAMP 200 μmol·L-1、H-89 160 μmol·L-1、capsaicin 200 μmol·L-1、i RTX 16、8 μmol·L-1使细胞增殖明显降低(P<0.05,P<0.01),故选择8-Br-cAMP 50 μmol·L-1、H-89 20 μmol·L-1、capsaicin 25 μmol·L-1、i RTX 2 μmol·L-1对细胞没有损害的浓度作为后续实验浓度。
3.38-Br-cAMP、H-89、capsaicin、iRTX对TRPV1、p-PKAmRNA表达的影响Tab 3结果显示,与正常对照组比较,8-Br-cAMP、capsaicin可明显促进TRPV1 mRNA的表达(P<0.01),i RTX可明显降低TRPV1 mRNA表达(P<0.01),H-89对TRPV1 mRNA表达的影响不明显;8-Br-cAMP可促进p-PKA mRNA的表达,H-89可降低p-PKA mRNA表达(P<0.05);capsaicin、i RTX对p-PKA mRNA表达的影响不明显。
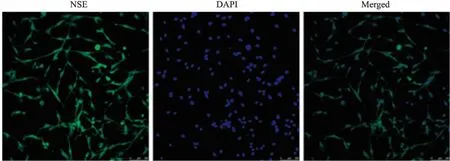
Fig 1 Dorsal root ganglion cells of rats(scale bar=50 μm)
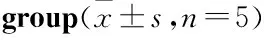
Tab 2 Cell proliferation rate in each
*P<0.05,**P<0.01vscontrol
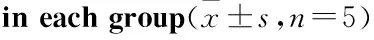
Tab 3 Expression of TRPV1 and p-PKA mRNA
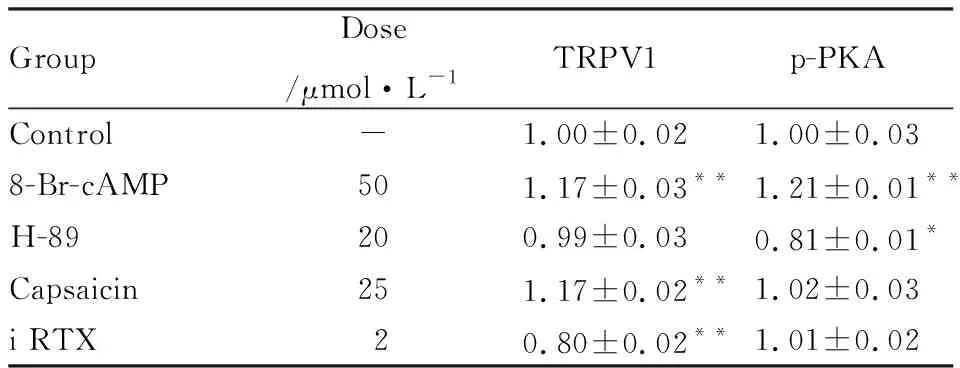
GroupDose/μmol·L-1TRPV1p-PKAControl-1.00±0.021.00±0.038-Br-cAMP501.17±0.03**1.21±0.01**H-89200.99±0.030.81±0.01*Capsaicin251.17±0.02**1.02±0.03i RTX20.80±0.02**1.01±0.02
*P<0.05,**P<0.01vscontrol
3.48-Br-cAMP、H-89、capsaicin、iRTX对p-PKA、TRPV1蛋白表达的影响与正常对照组比较,8-Br-cAMP、capsaicin可明显促进TRPV1蛋白的表达(P<0.01),i RTX可明显降低TRPV1蛋白表达(P<0.05),H-89对TRPV1蛋白表达的影响不明显;8-Br-cAMP可促进p-PKA蛋白的表达,H-89可降低p-PKA蛋白表达,差异均有统计学意义(P<0.05);capsaicin、i RTX对p-PKA蛋白表达的影响不明显(Fig 2)。
4 讨论
TRP是一类重要的阳离子通道,在TRP通道中,感受温度变化及参与体温调节的有多个家族和通道蛋白,其中热敏感通道蛋白TRPV1分布广泛,是具有多功能的细胞感受器。TRPV1可被体内外多种物理化学因素激活,如伤害性热刺激、低pH值(酸性环境)、炎症、疼痛、辣椒素等。在疼痛的感知与调节、体温感知与调节、炎症的发生及中医寒热病证、中药寒热药性等方面研究中,TRPV1起着重要作用[7]。因此,探讨TRPV1体内的调控机制,有非常重要的意义。在TRPV1的活化中,磷酸化起着重要作用。Schnizler等[9]证实,PKA磷酸化作用增敏TRPV1通道由A激酶锚定蛋白AKAP150 所介导。Bhave等[10]在转染TRPV1的cos7细胞中,给予辣椒素连续刺激后,产生急性脱敏现象;用8-Br-cAMP温育cos7细胞后,再给予辣椒素刺激,无急性脱敏现象;将PKA抑制剂与8-Br-cAMP一起温育cos7细胞,辣椒素刺激后,脱敏现象重新出现。还有研究表明,TRPV1的增强可促进cAMP的含量。可见cAMP/PKA信号通路引发的细胞磷酸化与TRPV1活化之间关系密切,TRPV1生理病理功能与cAMP/PKA通路的调控相关联。课题组前期研究表明,辛热药提高虚寒机体TRPV1活性同时,可上调机体cAMP/PKA信号通路。本实验从体外进一步探讨体内cAMP/PKA信号通路与TRPV1的调控关系,对TRPV1相关病症的研究有重要作用。
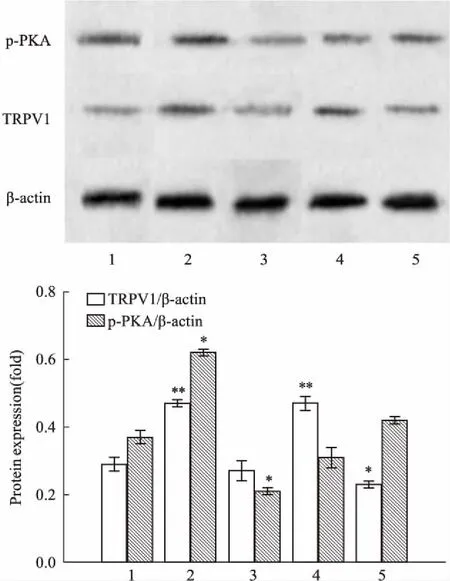
Fig 2 Expression of p-PKA, TRPV1 in different groups
1: Control;2: 8-Br-cAMP(50 μmol·L-1);3: H-89(20 μmol·L-1);4: Capsaicin(25 μmol·L-1);5: i RTX(2 μmol·L-1).*P<0.05,**P<0.01vscontrol.
实验中采取胶原酶、胰酶消化分离DRG细胞的方法较为成熟,分离出的细胞形态较为完整,活性较强,纯度较高。应用cAMP/PKA通路激动剂8-Br-cAMP、抑制剂H-89和TRPV1的激动剂辣椒素、抑制剂i RTX进行干预。实验结果表明,8-Br-cAMP 和H-89可明显上调或降低p-PKA基因、蛋白表达;capsaicin、i RTX可明显上调或降低TRPV1基因、蛋白表达;capsaicin、i RTX对p-PKA基因、蛋白的表达无明显影响,8-Br-cAMP可促进TRPV1的基因、蛋白的表达,H-89则对TRPV1的基因、蛋白的表达无明显影响。可见,TRPV1的激活或抑制对cAMP/PKA信号通路无明显影响,而cAMP/PKA信号通路激活可活化TRPV1,cAMP/PKA信号通路抑制时,对TRPV1基因、蛋白表达影响不大,可能除了cAMP-PKA信号通路可调控TRPV1的表达外,还存在其他信号通路对TRPV1也有一定调控作用,具体的调控机制还需在后期进一步深入研究。
(致谢:本实验在陕西中医药大学医学实验中心完成,感谢参与完成实验的课题组成员。)

