苦参碱联合黄芩苷对LPS诱导小鼠肺炎的影响
王 芳,孙耀贵,尹 伟,范阔海,段智变,孙 娜,李宏全
(山西农业大学动物科技学院,山西 太谷 030801)
苦参碱和黄芩苷分别是从苦参和黄芩中提取的天然化合物,二者分别属于生物碱类和黄酮类。已有大量文献表明苦参碱和黄芩苷均具有抗炎作用,如Wu等[1]的研究已证明苦参碱可以抑制脂多糖(lipopolysaccharide,LPS)诱导的肠炎和氧化应激,抑制炎症因子白细胞介素1β(interleukin 1β,IL-1β)和白细胞介素17(interleukin 17,IL-17)的分泌,且已证实是通过CCR7通路发挥其抗炎作用。黄芩苷能明显减弱滑膜组织中成纤维细胞的增殖及炎性损伤程度,降低滑膜组织中Toll样受体2(Toll-like receptor 2,TLR2)和髓样分化因子88(myeloid differentiation factor 88,MyD88)的表达[2],也可以有效减轻肝损伤引起的氧化应激和炎症因子的产生[3]。本实验室前期研究表明,苦参碱对猪蓝耳病毒和圆环病毒共感染引起的小鼠间质性肺炎有缓解作用[4]。虽然研究已表明苦参碱[5]和黄芩苷[6]有抑制肺炎作用,但对二者的联合作用并未进行研究。联合用药可以提升药效或减少用药量,并可通过作用多靶点来发挥药效,降低抗药性。本实验以LPS诱导的小鼠肺炎为模型,考察苦参碱和黄芩苷联合用药的效果,为苦参碱和黄芩苷组方提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级♀昆明小鼠(合格证号:11400777254421),体质量18~22 g,由北京维通利华实验动物有限公司提供。饲养于标准条件下(温度23~25 ℃,相对湿度40%~70 %,12 h光/暗周期),通风良好的动物房。实验前7 d,小鼠自由采食,以适应环境。
1.1.2药物与试剂 LPS(大肠杆菌055 ∶B5)购自Solarbio公司;苦参碱和黄芩苷购自南京泽朗生物科技有限公司,浓度≥98%。DMEM高糖培养基购于Hyclone公司;小鼠白细胞介素6(interleukin 6,IL-6)ELISA试剂盒、小鼠肿瘤坏死因子α(tumor necrosis factor α,TNF-α)ELISA试剂盒,购于上海蓝基生物科技有限公司;TRIzol试剂盒购于Biomiga公司;两步法反转录试剂盒购于TaKaRa公司;DNA Marker购于中科瑞泰(北京)生物科技有限公司;引物由北京擎科新业生物技术有限公司合成;髓过氧化物酶(myeloperoxidase,MPO)测试盒购于南京建成生物工程研究所。
1.1.3仪器 ND-1000核酸蛋白浓度测定仪(美国NanoDrop);DYY-7型转移电泳仪(北京市六一仪器厂);7500定量PCR仪(美国ABI公司);光学显微镜(日本Olympus公司);UV 2800双光束紫外分光光度计(上海奥谱勒仪器有限公司);Spectra Max M5多功能酶标仪(美国Molecular Devices公司)。
1.2方法
1.2.1药物配制 称取适量的苦参碱和黄芩苷,用DMEM培养基将苦参碱和黄芩苷溶解到终浓度为30 mg·kg-1和200 mg·kg-1,然后将二者的混合物进行连续的2倍稀释,配成中剂量和低剂量。之后将配好的药物溶液置37℃水浴锅备用。
1.2.2动物分组与模型制备 将42只小鼠随机分为7组(n=6),具体分组为:空白组、LPS组、苦参碱(30 mg·kg-1)组、黄芩苷(200 mg·kg-1)组、联合高剂量组(苦参碱30 mg·kg-1+黄芩苷200 mg·kg-1)、联合中剂量组(苦参碱15 mg·kg-1+黄芩苷100 mg·kg-1)、联合低剂量组(苦参碱7.5 mg·kg-1+黄芩苷50 mg·kg-1)。采用腹腔注射LPS的方法制备小鼠肺炎模型。实验组腹腔注射LPS 20 mg·kg-1(0.01 mL·g-1),空白组腹腔注射等体积的PBS。加药组于造模后30 min腹腔注射药物,空白组和LPS组腹腔注射等体积的DMEM。LPS刺激24 h后,摘眼球放血致死,采集全肺。
1.2.3肺组织病理学观察 取左肺大叶组织,切两半,用苦味酸溶液固定24 h后,脱水、透明、石蜡包埋,行5 μm厚切片,然后进行苏木精-伊红(hematoxylin-eosin,HE)染色,光镜下观察小鼠肺组织的病理形态学变化。
1.2.4血清TNF-α、IL-6的测定 眼球取血后,4℃过夜,3 000 r·min-1、4℃离心10 min,收集血清,于-80 ℃保存。采用ELISA法,按试剂盒说明书检测TNF-α、IL-6浓度。终止反应后,将酶标板放入酶标仪槽内,选择450 nm波长检测,确定标准品和空白对照区域,检测相应的光密度(optical density,OD)值,然后绘制标准曲线并计算相应的浓度。
1.2.5qPCR测定小鼠肺组织中IL-6、TNF-α mRNA表达量 取-80℃冻存的右下肺组织放到研钵中,充分碾磨后,加入1 mL裂解液,按步骤提取总RNA,测定样品A260/A230和A260/A280。反转录后使用qPCR仪进行扩增,每个样品平行设置3个复孔,引物序列见Tab 1。采用ΔΔCt法,以β-actin基因为内参,对各样本IL-6、TNF-α mRNA进行相对定量分析,计算RQ值(2-ΔΔCt)。
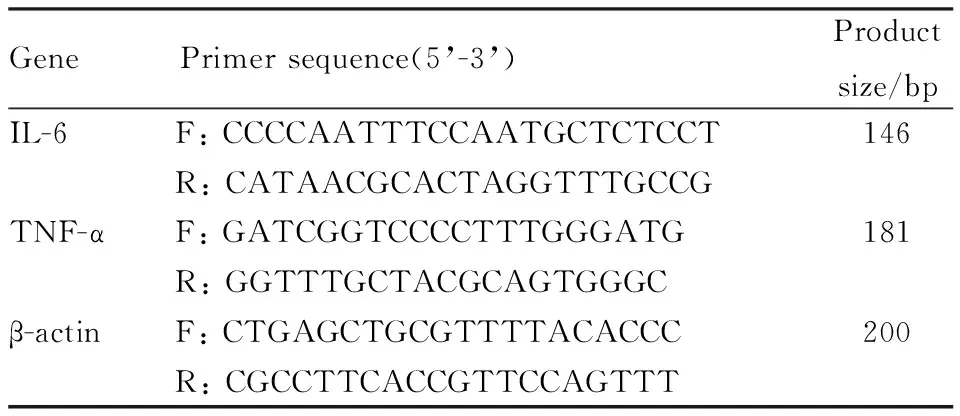
Tab 1 Primer sequences and product size
1.2.6小鼠肺组织MPO活性测定 采用MPO检测试剂盒。取右上肺,肺组织称重,剪切,匀浆。对照管加3 mL双蒸水、0.2 mL试剂四、0.2 mL样本;测定管加3 mL显色剂、0.2 mL试剂四和0.2 mL样本。混匀,37℃水浴30 min。之后,每管加0.05 mL试剂七。混匀,60 ℃水浴10 min,取出后立即在460 nm处,1 cm光径,双蒸水调零,测各管吸光度值。并根据说明书对MPO活性进行分析。计算公式如下:

2 结果
2.1小鼠一般情况空白组小鼠表现正常,活泼,反应灵敏;模型组小鼠腹腔注射LPS后,反应变迟钝,行动缓慢,饮食减少,被毛竖起,呼吸加快,全身颤抖,抱团。各给药组与LPS组小鼠相比,精神状态较好,活动量增多,饮食量也增加,整体状态比LPS组好。
2.2肺组织切片病理形态学变化Fig 1的小鼠肺组织切片HE染色显示,空白组小鼠肺组织结构清晰,肺泡结构完整,肺泡腔内无分泌物和炎性细胞浸润,肺泡壁厚度正常。LPS组小鼠肺组织病变严重,发生实变,结构不清晰,肺泡腔里有炎性细胞浸润和红细胞渗出,肺泡间隔增厚,血管充血。给药组与LPS组相比,肺组织病变明显改善,肺泡壁变薄,肺泡腔炎性细胞减少,充血现象也有所减轻,与空白组相比肺泡壁仍厚。
2.3各处理组对小鼠血清IL-6、TNF-α水平的影响如Fig 2所示,与空白组相比,LPS组血清中IL-6、TNF-α水平明显升高(P<0.01),各给药组与空白组相比,IL-6和TNF-α水平没有明显差异。与LPS组相比,各给药组IL-6水平差异无显著性,但是有降低趋势;黄芩苷组、联合高、中剂量组与LPS组相比,TNF-α水平明显降低(P<0.05),而苦参碱组和联合低剂量组与LPS组相比TNF-α水平差异无显著性,但有降低趋势。各用药组间相比,IL-6和TNF-α水平差异无显著性。
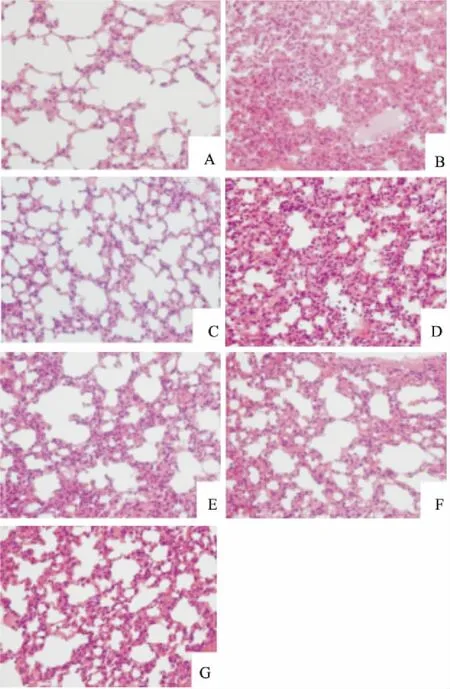
Fig 1 Observation of histopathological changes in lungtissues of different treatment groups (×400)
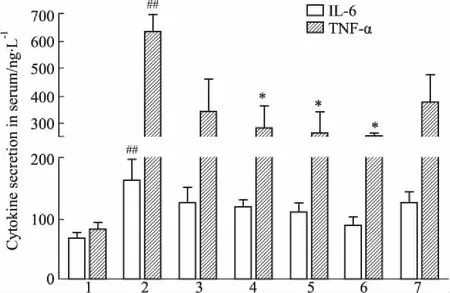
Fig 2 Effects of different treatment on IL-6 andTNF-α secretion in serum n=6)
1:Control group;2:LPS group;3:Matrine group;4:Baicalin group;5:Combined high dose group;6:Combined medium dose group;7: Combined low dose group.##P<0.01vscontrol group;*P<0.05vsLPS group.
2.4各处理组对小鼠肺组织IL-6、TNF-αmRNA表达的影响如Fig 3所示,与空白组比较,LPS组IL-6和TNF-α mRNA的表达量明显升高(P<0.01)。与LPS组相比,各给药组均明显降低IL-6、TNF-α mRNA的表达量(P<0.01),且各用药组间相比,IL-6和TNF-α mRNA的表达量差异无显著性。
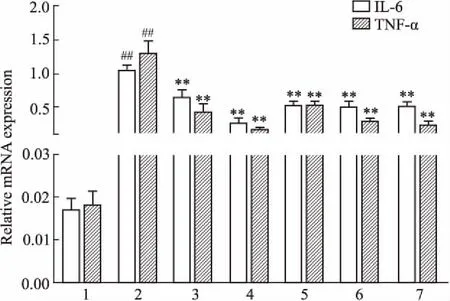
Fig 3 Effects of different treatment on IL-6 and TNF-α mRNAexpression of lung tissues n=6)
1:Control group;2:LPS group;3:Matrine group;4:Baicalin group;5:Combined high dose group;6:Combined medium dose group;7: Combined low dose group.##P<0.01vscontrol group;**P<0.01vsLPS group.
2.5各处理组对小鼠肺组织MPO活性的影响如Fig 4所示,与空白组比较,LPS组MPO活性明显升高(P<0.01);与LPS组相比,各给药组均明显降低肺组织MPO活性(P<0.05,P<0.01),且各用药组间差异无显著性。
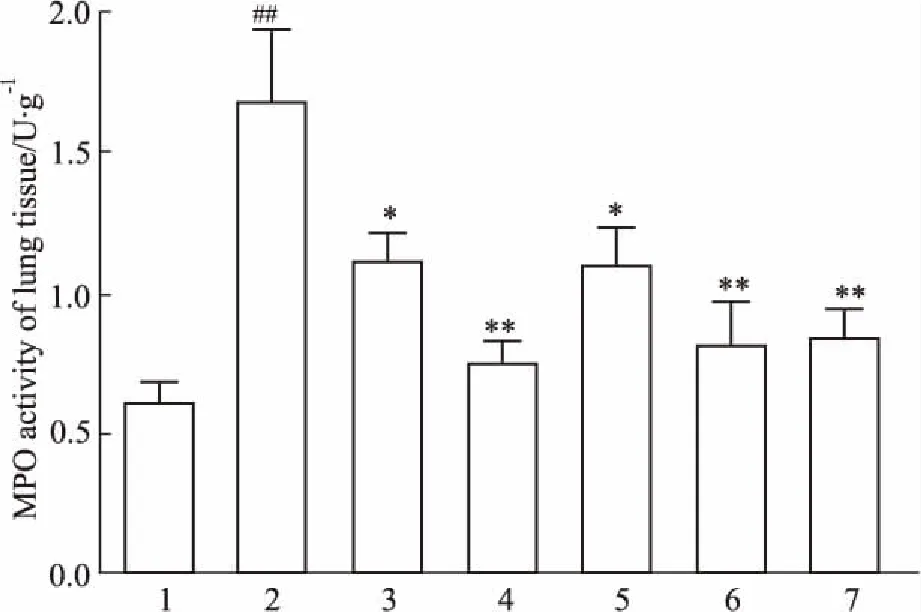
Fig 4 Effects of different treatment on MPOactivities of lung tissues n=6)
1:Control group;2:LPS group;3:Matrine group;4:Baicalin group;5:Combined high dose group;6:Combined medium dose group;7: Combined low dose group.##P<0.01vscontrol group;*P<0.05,**P<0.01vsLPS group.
3 讨论
急性肺损伤(acute lung injury,ALI)是临床上最常见的呼吸系统疾病,主要发生在肺泡和肺实质,以肺水肿为主要特征,急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是其严重形式[7]。很多研究者通过LPS制备肺炎模型,LPS进入机体后,可以使肺组织中大量炎性细胞趋化、迁移,最终发生浸润,引起炎性介质的过度表达,最终导致ALI。Zeng等[8]用LPS制备的小鼠肺炎模型,表现为肺泡隔内有炎性细胞浸润,主要以嗜中性粒细胞为主,肺泡间隔出现不同程度的增厚,血管充血。本实验通过腹腔注射LPS制备小鼠肺炎模型,病理学观察显示,与空白组相比,模型组小鼠表现出特征性的肺组织病变,大量炎性细胞浸润,充血,肺泡间隔增厚,成功建立了小鼠肺炎模型。用药组与LPS组相比,肺部炎症均有所改善,肺组织肺泡间隔变薄,充血现象减轻,说明黄芩苷、苦参碱及其二者的联合均表现出很好的抗炎作用。
在ALI中,LPS可诱导大量的炎症因子产生,并参与肺损伤的进程。TNF-α主要由单核细胞和巨噬细胞产生,在急性和慢性炎性疾病早期是一种重要的促炎细胞因子,可诱导循环中性粒细胞黏附于血管内皮,促进中性粒细胞迁移并浸入支气管肺泡腔,使其激活和脱颗粒,产生氧自由基,释放颗粒酶[9]。IL-6也是由LPS刺激巨噬细胞产生的一种重要的炎性细胞因子。汪雪峰等[10]研究表明,莰醇可以降低血清中TNF-α、角化生长因子、IL-1β和IL-6的含量,起到改善肺炎的作用。Espírito-Santo等[11]研究表明,在小鼠足炎模型中,布拉易林可以抑制促炎因子IL-1β、IL-6和TNF-α的产生,达到抑制炎症的作用。本实验结果显示,模型组(LPS组)促炎因子IL-6和TNF-α水平明显高于空白组,说明LPS引起了小鼠肺部的炎症反应。与LPS组相比,苦参碱组、黄芩苷组、联合高、中、低剂量组明显降低IL-6、TNF-α mRNA的相对表达量,说明各用药组均表现出很强的抗炎作用。且各用药组间及用药组与空白组间在IL-6、TNF-α mRNA相对表达量上差异无显著性,说明各用药组间对肺炎的抑制作用无差异,与空白组无差异,提示抑制炎症的效果很好。且在用药组中,联合低剂量组是用药量最少的,所以从量效关系上看,联合低剂量组的效果最好。
MPO在中性粒细胞中表达最丰富,MPO活性与肺组织中的中性粒细胞数呈正相关[12]。中性粒细胞有趋化、变形和黏附、吞噬及杀菌作用,在机体防御和抵抗病原菌侵袭过程中起着重要作用[13]。所以,可以通过肺组织中MPO活性的高低来判断炎症程度。在Yin等[14]的研究中,异氟醚可以通过降低MPO的活性,保护LPS诱导的大鼠肺损伤。本实验中,LPS组小鼠肺组织的MPO活性明显高于空白组,说明LPS促进了中性粒细胞的活化和产生,从而导致MPO活性升高;而苦参碱组、黄芩苷组、联合高、中、低剂量组中肺组织的MPO活性与LPS组比较均明显减少,且各用药组间、用药组与空白组间差异均无显著性,说明用药组可能是抑制了中性粒细胞的活化和产生,从而导致MPO活性降低。本研究结果表明,苦参碱、黄芩苷单独作用和二者联合作用都有很好的抗炎效果,且它们之间的抑炎效果差异无显著性,其中联合低剂量组用药量最少。所以,后续我们将在7.5 mg·kg-1苦参碱和50 mg·kg-1黄芩苷联合使用的基础上,进一步研究其最佳配伍剂量和机制。
综上,综合考虑用药量和药效,联合低剂量组用量最少,效果与单独用药组差异无显著性,相比较而言更加经济,且用量减少也会降低药物的毒性,所以,临床上推荐使用苦参碱和黄芩苷联合使用。研究表明,炎症因子TNF-α和IL-6的产生与NF-κB通路有关[15],后续将从这条通路对苦参碱联合黄芩苷抗炎机制进行深入研究。
(致谢:本实验是在山西农业大学动物科技学院临床兽医实验室完成,在此对实验室的各位老师及同学的帮助致以衷心的感谢!)