艾迪注射液对肝癌大鼠谷胱甘肽-S-转移酶的影响
陆 苑, 潘 洁, 杨淑婷, 吴 琼, 刘春花, 李勇军, 刘 亭
(1.贵州省药物制剂重点实验室;2. 民族药与中药开发应用教育部工程研究中心;3. 贵州医科大学药学院;4. 国家苗药工程技术研究中心,贵州 贵阳 550004)
艾迪注射液(Aidi injection, ADI)是由斑蝥、人参、黄芪和刺五加组成的中药复方注射液[1],属国家基本药物,收载于部颁标准,具有清热解毒、消瘀散结功能。ADI在晚期恶性肿瘤治疗中的疗效明显,可通过发挥协同作用来提高肿瘤治疗的综合疗效和提升患者生存的质量[2]。近年来,有关ADI与化疗药物联合治疗肝细胞癌(hepatocellular carcinoma, HCC),多为临床疗效观察的报道,缺乏基础研究,有关其产生协同作用机制的报道更为少见[2-5]。
谷胱甘肽-S-转移酶 (glutathione S-transferases, GSTs;EC 2.5.1.18) 是一种II相代谢酶,是细胞抗损伤、抗癌变和重要的解毒酶系统[6]。研究发现,GSTs在HCC组织中具有较高水平的表达,且π亚型 GSTs (GST-π) 与细胞的癌变、肿瘤的形成以及肿瘤的耐药性有密切关系[7]。具有亲电子特性的氮芥类、蒽环类、铂类和烷化剂均是GSTs的底物,GSTs能促使细胞毒性药物代谢加速,降低化疗药物的细胞毒作用,导致耐药性的发生[8-11]。因此,寻找或设计GSTs抑制剂对于逆转肿瘤多药耐药,提高肿瘤药物治疗指数,减少肿瘤患者身体和经济方面的负担都有着重要的意义。本实验将考察ADI对HCC大鼠肝功能各项生化指标、肝组织中GSTs酶活性以及GST-π表达的影响,以期从是否抑制GSTs酶活性或表达方面,来研究ADI与化疗药物联合应用产生协同作用的机制。
1 材料
1.1实验动物SPF级健康♂ SD大鼠,180~200 g,购自长沙市天勤生物技术有限公司,动物许可证编号:SCXK (湘) 2014-0011。
1.2药物及试剂艾迪注射液(贵州益佰制药有限责任公司,批号20150627,规格10 mL/支);大鼠谷胱甘肽-S转移酶试剂盒(南京建成生物工程研究所,批号:20151127);二乙基亚硝胺(diethylnitrosamine, DEN)(批号D0516A,纯度 >99.0 %)购自大连美仑生物科技有限公司;TRIzol(Invitrogen,批号101004);Eastep总RNA提取试剂盒(Promega,批号0000197548);TransScriptTMOne-Step RT-PCR SuperMix(批号00351597)、SYBR® Premix Ex TaqTMII(批号AK7005)均购自大连宝生物有限公司;GST-π、GAPDH引物由上海英骏有限公司合成;BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,批号20170121);GST-π抗体(批号gr136981-3)、GAPDH(批号gr136220-9)、羊抗兔IgG(H+L)-HRP(批号gr216930-6)、羊抗小鼠IgG(H+L)-HRP(批号gr124950-7),均购自Abcam。
1.3仪器Biomate 3S核酸蛋白紫外测定仪、Fresco 17高速冷冻离心机(美国Thermo公司);Trans-Blot Turbo蛋白快速转印仪、Mini Trans-blot Cell垂直电泳槽、CFX96实时荧光定量PCR仪(美国Bio-Rad公司);凝胶成像仪(英国Syngene公司);EL204电子天平(梅特勒-托利多仪器有限公司);TGrinder电动组织研磨器(北京天根生化科技有限公司)。
2 方法
2.1HCC模型建立根据文献报道的改良法建立原发性肝癌大鼠模型[12-13]。26只♂ SD大鼠,其中20只进行造模(大鼠自由饮用含95 mg·L-1DEN的溶液,每天更换1次,连续饮用30 d后,改饮用煮沸自来水30 d,再继续饮用含95 mg·L-1的DEN溶液70 d),造模结束后存活18只,造模结束后随机挑选6只HCC大鼠进行病理学检查。其余12只HCC大鼠和6只正常大鼠进行生化指标、GSTs酶活性和GST-π表达的测定。
2.2一般状况评估和病理学检查造模过程中,观察大鼠的状况。造模结束后,解剖大鼠,拍照。然后,取肝脏典型的病变组织放入4%多聚甲醛溶液,固定24~48 h,然后转入70%乙醇脱水长期保存。收集的标本于贵州医科大学病理教研室进行石蜡包埋、切片、HE染色,在光学显微镜下观察和摄影。
2.3动物分组和给药将HCC模型大鼠分成两组,与同批次正常大鼠共计3组进行实验,每组6只。分别是正常组(腹腔注射生理盐水10 mL·kg-1,每日1次,连续给药14 d)、模型组(腹腔注射生理盐水10 mL·kg-1,每日1次,连续给药14 d)、模型-ADI组(腹腔注射ADI 10 mL·kg-1,每日1次,连续给药14 d),在给药期间饮用灭菌自来水和正常饲料。大鼠末次给药后,禁食16 h,股动脉取血,全血测定生化指标;剪开腹腔取其肝脏,用预冷的生理盐水将肝脏的血冲洗干净。3组大鼠的一部分肝脏组织进行GSTs活性测定实验。
小心分离模型组大鼠的癌旁组织(para-cancerous tissue, PCT)和癌灶组织(cancerous tissue, CT),以及正常组大鼠肝脏组织(normal liver tissue, NLT)。得到5组样品,分别为模型-ADI组大鼠的癌旁组织(ADI-PCT)、模型-ADI组大鼠的癌灶组织(ADI-CT)、模型组大鼠的癌旁组织(Control-PCT)、模型组大鼠的癌灶组织(Control-CT)和正常组肝脏组织(NLT),进行qRT-PCR和Western blot实验。
2.4生化指标分离血清后,进行生化指标谷丙转氨酶(alanine transaminase, ALT) 、谷草转氨酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBil)、碱性磷酸酶(alkaline phosphatase, ALP)检查,在贵州医科大学附属医院检验科生化分析仪进行检测。
2.5GSTs活性检测GSTs具有催化谷胱甘肽(glutathione, GSH)与1-氯-2,4-二硝基苯(1-chloor-2,4-dinitrobenzeen, CDNB)结合的能力,本实验按照GSTs活性检测试剂盒说明书操作,通过紫外/可见分光光度计检测GSH与CDNB的结合物在412 nm下的OD值,进而计算肝组织中GSTs活力的大小。组织中GSTs活力单位为kU·g-1Pro,即每毫克组织蛋白在37℃反应1 min扣除非酶促反应,使反应体系中GSH浓度降低1 μmol·L-1为1个酶活力单位。GSH浓度降低越多则GST活力越大。
2.6qRT-PCR检测GST-πmRNA水平取肝脏约20 mg,加入1 ml TRIzol试剂匀浆,并按说明书,用Eastep总RNA提取试剂盒提取纯化肝脏总RNA。利用核酸蛋白紫外测定仪检测RNA样品浓度和纯度,琼脂糖凝胶电泳分析RNA样品的完整性。取RNA 2.0 μg按说明书进行逆转录反应。20 μL qRT-PCR反应体系包括: 2.0 μL逆转录反应产物,上、下游引物(10 μmol·L-1) 各0.4 μL,SYBR Premix Ex Taq II (2×)10 μL。用GAPDH作为内参基因。qRT-PCR引物序列如下:GAPDH上游引物 5′-TATGCCAACACCCTCAGTGC-3′,下游引物 5′-CTGCTTGCTGGTACTCATCC-3′;GST-π上游引物 5′-TGCTATTCTCTGCTCCTGTCTG-3′,下游引物5′-CAAACCCTACTGCAACTGTG-3′。PCR扩增程序为95℃ 30 s;95℃ 5 s,60℃ 30 s,72℃ 30 s,40个循环;循环结束后绘制熔解曲线。用2-ΔΔCt方法分析数据。
2.7Westernblot检测GST-π蛋白的表达取约100 mg肝组织用RIPA裂解液于冰上匀浆,制备总蛋白提取液,并按BCA蛋白定量试剂盒说明书操作,测定蛋白浓度。各组取等量总蛋白上样,经SDS-PAGE电泳后,将目的条带转移至PVDF膜。转膜完毕后,用5%牛血清白蛋白(BSA)溶液封闭,再分别加入一抗(GST-π抗体1 ∶5 000、GAPDH抗体1 ∶5 000),在室温下孵育2 h,用1×TBST缓冲液漂洗3次。再与辣根过氧化物酶(HRP)偶联的抗鼠(1 ∶10 000)或抗兔(1 ∶20 000)二抗孵育1 h。二抗孵育结束后,用1×TBST缓冲液漂洗3次。ECL显色,于凝胶成像仪中扫描成像,使用Quantity one凝胶图像分析软件进行灰度值分析。
Tab 1 Liver function indicators of three
**P<0.01vsnormal;##P<0.01vsmodel
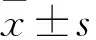
3 结果
3.1一般状况评估和病理学检查实验过程中,模型组大鼠开始出现不同程度的竖毛、精神萎靡、活动减少、食欲不振、消化不良等表现。解剖大鼠,模型组肝脏色泽晦暗,肝表面布满粗颗粒结节,并可见明显癌结节突起,癌结节较周围组织发白,有的癌结节伴有出血性坏死,呈暗紫色(Fig 1)。Fig 2病理学检查显示,模型组大鼠肝组织可见部分肝细胞轻度水肿,HCC形成,癌细胞异型性明显、核分裂像多见。
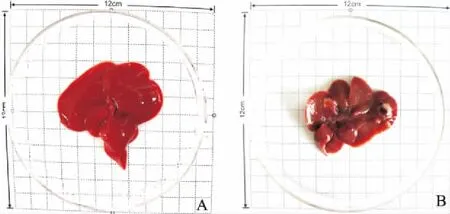
Fig 1 Livers of normal group and HCC model group
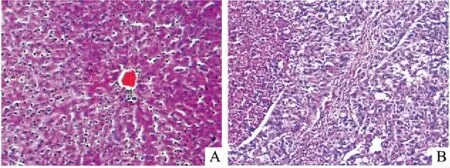
Fig 2 HE staining of tissue sections(×200)
3.2ADI对肝癌大鼠生化指标的影响与正常组比较,模型组ALT、AST、TBil、ALP水平明显升高(P<0.01),表明模型大鼠肝功能严重受损。与模型组比较,模型-ADI组ALT、AST、TBil、ALP均明显降低(P<0.01),提示ADI对肝功能具有明显的保护作用(Tab 1)。
3.3ADI对GSTs活性的影响与正常组比较,模型组GSTs活性明显增加(P<0.01);与模型组比较,模型-ADI组GSTs活性明显降低(P<0.05),说明ADI可以降低HCC大鼠肝脏中GSTs活性(Tab 2)。
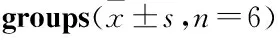
Tab 2 Activity of GSTs in different
**P<0.01vsnormal;#P<0.05vsmodel
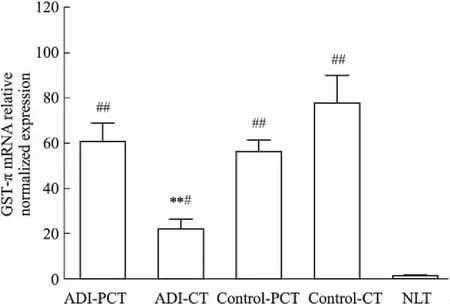
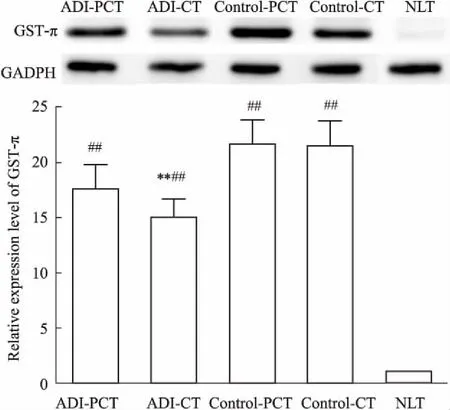
3.4ADI对肝脏GST-πmRNA表达的影响各组样本的总RNA的260/280值在1.86~1.95之间,28S条带灰度值也大约是18S条带灰度值的2倍,说明提取到的总RNA适用于后续qRT-PCR实验。GST-π mRNA水平检测结果见Fig 3。与NLT比较,GST-π在HCC模型大鼠PCT和CT中表达上调,且差异具有显著性(P<0.01);GST-π mRNA表达强度的顺序是:NLT 3.5ADI对肝脏GST-π蛋白表达的影响如Fig 4所示,与NLT比较,GST-π在HCC模型大鼠PCT和CT中表达上调,且差异具有显著性(P<0.01)。ADI下调HCC大鼠肝脏中CT的GST-π表达(P<0.01)。 DEN是一种化学致癌剂,对肝脏有明显的亲和性,使用其诱发大鼠HCC模型,因其诱发癌变的整个过程与人类肝癌发生过程(肝炎→肝硬化→肝癌)十分相似,且诱癌成功率高,被广泛用于制作肝癌大鼠模型[14]。由于♂大鼠较♀大鼠对化学诱导剂有较高敏感性[15],因此选择♂大鼠进行实验。实验过程中,采用长期小剂量间断给予DEN喂养SD大鼠,其优点为:① 采用间断给药,可以缓解药物对肝细胞的毒性损害,减少DEN连续给予对大鼠肝脏的损伤,可以降低大鼠死亡率;② 该方法操作简单方便,95 mg·L-1DEN自由喂养,与传统灌胃或腹腔注射相比,操作方法非常简便,可以避免长期灌胃或腹腔注射对大鼠造成的损伤。临床上,肝癌确诊的“金标准”是病理组织学检查,本实验HE染色结果表明HCC造模成功。 Fig 3 mRNA expression of GST-π in livers of n=6) **P<0.01vscontrol-CT;#P<0.05,##P<0.01vsNLT Fig 4 Protein expression of GST-π in livers of n=6) **P<0.01vscontrol-CT;##P<0.01vsNLT 根据药品说明书,ADI一次使用剂量为50~100 mL,每天1次。标准体重60 kg以100 mL给药量计算,人的单位体重ADI给药剂量为1.67 mL·kg-1。若按单位体重的剂量来算,大鼠的等效剂量相当于人的6.3倍。因此,大鼠的给药剂量为1.67 mL·kg-1×6.3 = 10.5 mL·kg-1。为了实际给药方便,我们按照10 mL·kg-1给药剂量给予大鼠ADI,且10 mL·kg-1给药体积未超过大鼠的最大耐受体积(20 mL·kg-1)。临床上,ADI视病情使用10~30 d为1个疗程。结合ADI临床实际使用情况以及实验操作方便,我们考察了连续给予大鼠ADI 14 d(每天1次,10 mL·kg-1)后对肝功能和GSTs的影响。 GST-π属于GSTs家族中的一员,在细胞解毒方面起着关键作用。GST-π可使抗肿瘤药物转化、代谢加快,细胞内有效药物浓度持续时间缩短,使药物在靶部位的积蓄量迅速减少,降低药效。GST-π阳性表达的肿瘤细胞主要对烷化剂、铂类、丝裂霉素类等药物耐药[10-11]。因此,通过下调GST-π可有效逆转肿瘤细胞耐药性。本实验测定了正常组、模型组和模型-ADI组大鼠肝脏组织中GSTs的活性,结果发现模型组大鼠肝脏中GSTs活性明显高于正常组;ADI可降低肝癌组织中GSTs活性,并且ADI可降低癌灶组织中GST-π表达,但对癌旁组织中GST-π表达无明显影响。以上结果表明,ADI具有降低肝癌组织GSTs活性的功能,这种功能可能与其降低GST π的表达有关。与此同时,ADI可明显降低HCC大鼠的ALT、AST、TBil、ALP,提示ADI还具有肝功能保护作用。 综上所述,ADI可降低HCC大鼠肝脏中GST-π的表达,从而降低GSTs酶活性,这对逆转肿瘤细胞耐药性具有重要意义,这也可能是ADI治疗HCC发挥协同作用的重要作用机制。4 讨论