Fas/caspase-8/3和ERK信号通路在Fas siRNA减轻心肌细胞缺氧/复氧损伤中的作用
潘永露,何淑芳,韩正怡,窦梦云,杨 婉,程 洁,陈志武,张 野
(1. 安徽医科大学第二附属医院麻醉科,安徽 合肥 230601;2. 安徽医科大学基础医学院药理学教研室,安徽 合肥 230032)
RNA干扰(RNA interference,RNAi)指由双链RNA(dsRNA)诱发的同源mRNA高效特异性降解,导致其相应的基因沉默的现象,目前已被广泛用于探索基因功能和心脑血管疾病及恶性肿瘤的治疗领域[4]。利用脂质体作为载体介导小干扰RNA(siRNA)转染不但经济、方便,而且有很高的转染效率[5]。因此,本研究拟评价Fas siRNA对H9c2心肌细胞H/R损伤的影响,并探讨其心肌保护作用的机制。
1 材料与方法
1.1材料
1.1.1实验动物及细胞株 本实验所用实验动物及实验方法经安徽医科大学伦理委员会批准。健康成年♂SD大鼠,体质量(250±50)g,由安徽医科大学动物实验中心提供,动物合格证号:SCXK(皖)2005-001。大鼠H9c2(2-1)胚胎心肌细胞株购自中科院上海细胞库。
1.1.2试剂 DME/F-12细胞培养液(美国Hyclone公司);Opti-MEM转染培养基(美国Gibco公司);胎牛血清、0.25%胰酶消化液(加拿大Wisent公司);化学修饰合成的Fas siRNA及siRNA-NC(广州锐博生物公司);Lipofectamine RNAiMax、TRIzol(美国Invitrogen公司);细胞增殖检验试剂盒(cell counting kit-8,CCK-8)(广州Biosharp公司);乳酸脱氢酶(lactic acid dehydrogenase,LDH)试剂盒(南京建成生物工程研究所);FITC Annexin V凋亡试剂盒(美国BD公司);PrimeScriptTMRT试剂盒、SYBR®Premix Ex TaqTM试剂盒(日本TaKaRa公司);内参β-actin引物、Fas引物(上海生工公司);鼠抗β-actin单克隆抗体、兔抗Fas单克隆抗体(英国Abcam公司);兔抗caspase-3 单克隆抗体、兔抗ERK单克隆抗体、兔抗GSK-3β单克隆抗体(美国Cell Signaling公司);兔抗caspase-8单克隆抗体(美国Merck Millipore公司);辣根过氧化物酶标记山羊抗兔、山羊抗小鼠抗体(北京中杉金桥生物技术公司);ECL发光试剂盒(美国Thermo公司)。
1.1.3仪器 细胞培养箱(美国Thermo公司);生物安全柜(中国Haier公司);荧光显微镜(日本Olympus公司);缺氧小室(加拿大Stem Cell公司);荧光定量PCR仪(美国ABI公司);蛋白电泳仪、Tanon Fine Do X6全自动化学发光图像分析系统(上海Tannon公司);Tecan M1000 酶标仪(德国Tecan公司);Cytomics FC500 流式细胞仪(美国Beckman有限公司)。
1.2方法
1.2.1动物模型的制备与分组处理 采用随机数字表法,将SD大鼠分为2组(n=4):假手术组(Sham组)和I/R组。Sham组大鼠开胸后行冠状动脉左前降支(left anterior descending coronary artery,LAD)下穿线,但不结扎;I/R组开胸后穿线结扎LAD,进行30 min缺血和120 min再灌注。实验结束后,检测Fas、caspase-8/3、ERK、GSK-3β蛋白表达。
1.2.2细胞培养 含10%胎牛血清(FBS)的DME/F-12培养液培养H9c2细胞,置于37℃、95%空气-5% CO2培养箱中生长。当细胞密度达90%左右时,用0.25%胰酶消化约1 min,以1 ∶3的比例传代,每隔2 d传代1次。选对数生长期的细胞用于实验。
1.2.3细胞转染 细胞生长达60%~70%时进行转染,按照Lipofectamine RNAiMAX说明书进行转染,Fas siRNA以及其阴性对照(siRNA-NC)用Opti-MEM培养基稀释(终浓度均为50 nmol·L-1),轻柔混匀后室温放置5 min,将混合物加入各组细胞中,置于培养箱中培养24 h。CY3标记的荧光对照用于观察siRNA转染效率,在荧光显微镜下可见细胞呈红色荧光,当siRNA转染效率在70%~80%时说明能满足后续实验要求。 Fas siRNA共有3条链,预实验通过RT-PCR和Western blot筛选干扰Fas基因表达最有效的siRNA链,将筛选的Fas siRNA链用于正式实验。转染结束后按实验需要处理细胞。
1.2.4制备心肌细胞H/R损伤模型 参照文献[6]介绍的方法,弃去H9c2细胞培养的完全培养基,加入无血清无糖的缺氧液(139 mmol·L-1NaCl、4.7 mmol·L-1KCl、0.5 mmol·L-1MgCl2、1.0 mmol·L-1CaCl2、5 mmol·L-1HEPES,pH 7.4),细胞置于缺氧小室中,通入95% N2-5% CO2饱和10 min,将缺氧小室放入37℃培养箱中缺氧5 h,然后用含10% FBS的完全培养基正常培养1 h。
1.2.5细胞实验分组及处理 将H9c2心肌细胞随机分为4组:正常对照组、H/R组、Fas siRNA组(H/R+Fas-siRNA)、siRNA阴性对照组(H/R+siRNA-NC)。对照组细胞正常培养24 h,H/R组制备H/R损伤模型,H/R+Fas-siRNA组和H/R+siRNA-NC组分别转染Fas siRNA和siRNA-NC 24 h后,制备H/R损伤模型。各组结束以后检测以下指标。
1.2.6心肌细胞活性的检测 将对数生长期H9c2细胞接种于96孔培养板,每孔104个,按上述方法进行分组及处理后,每孔加入10 μL CCK-8溶液(培养基100 μL),在细胞培养箱内孵育4 h后,酶标仪测定各组吸光度(波长450 nm),空白对照孔为不含细胞的培养液。实验测定孔吸光度减去空白对照孔吸光度为H9c2心肌细胞活力,计算各组平均值。
1.2.7检测LDH活性 接种在96孔细胞培养板的H9c2细胞按照以上进行分组及处理后,每组各取40 μL培养上清液,按照LDH试剂盒说明书操作,利用酶标仪测定吸光度值,并计算LDH活性。
1.2.8心肌细胞凋亡的检测 将H9c2心肌细胞以2×106个/孔接种6孔培养板,按照以上进行分组及处理后,0.25%胰酶消化,PBS洗涤细胞2次,1 000 r·min-1离心5 min,收集细胞,用500 μL Annexin V binding buffer 重悬细胞,每组加入5 μL Annexin V-FITC 和5 μL PI , 混匀后室温反应10~15 min,避光,流式细胞仪检测细胞凋亡率。以单染Annexin-V-FITC细胞和单染PI细胞作为基准参照,每个样本获取20 000个细胞,以FCS Express V 3.0软件进行分析。
1.2.9检测Fas mRNA表达水平 接种于60 mm培养皿的细胞按上述分组处理后,弃培养液,4℃预冷PBS清洗细胞,每孔加1 mL TRIzol,置于冰上裂解10 min,加200 μL氯仿萃取,12 000 r·min-1、4℃离心15 min,收集上清液400 μL。加400 μL异丙醇混匀,-20℃沉降30 min,12 000 r·min-1、4℃离心15 min。弃尽异丙醇后,加1 mL 75%无酶乙醇洗涤,12 000 r·min-1、4℃离心5 min。留沉淀加40 μL DEPC水溶解,紫外分光光度计检测总RNA的浓度和纯度。逆转录反应按照PrimeScriptTMRT试剂盒说明书进行,内参β-actin的上游引物5′-CCCATCTATGAGGGTTACGC-3′,下游引物5′-TTTAATGTCACGCACGATTTC-3′;目的基因Fas的上游引物5′-GTTGGAAAGAACCGAAGGACAA-3′,下游引物5′-CCTCAAAGTAGGCACAGGATGT-3′。逆转录反应条件设定为:37℃ 15 min,85℃ 5 s。PCR扩增反应按照SYBR® Premix Ex TaqTM试剂盒说明书进行,条件设定为:95℃预变性30 s,95℃ 5 s ,60℃ 34 s,重复40个循环进行扩增;同时设去离子水为阴性对照。实验结束后,用StepOne Software v 2.3软件进行数据分析,采用2-△△CT法计算[7]。
1.2.10检测蛋白表达水平 各组处理结束后,动物组织液氮研磨,细胞弃培养液后4℃预冷PBS清洗,胰酶消化后收集细胞,各加入1 mL RIPA裂解液,冰上裂解30 min,15 000 r·min-1、4℃离心10 min,收集上清液,BCA法蛋白定量测定浓度。各组蛋白质样本按1 ∶1加入2×上样缓冲液,100℃变性10 min,取20 μg蛋白样品进行SDS-PAGE电泳,转移至PVDF膜,在含8%脱脂牛奶的TBST封闭液中室温孵育2 h,TBST液漂洗10 min×3次,加入β-actin(1 ∶500稀释)、Fas(1 ∶500稀释)、caspase-3、cleaved caspase-3(1 ∶500稀释)、caspase-8(1 ∶250稀释)、ERK(1 ∶500稀释)和 GSK-3β(1 ∶500稀释)一抗, 4℃孵育过夜。次日TBST漂洗10 min×3次,加二抗孵育1 h,TBST漂洗10 min×3次, ECL发光显色,采集图像,Imaging J 1.38e图像分析软件进行条带光密度分析。
2 结果
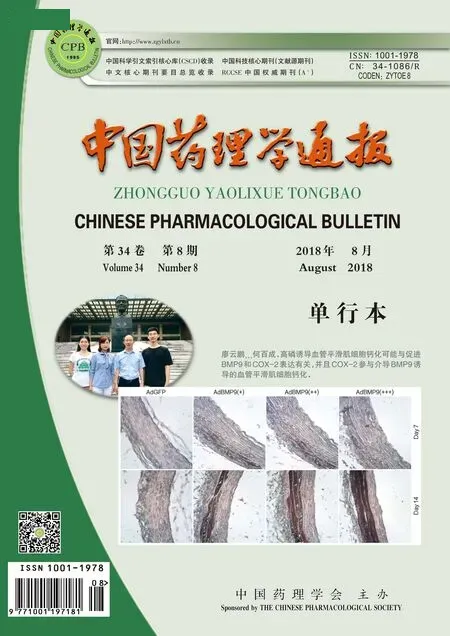
2.1心肌I/R损伤激活Fas/caspase-8/3及ERK信号通路Fig 1的Western blot结果表明,心肌I/R损伤后Fas、cleaved caspase-8/3、p-ERK、p-GSK-3β蛋白表达明显增加(P<0.01)。说明这些蛋白在心肌I/R损伤中发挥着作用,因此,本实验进一步在细胞水平探究Fas/caspase-8/3和ERK信号通路在心肌细胞H/R损伤中的作用及其机制。
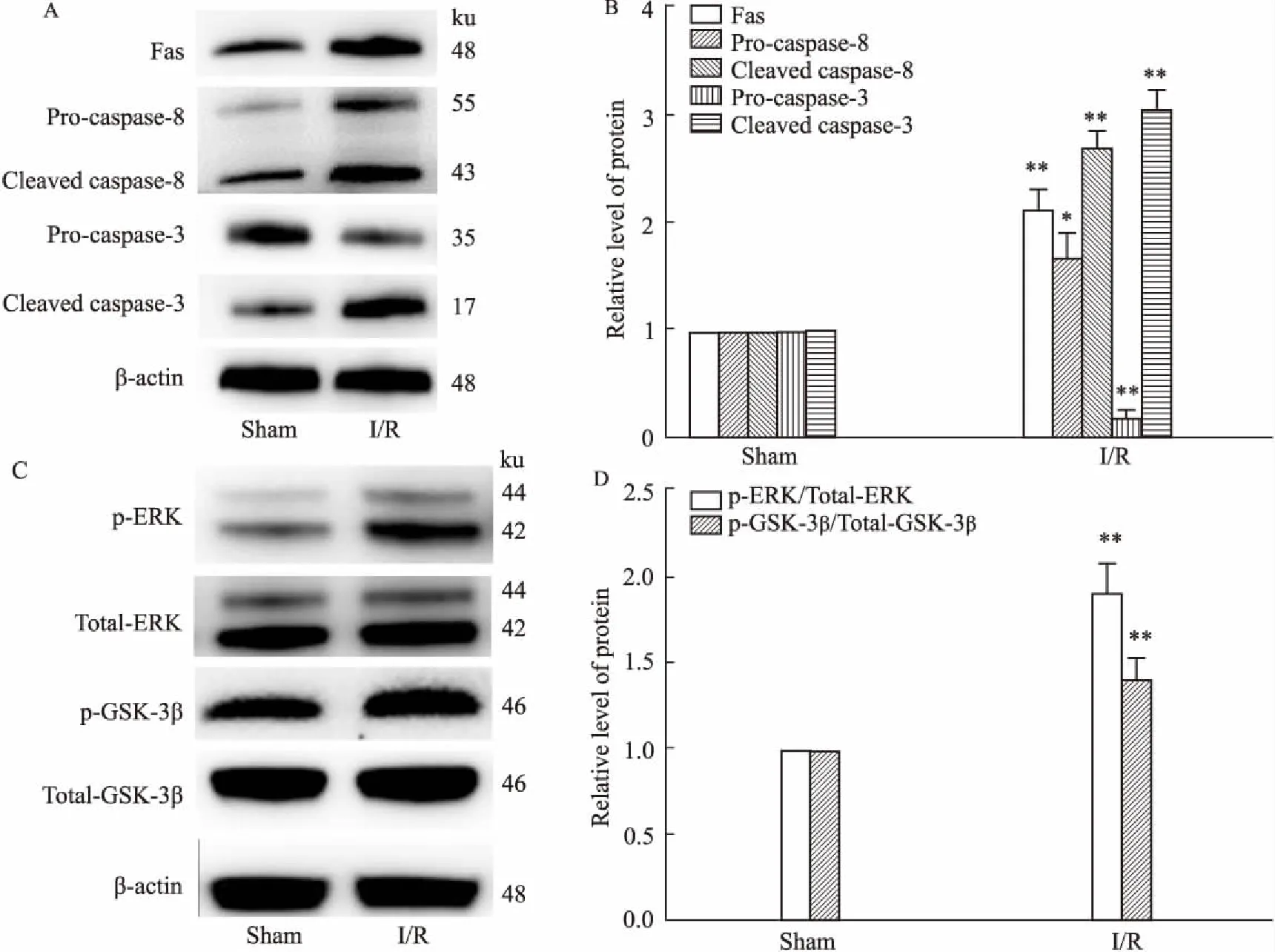
Fig 1 Expressions of Fas/caspase-8/3 and ERK/GSK-3β protein induced by I/R injury in hearts n=3)
2.2筛选最有效FassiRNA链H9c2细胞转染24 h后,荧光显微镜下观察可见大量红色荧光颗粒(Cy3荧光基团标记),隐约可见细胞形态,说明成功转染H9c2细胞。荧光定量RT-PCR 和Western blot结果显示,Fas siRNA2组Fas mRNA、蛋白表达降低最明显,差异有统计学意义(P<0.01),见Fig 2。说明Fas siRNA2可有效抑制Fas蛋白的表达,故后续选择Fas siRNA2进行正式实验。
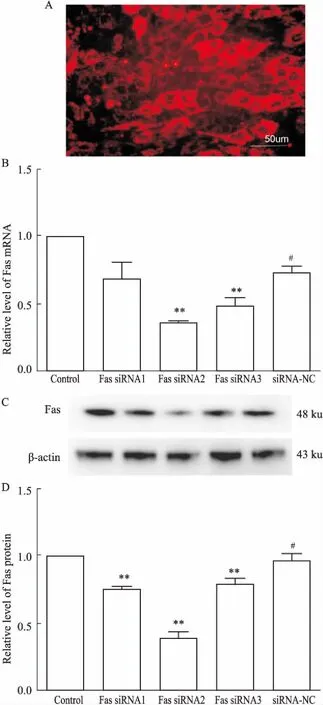
Fig 2 Transfection efficiency of Fas siRNA and screening ofeffective Fas siRNA in H9c2 cardiomyocytes n=3)
2.3FassiRNA增加H9c2细胞活力,降低LDH活性和心肌细胞凋亡与对照组相比,H/R可明显降低心肌细胞活力,增加LDH活性(P<0.01);与H/R组相比,H/R+Fas-siRNA组则明显增加H/R损伤后心肌细胞活力,降低LDH活性(P<0.01),而H/R+siRNA-NC组上述指标差异无统计学意义(Fig 3A、3B)。Annexin-V-FITC/PI双染法检测心肌细胞凋亡结果显示,与对照组相比,H/R组FITC+/PI-区(右下象限)细胞明显增多,提示细胞早期凋亡明显增加(P<0.01);与H/R组相比,H/R+Fas-siRNA组则明显减轻心肌细胞早期凋亡(P<0.01),H/R+siRNA-NC组心肌细胞凋亡率无明显变化,差异无统计学意义(Fig 3C、3D)。说明Fas siRNA通过增加心肌细胞活力,降低LDH活性和心肌细胞凋亡来减轻H9c2细胞H/R损伤。
2.4FassiRNA抑制Fas/caspase-8/3信号通路激活荧光定量RT-PCR和Western blot结果显示,与对照组相比,H/R组细胞内Fas mRNA、蛋白表达明显升高(P<0.01);而H/R+Fas-siRNA组则下调细胞内Fas mRNA、蛋白,与H/R组相比,差异有统计学意义(P<0.05),H/R+siRNA-NC组差异无统计学意义(Fig 4A、4C)。说明Fas siRNA可有效抑制Fas基因的表达。与对照组相比,H/R组细胞内cleaved caspase-8蛋白表达明显升高(P<0.01);而H/R+Fas siRNA组细胞内cleaved caspase-8蛋白水平下调,与H/R组相比,差异有统计学意义(P<0.05),H/R+siRNA-NC组差异无统计学意义。caspase-3蛋白是细胞内重要的凋亡执行蛋白,与对照组相比,H/R组细胞内caspase-3蛋白被激活,pro-caspase-3蛋白表达下降,而cleaved caspase-3蛋白表达明显升高(P<0.01),而H/R+Fas siRNA组则抑制caspase-3蛋白活性,细胞内pro-caspase-3增多,而cleaved caspase-3蛋白水平下降,与H/R组相比,差异有统计学意义(P<0.01),H/R+siRNA-NC组差异无统计学意义(Fig 4B、4D)。说明Fas siRNA通过抑制Fas/caspase-8/3信号通路表达来减轻心肌细胞凋亡。
2.5FassiRNA激活ERK信号通路表达Fig 5 Western blot 结果显示,与对照组相比,H/R组细胞内p-ERK及p-GSK-3β蛋白表达增加(P<0.01),而H/R+Fas siRNA组细胞内p-ERK及p-GSK-3β蛋白水平明显增加,与H/R组相比,差异有统计学意义(P<0.01),H/R+siRNA-NC组差异无统计学意义。说明Fas siRNA通过激活ERK信号通路来减轻心肌细胞凋亡。
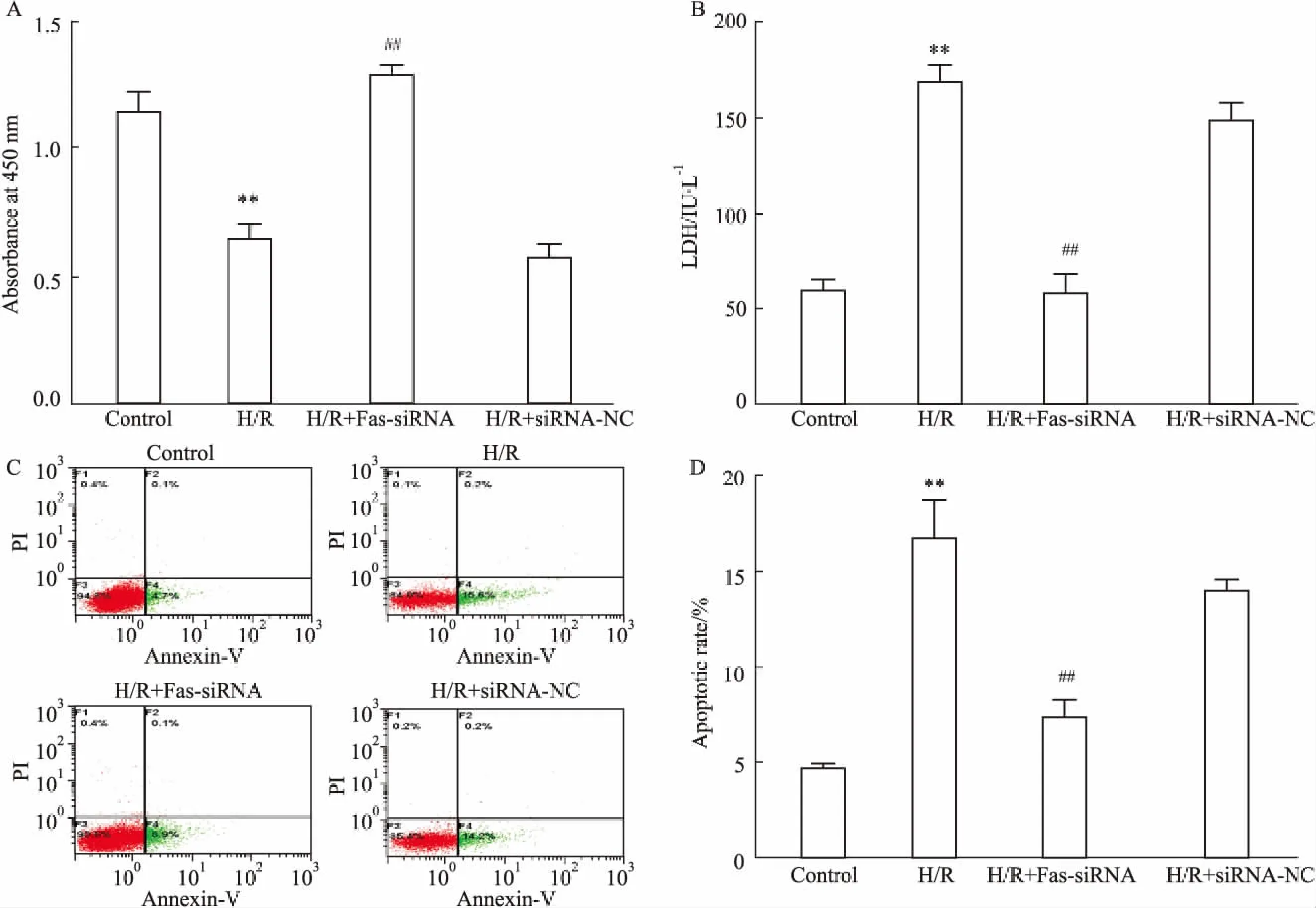
Fig 3 Fas siRNA reduced H/R injury in H9c2 cardiomyocytes n=3)
3 讨论
心肌细胞凋亡是心肌I/R过程中的关键事件,细胞凋亡可通过两种途径,包括Fas死亡受体介导的外源性凋亡途径和线粒体介导的内生途径,然后通过caspase家族执行。本研究在动物水平预实验表明,Fas/caspase-8/3凋亡信号通路和ERK信号通路参与心肌的I/R损伤,故进一步在细胞水平上用H/R损伤模拟在体I/R模型,更深入研究心肌I/R损伤的作用机制。
Fas死亡信号通路在I/R期间是心肌细胞死亡和心肌梗死的关键[8]。Fas是I型跨膜糖蛋白,属于肿瘤坏死因子(tumor necrosis factor,TNF)受体超家族成员,Fas的天然配体(FasL)是II型跨膜糖蛋白,也属于TNF家族。在I/R损伤中,Fas死亡信号通路被激活,FasL诱导Fas三聚体化后,在细胞膜形成凋亡诱导复合物,包括带有死亡结构域的Fas相关蛋白(Fas-associated protein with death domain,FADD),启动细胞凋亡信号的转导,引起细胞一系列特征性变化,这与机体的炎症反应、异物排除、肿瘤杀伤等密切相关,最终导致细胞凋亡。本研究结果表明,H9c2心肌细胞在H/R时细胞活力下降,细胞损伤和凋亡增加,而Fas mRNA和蛋白水平升高,提示Fas表达上调可能参与心肌细胞凋亡;采用Fas siRNA转染细胞后,心肌细胞活力增强,细胞损伤和凋亡减少,Fas mRNA和蛋白水平下降,提示Fas siRNA减轻心肌细胞H/R诱发的细胞损伤和凋亡。
Fas与FasL结合后介导细胞凋亡通路,进而激活下游的caspase凋亡级联信号,在I/R中发挥关键作用[9]。caspase家族是一类半胱氨酸蛋白酶,在细胞凋亡的过程中扮演重要角色,caspase未被激活时以酶原形式存在(pro-caspase),一旦被激活后就剪切成有活性的亚单位(cleaved caspase)。根据作用不同,分为起始caspase和效应caspase两个亚类[10]。其中,caspase-8属于起始caspase,在死亡受体介导的细胞凋亡中起重要作用。在各种细胞凋亡信号的刺激下,死亡受体活化导致起始酶caspase-8和caspase-10的激活,通过细胞内Fas等相关媒介蛋白调控,进一步激活其下游效应分子caspase-3和caspase-7,从而导致细胞凋亡的发生[11]。caspase-3属于效应caspase,是细胞凋亡的关键执行者,通常以非活化的酶原方式存在于胞质中,当多种凋亡信号传递到细胞内时,caspase-3可被激活裂解成分子质量17 ku的活性亚单位,切割不同的蛋白底物,发生一系列的级联反应,从而在调控细胞凋亡中发挥关键作用。因此,caspase-3的活化是执行细胞凋亡的开始[12]。caspase-8和caspase-3的激活已被证实是细胞凋亡信号通路的关键步骤,能导致DNA降解和细胞凋亡。本研究发现,H9c2心肌细胞在H/R损伤中cleaved caspase-8/3蛋白表达增加,而转染Fas siRNA组cleaved caspase-8/3蛋白表达减少,提示Fas siRNA通过抑制caspase-8/3蛋白活性,减轻H/R损伤,从而发挥心肌保护作用。
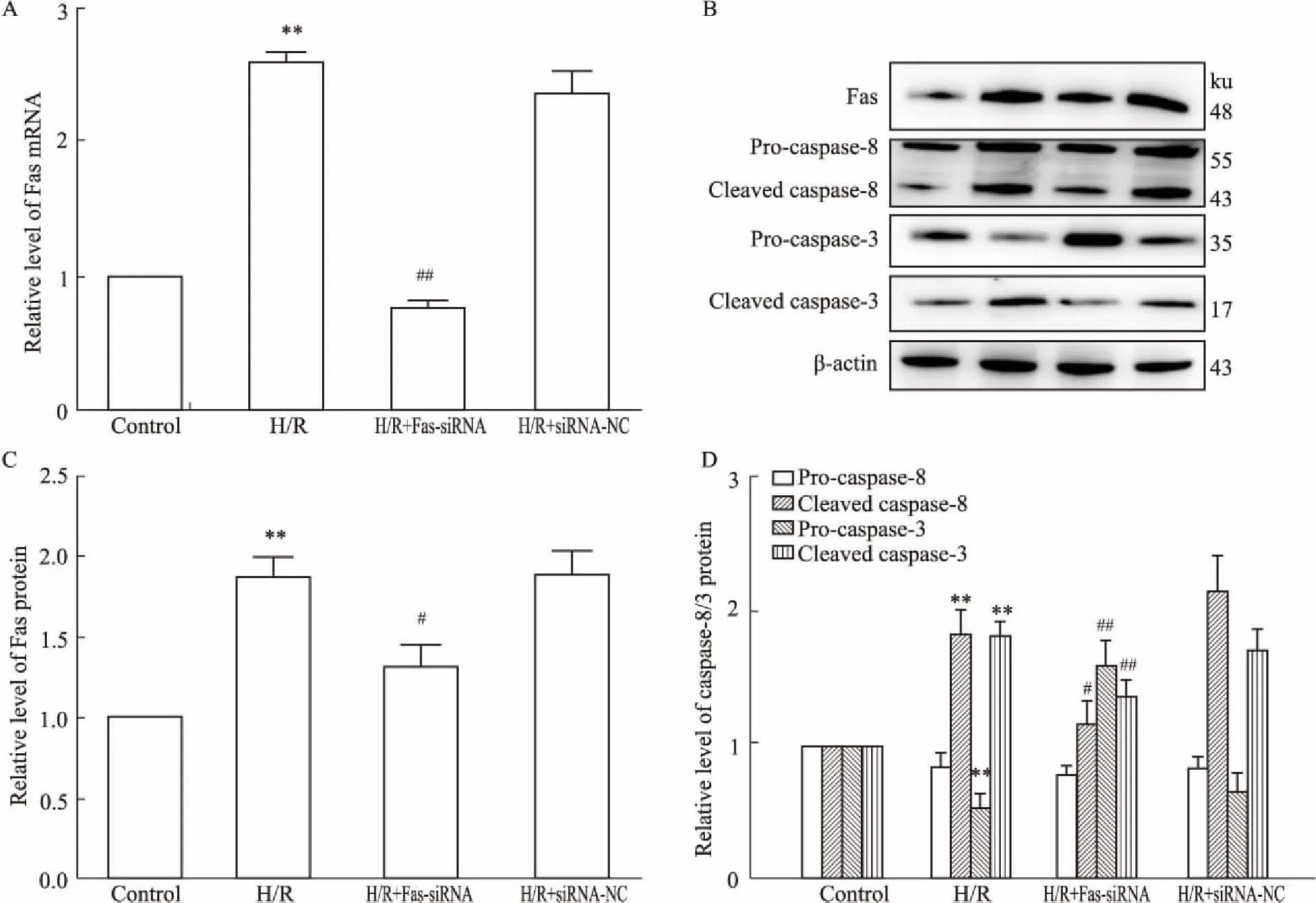
Fig 4 Fas siRNA decreased Fas mRNA, protein and caspase-8/3 protein expression in H9c2 cardiomyocytes n=3)
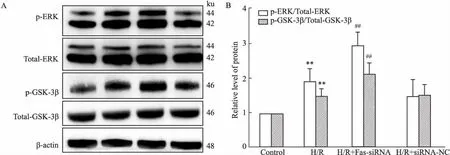
Fig 5 Fas siRNA increased ERK, GSK-3β protein expression in H9c2 cardiomyocytes n=3)
ERK信号通路是心肌再灌注损伤补救激酶通路,属于丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)家族成员,ERK通路激活能减轻心肌I/R损伤[13]。ERK磷酸化后可以抑制糖原合成酶激酶-3β(glycogen synthase kinase 3β, GSK-3β)活性,导致线粒体渗透性转化孔(mitochondrial permeability transition pore,MPTP)关闭,线粒体内凋亡因子的释放减少,从而抑制心肌细胞凋亡[14]。本研究在动物水平表明,ERK信号通路在心肌I/R损伤中起作用,进一步在细胞水平证实ERK及下游的GSK-3β活化可以减轻心肌细胞H/R损伤。已有研究表明,Fas/caspase与ERK信号通路间存在相互作用,共同调控心肌细胞凋亡[15]。本实验在细胞水平证实,Fas siRNA明显活化ERK信号通路,减轻心肌细胞H/R损伤,这表明Fas基因表达可以调控ERK信号通路,两者之间存在紧密的相互联系。
本研究通过将外源性的Fas siRNA转染H9c2心肌细胞,细胞凋亡未完全抑制,提示在H9c2细胞中,Fas/caspase-8/3和ERK信号通路可能是心肌H/R时调控细胞凋亡的机制之一,还有其他途径参与凋亡机制。至于Fas/caspase-8/3凋亡信号通路和ERK信号通路之间具体的相互作用还有待进一步研究。
综上所述,本实验证实Fas siRNA能减轻心肌细胞H/R损伤,其机制可能与调控Fas/caspase-8/3和ERK信号通路有关,为研究缺血性心脏损伤的机制提供新的认识和潜在的治疗方法。