Ksp计算透析
湖北 危红华
Ksp计算透析
湖北 危红华
2017高考考纲要求:了解难溶电解质的沉淀溶解平衡。理解溶度积(Ksp)的含义,能进行相关的计算。
沉淀溶解平衡是高中化学新课程新增内容,尤其是Ksp相关计算是学生的难点之一。学生虽然有化学平衡和离子平衡知识作铺垫,但是学生对此部分内容始终理解不够透彻。为了让学生准确掌握和有效应对高考,本文特归纳如下。
一、Ksp含义
对于MmAn型电解质来说,已知难溶电解质在水溶液中存在溶解平衡:

1.溶度积与溶解度的关系
溶度积和溶解度都可以表示物质的溶解能力,溶度积的大小与溶解度有关,它反映了物质的溶解能力。
2.溶度积规则
可以判断溶液中沉淀的生成和溶解。
3.离子积Qc与溶度积Ksp的区别与联系
某难溶电解质的溶液中任意情况下有关离子浓度的乘积Qc:
当Qc<Ksp时,为不饱和溶液;
当Qc=Ksp时,为饱和溶液;
当Qc>Ksp时,为过饱和溶液。
二、常考计算类型
1.判断能否沉淀
例1 等体积混合0.2mol·L-1的AgNO3和NaAc溶液是否会生成AgAc沉淀?(已知AgAc的Ksp为2.3×10-3)
【解析】c(Ag+)=c(Ac-)=0.2/2=0.1mol·L-1
Qc=c(Ag+)×c(Ac-)=1.0×10-2>Ksp
∴有AgAc沉淀生成。
2.判断能否沉淀完全
例2 取5mL0.002mol·L-1BaCl2与等体积的0.02mol·L-1Na2SO4的混合,是否有沉淀产生?若有,计算Ba2+是否沉淀完全。(该温度下BaSO4的Ksp=1.1×10-10)
【解析】此题中,Qc=c(Ba2+)·c(S)=1×10-5>Ksp,故有沉淀生成。两种溶液混合之后,S浓度变为9×10-3mol·L-1,根据Ksp=c(Ba2+)·c(S),计算得c(S)<1×10-5,故可认为Ba2+已经沉淀完全。
3.判断沉淀顺序
溶液中含有Cl-、Br-和I-三种离子,其浓度均为0.01mol·L-1,现向溶液中逐滴加入AgNO3溶液时,最先和最后沉淀的是 ( )
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13,Ksp(AgI)=8.3×10-17。
A.AgBr和AgI B.AgI和AgCl
C.AgBr和AgCl D.同时沉淀
【解析】AgCl、AgBr、AgI为同种类型的沉淀,Ksp越小越先沉淀,所以沉淀的先后顺序为AgI、AgBr、AgCl,所以最先和最后沉淀的是AgI和AgCl,B正确。
变式训练1 已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.12×10-12,下列叙述正确的是( )
A.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
B.向2.0×10-4mol·L-1K2CrO4溶液中加入等体积的2.0×10-4mol·L-1AgNO3溶液,则有Ag2CrO4沉淀生成
C.将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大
D.将0.001mol·L-1AgNO3溶液逐滴滴入0.001mol·L-1KCl和0.001mol·L-1K2CrO4的混合溶液中,则先产生AgCl沉淀
【解析】AgCl的Ksp只与温度有关,向AgCl的浊液中加入氯化钠溶液,虽然平衡向逆方向移动,但Ksp不变,A错;K2CrO4溶液与等体积的AgNO3溶液混合,体积加倍,浓度减半,c(Ag+)=c(Cr)=1.0×10-4mol·L-1,则Qc(Ag2CrO4)=1.0×10-12<Ksp(Ag2CrO4)=1.12×10-12,所以没有沉淀生成,B错;AgCl和Ag2CrO4固体混合物溶于蒸馏水中,AgCl和Ag2CrO4都会产生Ag+,所以Ag+的浓度最大,C错;根据Ksp(AgCl)、Ksp(Ag2CrO4),计算得出Cl-开始沉淀时所需Ag+浓度较小,故先产生AgCl沉淀,D正确。
4.计算某一离子浓度
直接根据Ksp计算公式和溶液中离子关系进行计算。
例4 已知在室温时,Mg(OH)2的溶度积Ksp=5.6×10-12,求室温下Mg(OH)2饱和溶液中Mg2+和 OH-的物质的量浓度。
【解析】本题根据氢氧化镁的沉淀溶液平衡常数表达式和OH-浓度和Mg2+浓度,可以直接进行计算。
变式训练2 已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡。当达到平衡时,溶液中离子浓度的乘积是一个常数。(此常数用Ksp表示,Ksp和水的Kw相似)

(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为________________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”“减小”或“不变”)。
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为________。
【解析】(1)根据各物质的Ksp可知其溶解度S(AgX)>S(AgY)>S(AgZ)。(2)由于AgY比AgX更难溶,则向AgY饱和溶液中加入AgX固体,则发生沉淀的转化:(aq),c(Y-)减小。(3)25℃时,Ksp(AgY)=1.0×10-12,即溶液达到饱和时,c(Ag+)=c(Y-)=1.0×10-6mol/L,则100mL水溶解AgY的质量约为0.10L×1.0×10-6mol/L×188g/mol=1.88×10-5g<0.188g,即0.188gAgY固体放入100mL水中,形成AgY的饱和溶液且固体还有剩余,则溶液中c(Y-)=1.0×10-6mol/L。
5.计算pH
例5 难溶电解质Mg(OH)2的Ksp=1.2×10-11。在c(Mg2+)=0.12mol·L-1的溶液中,要生成Mg(OH)2沉淀,溶液pH至少应控制在多少?
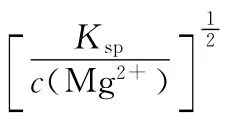
∴c(H+)=1.0×10-14/1.0×10-5=1.0×10-9mol·L-1
故pH=9,即溶液的pH至少应控制在9以上。
(1)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2mol/LCuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。

特别提醒:在有关Ksp的计算中,要特别注意溶液混合之后对离子浓度的影响。
(作者单位:湖北省天门实验高中)
——饱和溶液与不饱和溶液

