高三化学模拟试题(二)
江苏 马秋英
高三化学模拟试题(二)
江苏 马秋英
可能用到的相对原子质量:H—1 O—16 Na—23 Fe—56
一、选择题(本题包括7小题,每小题6分,共42分。每小题只有一个选项符合题意)
1.化学与生产、生活、环境密切相关。下列叙述正确的是( )
A.手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料
B.汽车尾气中含有的氮氧化物是汽油的不完全燃烧造成的
C.明矾净水的原理和漂白粉等氯系消毒剂的消毒原理相同
D.PM2.5(颗粒直径接近2.5×10-6m)分散在空气中形成胶体
2.下列说法正确的是( )
A.苯能被酸性高锰酸钾溶液氧化
B.氯乙烯可以用作生产食品包装材料的原料
C.淀粉和纤维素互为同分异构体
D.乙烯和氯化氢反应可制得较纯净的氯乙烷
3.甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是( )

选项____物质转化关系甲乙丙丁SO2___Na2SO3__NaHSO3_A_B_C_DNaOH_C CO CO2________O2____Fe Fe(NO3)3Fe(NO3)2__HNO3_AlCl3__NaAlO2____Al(OH)3NaOH_
4.用下列装置进行实验能达到相应实验目的的是( )

A.用甲装置配制一定物质的量浓度的NaNO3溶液
B.用乙装置制取并收集NH3
C.用丙装置制取SO2气体并验证其还原性(可加热)
D.用丁装置证明Cl、C、Si三种元素的非金属性:Cl>C>Si
5.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4LC2H6和22.4LC6H14所含的分子数均为NA
B.0.2g重水(D216O)中含有的质子数、中子数和电子数均为0.1 NA
C.25℃时,1LpH=12的Ba(OH)2溶液中含有的OH-的数目为0.02 NA
D.完全燃烧1.5mol CH3CH2OH和C2H4的混合物,转移电子数为16 NA
6.X、Y、Z、W为原子序数依次增大的四种短周期主族元素,其中Z元素原子的内层电子数是最外层电子数的2倍,X与Z同主族,Y是短周期主族元素中原子半径最大的,W的最高正价与最低负价的代数和为6。下列说法正确的是( )
A.Y单质和Z单质都能在W的单质中燃烧
B.氧化物对应水化物的酸性W的一定强于Z
C.W氢化物的稳定性比Z的氢化物的稳定性弱
D.X的氢化物与W的氢化物反应生成共价化合物
7.下列图示与对应的叙述相符的是( )

B.图2表示CH3COOH溶液中逐步加CH3COONa固体后,溶液pH的变化
D.图4表示某可逆反应正、逆反应速率随温度变化,则该反应的正反应是吸热反应
二、非选择题
必考题(本题包括3小题,共43分)
8.(15分)研究和深度开发二氧化碳的应用对发展低碳经济,构建生态文明社会具有重要的意义。
(1)CO2与H2在一定条件下反应可合成乙烯:
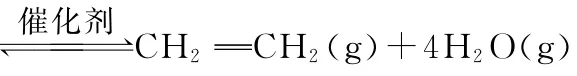
已知:2H2(g)+O2(g)-480kJ·mol-1

(1)ΔH1=________。
(2)科学家用氮化镓材料与铜组装如图1的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。铜电极表面的电极反应式为__________________________;为提高该人工光合系统的工作效率,可向装置中加入少量____________(填“盐酸”或“硫酸”)。

(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应H2O(g),测得CH3OH的物质的量随时间的变化如图2所示。
①该反应的ΔH________(填“大于”或“小于”)0,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________________(填“>”“=”或“<”)KⅡ。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。

_____容器甲乙反应物投入量1mol CO2、3mol H2amol CO2、3amol H2、b mol CH3OH(g)、b mol H2O(g)
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为________。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图3所示。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为________(填序号)。
(5)可用K2CO3溶液吸收化学反应中生成的CO2,常温下pH=10的K2CO3溶液中水电离的OH-的物质的量浓度为_________。常温下,0.1mol·L-1KHCO3溶液pH>8,则溶液中c(H2CO3)________(填“>”“=”或“<”)c(CO2-3)。
9.(14分)高氯酸可用于生产高氯酸盐、人造金刚石提纯、电影胶片制造、医药工业等方面。工业上用以下工艺流程生产高氯酸,同时得到副产品亚氯酸钠(NaClO2)粗品。

已知:①NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点为90℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为_________________________,冷却过滤的目的是_______________________,能用蒸馏法分离出高氯酸的原因是_______________。(2)反应器Ⅱ中通入SO2的目的是_________________。(3)从反应器Ⅱ中获得NaClO2粗品的实验操作依次是________(填序号,下同),进一步提纯的操作为_________。
a.过滤 b.重结晶 c.蒸馏 d.蒸发浓缩 e.蒸干灼烧 f.冷却结晶 g.萃取分液
(4)现提供0.1mol/L的NaHSO4溶液,请设计实验方案判断HSO4-在溶液中是否完全电离:________________。
10.(14分)草酸亚铁为黄色固体,作为一种化工原料,可广泛用于涂料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产。某化学兴趣小组的同学设计了如下实验,进行草酸亚铁晶体(FeC2O4·nH2O)分解产物和样品中草酸根含量测定的实验探究,请你协助他们完成下列问题。
Ⅰ.分解产物探究
下列实验装置中,烧瓶B中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制N2),干燥管C1、C4中装有碱石灰,试管E1、E3、E4中装有澄清石灰水。

(1)该实验装置中有3个酒精灯,至少应该点________次酒精灯,最先点燃的酒精灯是__________,最后点燃的是________。
(2)该实验装置中有4个直立的试管,它们中盛放的试剂体现不同的作用,其中E2的作用是___________________。
(3)该实验装置中有4个干燥管,C3中盛装的试剂是________。
(4)充分反应后,将D1中的固体残余物投入足量经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为________。
(5)取7.2g样品充分反应后,测得D1中的固体残余物为2.88g,D2中固体质量减轻0.64g,则草酸亚铁晶体(FeC2O4·nH2O)分解的方程式为_____________________。
Ⅱ.草酸根含量测定
某草酸亚铁晶体样品中含有少量草酸铵。为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
①准确称量mg样品,溶于少量2mol·L-1硫酸中并用100mL容量瓶定容。
②取上述溶液20mL,用c mol·L-1高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液V1mL。
③向上述溶液中加入足量Zn粉,使溶液中的Fe3+恰好全部还原为Fe2+,过滤。
④洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液。
⑤用c mol·L-1KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液V2mL。

(6)若省略步骤④,则测定的草酸根离子含量________(填“偏大”“偏小”或“不变”)。
(7)mg样品中草酸根离子的物质的量为________(用c、V1、V2的式子表示,不必化简)。
选考题(请考生任选一题作答,多做将按所做的第一题计分)
11.【物质结构与性质】(15分)
氢能是21世纪最有发展前途的新能源之一,但氢能的储存是氢能利用的瓶颈,新型储氢材料是开发利用氢能应用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态氯原子中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________。
②LiBH4由Li+和BH4-构成,BH4-的立体结构是_____________,B原子的杂化轨道类型是________。
③Li、B、H元素的电负性由小到大的排列顺序为_________________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+________________(填“>”“=”或“<”)H-。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:

-1 I1/kJ·mol-1I2/kJ·mol-1I3/kJ·mol-1I4/kJ·mol-1I5/kJ·mol____738 1 451 7 733 10 540 13 630
M是________(填元素符号)。
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为________,NaH的理论密度是________g·cm-3。(列出算式即可,可不算出结果)
12.【有机化学基础】(15分)
PET俗称涤纶树脂,是一种热塑性聚酯;PMMA俗称有机玻璃。工业上以基础化工原料合成者两种高分子材料的合成路线如下:

(1)指出下列反应的反应类型:反应②_____________;反应⑥_____________。
(2)E的名称为_____________;反应⑤的化学方程式为________________________。
(3)PET单体中官能团的名称为______________。
(4)下列说法正确的是________(填字母序号)。
a.B和D互为同系物
b.④为缩聚反应,⑧为加聚反应
c.F和丙醛互为同分异构体
d.G能发生加成反应和酯化反应
(5)Ⅰ的同分异构体中,满足下列条件的有________种(不包括Ⅰ)。
①能与NaOH溶液反应;②含有碳碳双键。
例:由乙醇合成聚乙烯的反应流程图可表示如下:
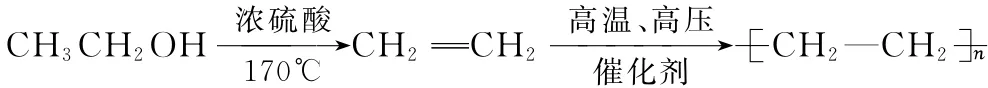
【参考答案及解题提示】
1.A 【解析】汽车尾气中含有的CO是汽油不完全燃烧造成的,B错误;明矾净水是因为Al3+水解成Al(OH)3胶体所致,漂白粉等氯系消毒剂能消毒杀菌是其强氧化性所致,C错误;胶体中分散质的微粒直径在10-9~10-7m之间,PM2.5的颗粒物直径不在此范围内,分散在空气中不能形成胶体,D错误。
2.D 【解析】苯性质稳定,不能被酸性高锰酸钾溶液氧化,A错误;氯乙烯有毒,不能用作生产食品包装材料的原料,B错误;淀粉和纤维素的分子通式相同,但分子式不同,不是同分异构体,C错误。
3.B 【解析】C在过量O2燃烧生成CO2,在不足量的O2中燃烧生成CO,B项中的乙应为CO2,丙应为CO。
4.C 【解析】配制溶液时,不能在容量瓶中溶解溶质,A错误;制取NH3应选用NH4Cl和Ca(OH)2固体反应,但NH3极易溶于水,不能用排水法收集NH3,B错误;验证Cl元素的非金属性大于C元素时,对应的酸应选HClO4,不是盐酸,D错误。
5.B 【解析】标准状况下,C2H6是气体,C6H14是液体,A错误;0.2g D216O的物质的量为0.01mol,1mol D216O中所含质子、中子和电子的物质的量均为10mol,则0.2g D216O中含有的质子数、中子数和电子数均为0.1 NA,B正确;25℃时,1LpH=12的Ba(OH)2溶液中含有的OH-的数目为0.01 NA,C错误;等物质的量的CH3CH2OH和C2H4完全燃烧时的耗氧量相同,1mol C2H4完全燃烧需要消耗3mol O2,反应中转移12mol电子,则完全燃烧1.5mol CH3CH2OH和C2H4的混合物,转移电子数为18 NA,D错误。
6.A 【解析】Z原子的内层应有10个电子,最外层电子数为5,Z是P,则X是N;Y是Na;W的最高正价为+7,最低负价为-1,是Cl。钠和磷都能在Cl2中燃烧,A正确;Cl的氧化物对应的水化物有很多,HClO的酸性比H3PO4的酸性弱,B错误;HCl比PH3的热稳定性强,C错误;NH3和HCl化合生成的NH4Cl是离子化合物,D错误。
7.C 【解析】由图1可知,金刚石转化为石墨的反应放热,其ΔH=ΔH2-ΔH1,A错误;在CH3COOH溶液中逐步加CH3COONa固体后,溶液pH增大,B错误;对于放热反应,温度降低时,平衡正向移动,生成物的体积分数增大,且温度低时反应后达到平衡,C正确;图4说明反应达到平衡后,升高温度,逆反应速率大于正反应速率,平衡逆向移动,该反应是放热反应,D错误。
8.(1)-40kJ·mol-1(2分)
(2)CO2+8e-+8H+CH4+2H2O (2分) 硫酸(1分)
(3)①< (1分) > (1分) ②0.4<b≤1 (2分)
(4)Ⅱ>Ⅲ>Ⅰ (2分)
(5)1×10-4mol·L-1(2分) > (2分)
【解析】(1)反应②×3-反应③得反应①,则ΔH1=3ΔH2-ΔH3=(-480×3+1 400)kJ·mol-1=-40kJ·mol-1。(2)在铜电极表面,CO2得电子发生还原反应生成+2H2O。盐酸中的Cl-易被氧化,加入硫酸合适。(3)①由图2可看出,曲线Ⅱ对应的反应先达到平衡,相应温度高。升高温度时,n(CH3OH)减小,说明平衡逆向移动,正反应是放热反应,ΔH<0。降低温度,平衡正向移动,平衡常数KⅠ>KⅡ。②甲中反应达到平衡时,CO2、H2、CH3OH(g)、H2O(g)的物质的量分别为0.6mol、1.8mol、0.4mol、0.4mol。要使甲、乙两容器中的平衡为等效平衡,则a+b=1;要使起始时维持化学反应向逆反应方向进行,则b>0.4,由此可得0.4<b≤1。(4)相同时间段内,CH4的产量越高,CH4的平均生成速率越大。(5)常温下pH=10的K2CO3溶液中,c(H+)=1×10-10mol·L-1,c(OH-)=1×10-4mol·L-1,盐溶液中的OH-就是水电离产生的。KHCO3溶液显碱性,说明HCO-3的水解能力大于其电离能力,故c(H2CO3)>c(CO2-3)。
9.(每空2分)
(1)3NaClO33NaHSO4+H2O
降低NaHSO4的溶解度并分离出NaHSO4晶体
高氯酸的沸点比较低,容易从溶液中逸出
(2)SO2作为还原剂把ClO2还原为NaClO2
(3)df b
(4)用精密pH试纸或pH计测定0.1mol/L的NaHSO4溶液的pH,如果pH=1,则HSO-4在溶液中完全电离;若pH>1,则HSO-4在溶液中不完全电离
【解析】(1)分离流程图可以看出,反应器Ⅰ中的反应物是NaClO3和浓H2SO4,反应产物是NaHSO4、ClO2、HClO4和H2O,据此可写出化学方程式。因为NaHSO4的溶解度随温度的升高而增大,冷却过滤可降低NaHSO4的溶解度并分离出NaHSO4晶体。因为高氯酸的沸点为90℃,比较低,所以可通过蒸馏法使之从溶液中逸出。(2)反应器Ⅱ中,ClO2与通入的SO2反应生成NaClO2,显然SO2是作为还原剂把ClO2还原为NaClO2。(3)从溶液中得到晶体需经过蒸发浓缩、冷却结晶的过程,进一步提纯的操作为重结晶。(4)若HSO-4完全电离,则0.1mol/L的NaHSO4溶液中,c(H+)=0.1mol/L,其pH=1,因此通过测定溶液的pH可达到实验目的。
10.(1)4 A1A1(3分)
(2)除尽气体中的CO2(2分)
(3)P2O5或CaCl2(1分)
(4)FeO (2分)
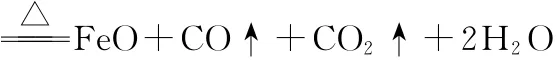
(6)偏大 (2分)


11.(1)①M 9 (各1分) ②正四面体 sp3③Li<B<H (各2分)
(2)①< (1分) ②Mg (2分)

12.(1)取代(或水解)反应 (1分) 消去反应 (1分)
(3)酯基、羟基 (2分)
(4)bc (2分)
(5)6 (2分)

(作者单位:江苏省常州市横山桥高级中学)

