把脉问诊 对症下药
——高考化学“易错点”盘点
河北 颜建河
把脉问诊 对症下药
——高考化学“易错点”盘点
河北 颜建河
随着高考的临近,模拟考试多了。考生要通过试卷给自己“把脉”,对自己的“病情”做出准确的判断,这是“对症下药”的前提条件。“考纲”中明确提出:“对中学化学基础知识能正确复述、再现、辨认,并能融会贯通。”注重基础,考查能力。只有基础知识了如指掌,深刻理解了,做题才是有效的。同时,对各个知识板块中的重点内容,要能够在知识梳理过程中,盘点高考命题中的“易错易混点”,都要有所把握,并针对性地、高质高效地练几道题,不贪多,只求精,精益求精。还有,对重要的方法也要作为复习重点,争取以少胜多,举一反三。
易错点1 阿伏加德罗常数
(1)从状况条件上:要注意只有气体的体积受外界条件(温度、压强等)的影响,而质量、物质的量不受温度、压强的影响。例如,常温常压下,32gO2所含的氧气分子数为NA,其说法是正确的;而运用气体摩尔体积(即22.4L·mol-1)计算时必须满足两个条件:“标准状况”和“气态”。
(2)从物质条件上:要熟悉常见物质的聚集状态,考查气体摩尔体积时,常用在标准状况下的非气态物质来迷惑考生。
(3)从物质结构上:要熟悉一些常见物质晶体结构中的化学键数目。例如,1mol金刚石中含有1mol C—C共价键、1mol石墨中含有1.5mol C—C共价键、1mol晶体硅中含2molSi—Si共价键、1molSiO2中含有4mol Si—O共价键、1mol CH4中含有4mol C—H共价键、1mol P4中含有6mol P—P共价键、1molCO2中含有2molCO双键,等等。
(4)从氧化还原反应上:要重视特殊的氧化还原反应中,转移电子数目的计算。
(5)从电离、水解知识上:要防止误入“水解陷阱”,忘记了考虑水解因素而致错。对于溶液中的离子,考查电解质溶液中粒子数目或浓度时常常设置弱电解质的电离和盐类水解方面的陷阱。对于胶体中的粒子数的考查,注意由于胶体粒子较大,由多个微粒组合而成。
(6)从“特殊”反应上:要注意某些物质或者几种物质的混合物可能发生反应的情况。例如,常温常压下,由于NO2与N2O4间存在着化学平衡,则46gNO2气体中含有的分子数应小于NA。
易错点2 离子反应方程式
(1)忽视溶解性大小,设错生成物。明确并熟悉重要酸、碱和盐的溶解性规律,特别是对于一些重要的微溶物的溶解度大小要牢记。例如,卤化银溶解度大小关系为AgCl>AgBr>AgI。
(2)忽视各种符号,设错符号的使用。一般来说,盐类水解的程度不大,是中和反应的逆反应,由于中和反应趋于完全,所以盐类的水解反应是微弱的。由于盐类的水解程度一般都很小,所以其水解离子方程式一般用也由于程度小,通常不生成沉淀和气体,则一般不标“↓”或“↑”符号,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
(3)忽视水解概念,设错离子反应。多元弱酸的酸根离子水解是分步进行的,且以第一步水解为主。例如,Na2CO3的水解,第一步第二步;多元弱碱的阳离子水解较复杂,可看作一步水解。
(4)忽视反应物用量,设错离子反应。对于复分解反应来说,首先要准确判断不足的物质是什么?以不足的物质完全反应为依据,一般按“以少定多”的原则来书写。即以少量的反应物(离子)来确定量多的离子前面的系数,要求不足量的物质各参加反应的离子的物质的量之比一定要与它的化学式配比相符合,而对足量的物质各参加反应的离子的物质的量之比不一定与化学式相符。若没有确定用量,用任一反应物作为足量(或不足量)写出的离子反应方程式均属正确。
(5)忽视隐含条件,设错离子反应。遵循客观事实,要学会全面考虑问题,并注意挖掘试题中可能发生的反应,做到全面、准确书写发生的离子方程式。例如,将5.6g铁粉加入80mL 0.500mol·L-1的硝酸溶液的总离子方程式为
(6)忽视反应环境,设错书写离子反应。离子反应通常所指向的是在水溶液中发生的,能否书写离子方程式的判断标准就是看其是否在水溶液中进行。例如,固态氯化铵和熟石灰混合加热制氨气,浓硫酸与铜片、氯化钠、硝酸钠等固体加热的反应,不能写离子方程式。
易错点3 物质结构与元素周期表
(1)最外层电子数为1或2的原子可以是ⅠA族、ⅡA族或副族元素的原子;最外层电子数是3~7的原子一定是主族元素的原子,且最外层电子数等于主族的族序数。
(2)分子的极性与共价键的极性没有必然联系,键有极性,分子不一定有极性,判断多原子分子是否属于极性分子时,不仅要看共价键有无极性,还要分析分子的空间构型是否对称,两者要兼顾,不能单方面考虑。
(3)活泼金属元素与活泼非金属元素形成的化合物,不一定是离子化合物。例如,AlCl3等属于共价化合物;所含化学键不一定只含离子键,可能既有离子键又有共价键(极性共价键、非极性共价键)。例如,如 NaOH、Na2O2、CaC2等。
(4)同一元素所处的价态越高,所表现出的氧化性不一定越强,有少数例外。例如,HClO氧化性强于HClO4。
易错点4 化学平衡理论及运用
(1)平衡向正反应方向移动时,反应的浓度不一定减小。例如,增加一种反应物的浓度,再次达到平衡后该反应物的浓度大于原平衡时的浓度。若用不同物质的反应速率比较反应进行的快慢时,除要保证单位一致外,还要根据反应速率之比等于化学计量数之比换算为同一物质的速率后再比较。
(2)影响平衡常数的因素:①平衡常数表达式中各物质的浓度是平衡浓度,不是起始浓度,也不是变化的浓度;②对于有固体和水参加或生成的反应,固体和水的浓度视为1,一般不列入平衡常数表达式中;③对于确定的化学反应,平衡常数只与温度有关,浓度、压强等外界条件的变化不影响平衡常数。对于同一化学反应,化学计量数改变时其平衡常数表达式也会发生变化。
(3)无论化学反应是否可逆,热化学方程式中的反应热均表示反应进行到底(完全转化)时的能量变化。例如,指2mol SO2(g)和1mol O2(g)完全转化为2mol SO3(g)时放出的能量;若在相同温度和压强下,向某容器中通入2mol SO2(g)和1mol O2(g),反应达到平衡时放出的热量为Q,因为该反应可逆,生成三氧化硫的物质的量小于2mol,故Q<197kJ。
易错点5 元素及化合物
(1)Na2O2不属于碱性氧化物,且其结构中含有过氧键(—O—O—),故在一定条件下获得电子表现氧化性,也可以在一定条件失去电子表现还原性,还可在一定条件下发生歧化反应,即表现氧化性,又表现还原性。
(2)制备Fe(OH)2时,要防止O2与Fe(OH)2接触,故制备实验中胶头滴管要伸入液面底部,否则会发生的反应,就会看到溶液中生成白色沉淀,沉淀迅速变成灰绿色,最终变成红褐色沉淀。
(3)中学化学中“漂白性”物质能使有机物颜色发生变化或褪色。例如,二氧化硫使品红褪色,新制氯水和过氧化钠都能使品红或紫色石蕊试液褪色等。二氧化硫使溴水、酸性高锰酸钾溶液等无机物褪色,表现出二氧化硫的还原性,乙烯、乙醇等使高锰酸钾溶液褪色,说明乙烯和乙醇等有还原性,但不能说它们有漂白性;乙烯使溴水褪色,说明乙烯中有1个共价键(π键)活泼,与溴单质发生加成反应,不能说明乙烯具有漂白性。
(4)Fe、Fe2+、Fe3+的相互转化,关键是转化条件,不同的氧化剂或不同的还原剂,铁所呈现的价态会不同,有时还与反应物的量有关。例如,铁与硝酸的反应。浓硝酸可使铁钝化,稀硝酸与铁反应时,因铁的用量不同,产物不同。
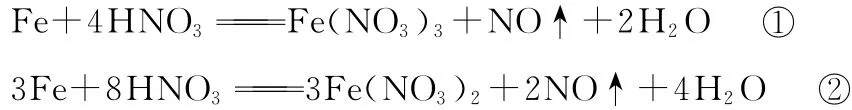
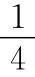
Ⅱ.上述反应可以认为先发生反应①,若Fe有剩余,则发生反应:

易错点6 有机化学综合问题
(1)注重有机物反应的单一性,而忽视对有机物反应多重性的认识。
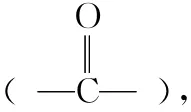
(2)注重代表物结构及性质的共性,而忽视对同类有机物结构及性质特殊性的认识。例如,有机物(CH3)3CCH2OH不能发生消去反应;有机物(CH3)3COH因羟基所连碳原子无氢可失,故不能发生催化失氢反应。
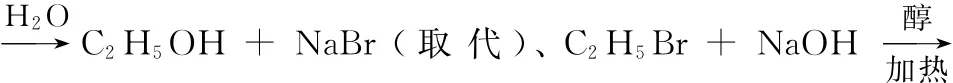
易错点7 化学实验基础知识
(1)水浴加热。水浴加热的温度不超过100℃。教材中用水浴加热的有机实验有:“银镜实验(包括醛类、还原性糖类等的所有银镜实验)”“硝基苯的制取实验(水浴温度为55~60℃)”“乙酸乙酯的水解实验(水浴温度为70~80℃)”和“糖类(包括二糖、淀粉和纤维素等)水解实验(热水浴)”。
(2)用温度计测温度的有机实验:“硝基苯的制取实验”、“乙酸乙酯的制取实验”(以上两个实验中的温度计水银球都是插在反应液外的水浴液中,测定水浴的温度)、“乙烯的实验室制取实验”(温度计水银球插入反应液中,测定反应液的温度)和“石油的蒸馏实验”(温度计水银球应插在蒸馏烧瓶支管口处,测定馏出物的温度)。
(3)中和滴定时,一般选用酚酞或甲基橙作指示剂,石蕊试液由于变色不太明显,滴定时不宜使用;酸碱恰好中和时,所得溶液不一定显中性。例如,用强酸滴定弱碱,由于刚好反应时溶液显酸性,用甲基橙作指示剂误差更小;用强碱滴定弱酸应选用酚酞作指示剂,因为刚好反应时溶液显碱性,这样指示剂的变色范围更接近酸碱恰好中和时溶液的pH;强酸测定强碱用甲基橙(由黄色变橙色),也可以用酚酞作指示剂(但要注意返滴定:最后一滴变无色,返滴一滴又显红色,即为终点)。
(作者单位:河北省衡水市故城县教育局教研室)

