例析近年高考中焓变的命题角度
浙江 李大艳
例析近年高考中焓变的命题角度
浙江 李大艳
化学反应中的热效应一直是高考考查的热点和重点。其中有关焓变的考查更是能量命题的核心内容。
何谓焓变?在恒温恒压条件下,化学反应过程中吸收或释放的热量称为反应的焓变,用ΔH表示,单位常采用kJ·mol-1。吸收热量的反应,其ΔH>0,放出热量的反应,其ΔH<0。下面将结合近3年高考题中有关焓变的试题从以下两个大方面分类例析。
一、焓变(ΔH)正负的判断(即反应是吸热反应还是放热反应)
角度一:根据反应特点进行判断

下列关于上述反应焓变的判断正确的是 ( )
A.ΔH1>0,ΔH3<0
B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3
D.ΔH3=ΔH4+ΔH5
【解析】根据反应特点,碳燃烧放热,故ΔH1<0;二氧化碳和碳反应吸热,故ΔH2>0;CO燃烧反应放热,故ΔH3<0;铁和氧气反应放热,故ΔH4<0;CO还原氧化铁反应吸热,故ΔH5>0;故A、B选项错误。C、D选项考查盖斯定律的应用,此处暂不展开。本题答案为C。
【知识要点】根据反应的特点归纳出常见的放热反应和吸热反应。
常见的放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化;⑥铝热反应等。
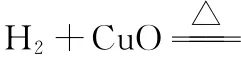
角度二:根据反应物和生成物具备的能量判断
例2 (2016海南,11)由反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是 ( )
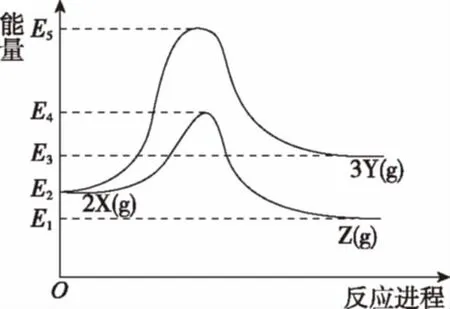
A.由X→Y反应的ΔH=E5-E2
B.由X→Z反应的ΔH<0
C.降低压强有利于提高Y的产率
D.升高温度有利于提高Z的产率
【解析】A选项,由图可知,反应物的总能量为E2,生成物的总能量为E3,所以由X→Y反应的ΔH=E3-E2,故A选项错误;B选项,由图可知,反应物的总能量高于生成物的总能量,由X→Z反应是放热反应,ΔH<0,故B选项正确;C、D选项考查平衡的移动,此处暂不展开。本题答案为B和C。
【知识要点】一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物总能量与生成物总能量的相对大小,若反应物的总能量大于生成物的总能量,该反应放热,ΔH<0;若反应物的总能量小于生成物的总能量,该反应吸热,ΔH>0。
角度三:根据化学反应的本质(化学键断裂和形成时吸收或释放的能量)判断
例3 (2016海南,6节选)顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:
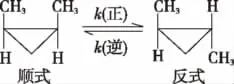
已知:t1温度下,该反应的活化能Ea(正)小于Ea(逆),则ΔH________(填“小于”“等于”或“大于”)0。
【解析】该反应的活化能Ea(正)小于Ea(逆),说明旧键断裂吸收的能量比新键形成放出的能量要少,说明反应是放热反应,故ΔH小于0。本题答案:小于。
【知识要点】当物质发生化学反应时,断开反应物中的化学键(即旧键的断裂)要吸收能量,而形成生成物中的化学键(新键的形成)要释放能量,当旧键断裂吸收的能量高于新键形成放出的能量,反应为吸热反应,ΔH>0;当旧键断裂吸收的能量低于新键形成放出的能量,反应为放热反应,ΔH<0。
角度四:根据平衡移动原理进行判断
①用离子方程式表示Na2CrO4溶液中的转化反应:____________________。
【知识要点】根据平衡移动原理,其他条件不变的情况下,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。故升高温度,若平衡正移,则正反应是吸热反应,若平衡逆移,则逆反应是吸热反应;降低温度,若平衡正移,则正反应是放热反应,若平衡逆移,则逆反应是放热反应。
化学平衡常数的数值随温度的改变而改变,但其改变趋势与反应本身是吸热反应,还是放热反应有关。若升高温度,某反应的化学平衡常数变大,则该反应是吸热反应,反之则是放热反应;若降低温度,某反应的化学平衡常数变大,则该反应是放热反应,反之则是吸热反应。
角度五:根据反应能否自发进行判断
例5 (2016天津,10节选)氢气可用于制备H2O2。
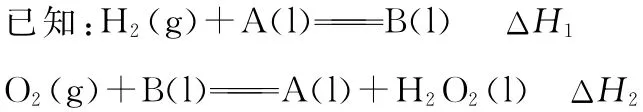
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)=H2O2(l)的ΔH________(填“>”“<”或“=”)0。
【知识要点】判断化学反应方向的综合判据ΔG=ΔHTΔS,若ΔG=ΔH-TΔS<0,反应能自发进行,若ΔG=ΔH-TΔS=0,反应达到平衡状态,若ΔG=ΔH-TΔS>0,反应不能自发进行。
①ΔH<0,ΔS>0的反应一定能自发进行;
③ΔH和ΔS的作用相反,且相差不大时,温度对反应的方向起决定性作用。当ΔH<0,ΔS<0时低温下反应能自发进行;当ΔH>0,ΔS>0时,高温下反应能自发进行。
二、焓变(ΔH)的计算
角度一:利用盖斯定律计算
例6 (2016新课标Ⅱ,26节选)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
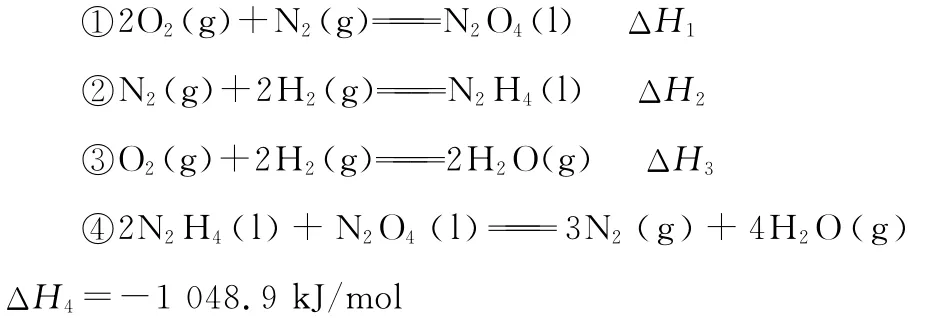
上述反应热效应之间的关系式为ΔH4=________。
【知识要点】盖斯定律:一个化学反应,无论是一步完成,还是分几步完成,其总的热效应是完全相同的。
盖斯定律表明,一个化学反应的焓变只与反应体系的起始状态和最终状态有关,与反应的途径无关。
在城市轨道交通线路实际运营中,经常会发生由于屏蔽门处站台绝缘带绝缘不佳或车站结构渗漏水造成屏蔽门与车站主体结构接触,从而导致屏蔽门打火的情况[8],为了快速消除此打火现象,运营维护人员经常通过常闭车站钢轨电位限制装置来解决。看似该故障已经得到了解决,实际上并没有真正找到造成打火的根本原因。由于常闭车站钢轨电位限制装置使得钢轨长期接地,在某种程度上导致杂散电流的增多[9]。
盖斯定律的常见用法:
(1)方程式加减法
已知焓变的几个热化学方程式,通过一定倍数的相加或相减,得到未知焓变的热化学方程式,则相应的焓变做相同的加减处理即可求得该未知热化学方程式的焓变。
(2)“虚拟路径”法
若反应物A变为生成物D,可以有两个途径:
①由A直接变成D,反应热为ΔH;
②由A变成B,B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:
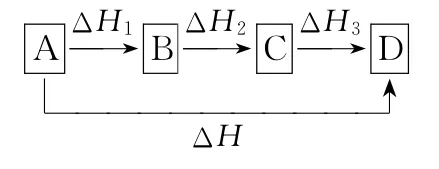
则有ΔH=ΔH1+ΔH2+ΔH3。
角度二:利用键能计算
例7 (2015浙江,28)乙苯催化脱氢制苯乙烯反应:
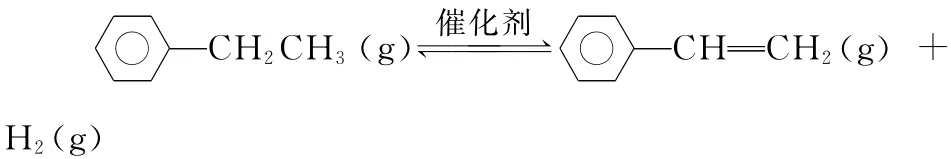
(1)已知:
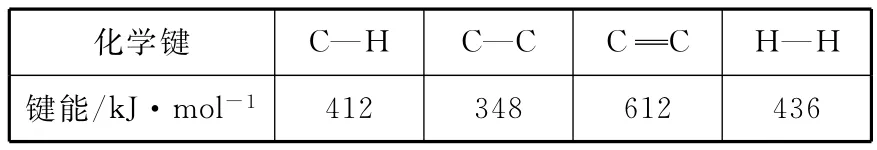
_____化学键 C—H C— C C C H—H_键能/k J·mol-14 1 2 3 4 8 6 1 2 4 3 6__
计算上述反应的ΔH=________kJ·mol-1。
【解析】ΔH=反应物的总键能-生成物的总键能。
反应物的总键能=苯环的键能总和+5个C—H键能+1个C—C键能
ΔH=412kJ·mol-1×5+348kJ·mol-1-412kJ·mol-1×3-612kJ·mol-1-436kJ·mol-1=124kJ·mol-1。本题答案为124。
【知识要点】从键能的角度计算:ΔH=反应物的总键能-生成物的总键能。
提醒:要分析清楚物质中每种的化学键的数目。
角度三:利用物质具备的能量计算
例8 (2014福建,23节选)一定条件,在水溶液中1mol Cl-、Cl(x=1,2,3,4)的能量(kJ)相对大小如下图所示。
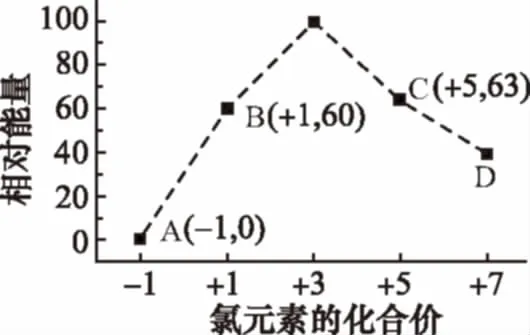
①D是_______________(填离子符号)。
②B→A+C反应的热化学方程式为___________(用离子符号表示)。
【解析】①根据图象可知,D中Cl元素化合价为+7价,所以Cl中x为4,则D为Cl;②根据氯元素的化合价可知,则B→A+C的方程式为,水溶液中的反应,状态为aq,反应放出的热量为63+2×0-3×60=117kJ,反应的焓变为-117kJ/mol。本题答案为①ClCl(aq)+2Cl-(aq)ΔH=-117kJ·mol-1。
【知识要点】从物质具备的能量角度计算:ΔH=生成物的总能量-反应物的总能量。
角度四:利用反应的热量变化计算
例9 (2014安徽,26节选)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101k Pa下,已知该反应每消耗1mol CuCl(s),放出44.4kJ热量,该反应的热化学方程式是___________________。
【解析】由CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体,根据原子个数守恒和质量守恒,写出化学方程式,该反应每消耗1mol CuCl(s),放热44.4kJ,消耗4mol CuCl(s),则放热44.4kJ×4=177.6kJ,故本题答案为4CuCl(s)+
【知识要点】焓变的计算常常与热化学方程式的书写结合考查。
热化学方程式是能表示反应热的化学方程式,不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。在书写时要注意:①应注明反应物、生成物的聚集状态,一般用g表示气体、l表示液体、s表示固体,aq表示水溶液。②应注明反应时的温度和压强(25℃、101k Pa时,可以不注明)。③热化学方程式中化学计量数只表示该物质的物质的量,不表示物质分子个数或原子个数,因此,它可以是整数,也可以是分数。④ΔH只能写在化学方程式的右边,若为放热反应,则ΔH为“-”;若为吸热反应,则ΔH为“+”。其单位一般为kJ/mol或kJ·mol—1。对于同一反应,计量数不同,其ΔH数值不同。
(作者单位:浙江省绍兴市鲁迅中学)

