微粒观在化学中的应用
——以与量有关的离子方程式书写为例
黑龙江 毕占龙 李志昂
微粒观在化学中的应用
——以与量有关的离子方程式书写为例
黑龙江 毕占龙 李志昂
“微粒观”是化学学科的基本观念之一,是化学基本观念的重要组成部分,也是化学基本观念最基础部分。微粒观的建立是化学学习的基本学科素养。具有微粒观能促进学生对化学知识深入系统地理解。从微观视角认识和考查物质世界亦是学生学习化学应掌握的重要思维方法。过量离子方程式的书写能够很好地体现微粒观,用以促进学生掌握微粒观并真正运用于化学学习与研究。从微粒观出发,不用按照特定步骤“写拆删查”书写与量有关的离子方程式,体会运用化学微粒观具有丰富的实用价值。
一、强酸制取弱酸
例1 向Na2CO3溶液中逐滴滴入盐酸溶液至过量。
其反应实质是CO2-3结合H+生成相应弱电解质,逐滴加时,1CO2-3只能结合1H+生成1HCO-3。当完全转化后,1HCO-3再结合1H+生成CO2和H2O。其离子方程式分步写:

若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,H+过量其离子方程式一步完成H2O。
此类反应都是“强酸”制取“弱酸”,满足如下表1酸性强弱顺序,结合表1更容易理解过量问题。需要注意的是将CO2通入含有HS-、ClO-、C6H5O-的溶液中时,无论CO2量多还是量少,只生成HCO-3。

表1
针对训练
1.少量CO2通入NaOH溶液中。
2.过量CO2通入NaOH溶液中。
3.少量CO2通入NaClO溶液中。
4.过量CO2通入苯酚钠溶液中。
二、弱酸酸式盐与碱反应
此类反应的本质是碱中OH-可以结合弱酸酸式酸根微弱电离出的H+生成水,“过量”的解决点就在此处。
例2 Ca(OH)2溶液与NaHCO3溶液反应。
(1)若NaHCO3少量时:只能电离出1HCO-3,需要结合1OH-生成1H2O和1CO2-3,1CO2-3又能结合1Ca2+生成CaCO3沉淀,所以离子方程式为HCO-3+Ca2++
(2)若NaHCO3过量时:以Ca(OH)2为基准,1Ca(OH)2只能电离出1Ca2+和2OH-。2OH-能结合2HCO-3生成2CO2-3和2H2O,2CO2-3中的1CO2-3又能结合1Ca2+生成CaCO3沉淀,另1CO2-3在溶液中游离。离子方程式为CO2-3+2H2O。
针对训练
5.向NH4HCO3溶液中加入足量NaOH溶液。
6.向NH4HCO3溶液中加入少量NaOH溶液。
三、与铝有关的过量问题
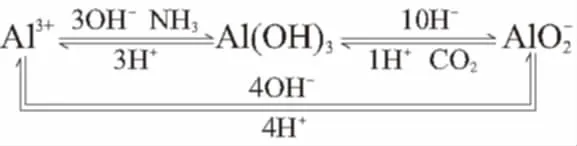
例3 明矾溶液与Ba(OH)2溶液反应。
(1)若明矾少量,可提供1Al3+和2SO2-4,1Al3+可结合4OH-生成1AlO2-和2H2O,2SO2-4可结合2Ba2+生成2BaSO4沉淀。离子方程式:Al3++2SO2-4+2Ba2++4OH-
(2)若Ba(OH)2少量,可提供1Ba2+与2OH-。1Ba2+需要1SO2-4生成1BaSO4沉淀,2OH-结合2/3Al3+生成2/3Al(OH)3。离子方程式:3Ba2++6OH-+2Al3++
针对训练
7.足量NaOH溶液与AlCl3溶液混合。
8.少量CO2通入NaAlO2溶液中。
四、氧化还原反应
氧化还原反应过量多是因为一种物质中同时含有两种还原性微粒,存在反应先后顺序问题。通常需要依照氧化/还原性顺序判断。
氧化性:Cl2>Br2>Fe3+>I2>S
还原性:Cl->Br->Fe2+>I->S2-
例4 Cl2通入FeBr2溶液中。
(1)Cl2少量,1Cl2可得到2e-能氧化2Fe2+,离子方程式为
(2)氯气过量,应以FeBr2为准,1FeBr2能提供1Fe2+和2Br-,共失去3e-需要1.5Cl2,离子方程式为3Cl2+4Br-+
需注意,以下反应一种物质虽过量,但离子方程式不变:
①过量二氧化锰与浓盐酸。
②过量铜与浓硫酸。
③铁与过量的浓硫酸。
针对训练
9.等物质的量的Cl2通入FeBr2溶液中。
10.0.05mol Cl2通入含0.04mol FeI2溶液中。
高中化学的学习是处于较高层次的学习,是培养学生从感性到理性、从现象到本质、从宏观到微观的科学素养形成阶段,最终形成微粒观。而微粒间的作用是物质微粒性认识微观视角的核心,它可以统领化学学习,有效地深化学生的微观意识。形成良好的微粒观对以后学生进一步研究化学有深刻意义。
针对训练参考答案

(作者单位:黑龙江省哈尔滨市阿城区第一中学)

