高三化学模拟试题(一)
北京 仲 卿
高三化学模拟试题(一)
北京 仲 卿
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 S—32 Cl—35.5 Fe—56 Cu—64
第Ⅰ卷(选择题 共42分)
一、选择题(本大题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.(原创)化学与人类的生活、生产息息相关,下列说法正确的是( )
A.BaSO4在医学上用作“钡餐”,Ba2+对人体无害
B.棉、蚕丝、合成纤维完全燃烧都只生成CO2和H2O
C.光导纤维的主要成分是单质硅,太阳能电池使用的材料是SiO2
D.“地沟油”禁止食用,但可以用来制肥皂或燃油
2.(原创)设NA为阿伏加德罗常数,下列说法中不正确的是( )
A.常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4 NA
B.1L1mol/L饱和FeCl3滴入沸水中完全水解生成Fe(OH)3胶体粒子个数为NA个
C.电解精炼铜的过程中转移了NA个电子,则阴极析出32g铜
D.1LpH=1的硫酸溶液中,含有0.1 NA个H+
3.(改编题)2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家分获,以表彰他们在“分子马达”研究方面的成就,一种光驱分子马达结构如下图所示。有关该分子的说法正确的是( )

A.该分子中有两个手性碳原子
B.两个苯环不可能处于同一平面
C.能与NaHCO3和酸性KMnO4溶液反应
D.1mol该分子最多可与2mol H2发生加成
4.X、Y、Z、W是原子序数依次增大的短周期元素,X的一种原子没有中子,Y、Z易形成质量比为3∶4和3∶8的两种常见化合物,W所在的周期数和族序数相同。下列说法正确的是( )
A.W的最高价氧化物对应水化物是强碱
B.原子半径:Y<Z<W
C.X、Y可以形成既有极性键也有非极性键的化合物
D.原子最外层电子数:W>Z>Y
5.(原创)下列实验对应的现象及结论均正确且两者具有因果关系的是( )
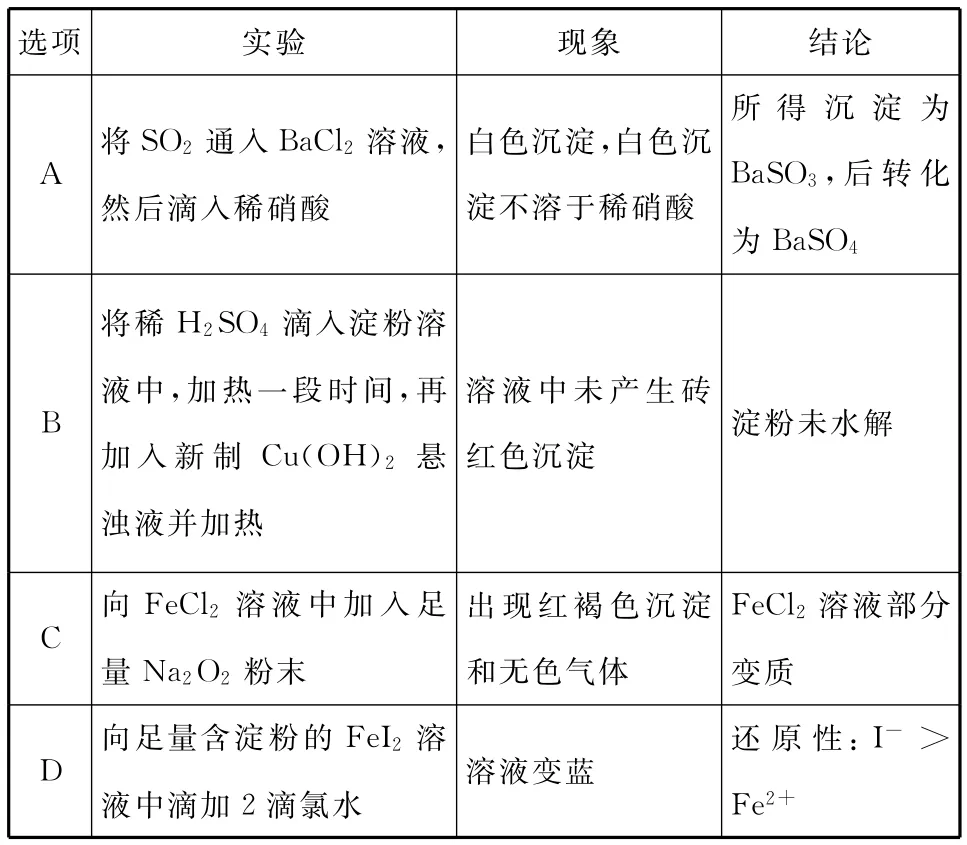
选项__________实验现象结论A将SO2通入BaCl2溶液,然后滴入稀硝酸白色沉淀,白色沉淀不溶于稀硝酸所得沉淀为BaSO3,后转化________________________________________________为BaSO4__________B将稀H2SO4滴入淀粉溶液中,加热一段时间,再加入新制Cu(OH)2悬浊液并加热溶液中未产生砖红色沉淀淀粉未水解FeCl2溶液部分C向FeCl2溶液中加入足______量Na2O2粉末出现红褐色沉淀和无色气体______变质__________D向足量含淀粉的FeI2溶______液中滴加2滴氯水溶液变蓝还原性:I->Fe2+
6.近几年,科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是( )

B.有机电解质和水溶液不可以互换区域
C.标况下产生22.4L的氢气时,正极消耗锂的质量为14g
D.该装置不仅可提供电能,还可得到清洁的能源
7.(原创)25℃时,下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol·L-1CH3COONa溶液与0.05mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
B.0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH+4)>c(Cl-)>c(OH-)
C.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中c(CH3COO-)+c(H+)>c(Na+)+c(OH-)
D.向浓度为0.1mol·L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)
第Ⅱ卷(非选择题 共58分)
二、非选择题(包括必做题和选做题两部分。第8~10题为必做题,每道试题考生都必须作答。第11、12题为选做题,考生根据要求作答)
(一)必做题
8.(15分)某化学小组探究酸性条件下NO-3、SO2-4、Fe3+三种微粒的氧化性强弱,设计如右图实验(夹持仪器已略去,装置的气密性已检验)。(忽略氧气对反应的影响)

实验记录如下:

实验序号实验操作实验现象Ⅰ向A装置中通入一段时间的SO2气体A中黄色溶液迅速变成深红棕色,最终变为浅绿色Ⅱ取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀

续表
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是_____________________。(用化学用语和简单文字叙述)
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质反应方程式为请用化学平衡移动原理解释实验Ⅰ中溶液颜色变化的原因:_________________________________________________。
(3)实验Ⅱ中发生反应的离子方程式是___________________________________。
(4)实验Ⅲ中,浅绿色溶液变为黄色的原因是______________________________________________________________。
(5)实验Ⅳ中液面上方有少量红棕色气体生成,发生反应的方程式是_________________________________________。
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是NO3->Fe3+>SO2-4。请从微粒变化的角度解释:______________________________________________________。
9.(改编题)(14分)雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化,反应的化学方程式为2NO(g)+
①已知部分化学键的键能如下:
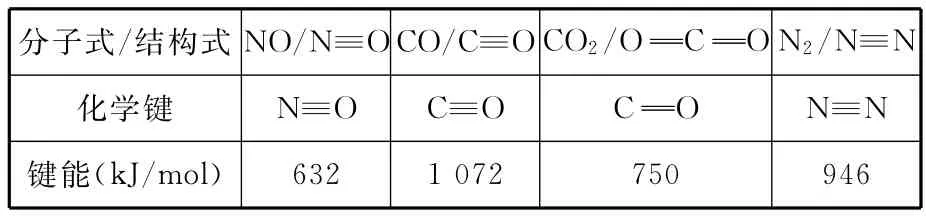
分子式/结构式NO/N≡O CO/C≡O CO2/O C O N2/N≡N化学键N≡O C≡O C O N≡N_键能(kJ/mol)632 1 072 750 946__
请计算上述反应的ΔH=________kJ/mol
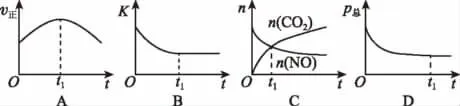
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是______(填选项字母)。(下图中v正、K、n、p总分别表示正反应速率、平衡常数、物质的量和总压强)
③在T℃下,向体积为10L的恒容密闭容器中通入NO和CO,测得了不同时间时NO和CO的物质的量如下表:

_______时间/s ________0 1 2 3 4 5_n(NO)/×10-2mol 10.0 4.50 2.50 1.50 1.00 1.00_n(CO)/×10-1mol 3.60 3.05 2.85 2.75 2.70 2.70
T℃时该反应的平衡常数K=________,既能增大反应速率又能使平衡正向移动的措施是_____________________________(写出一种即可)。
(2)如图l所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物),写出生成这种硝化剂的阳极电极反应式:________________________________________。

(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响:____________________________,给出合理的解释:________________________________________。
10.(14分)铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作________剂。
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:

(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是__________________________________________________。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________________________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是__________________________________________________________。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是__________________________________________________。
(二)选做题
11.【物质结构与性质】(15分)
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界。
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为________,基态铁原子有________个未成对电子,Fe3+的电子排布式为________。
(2)硝酸钾中NO3-的空间构型为_________,写出与NO3-互为等电子体的一种非极性分子化学式:__________。
(3)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_________。Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)Fe(s)+xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有________、________。
(4)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有_________。

图1

图2

(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该反应的化学方程式:_______________________,若两个最近的Fe原子间的距离为s cm,则该晶体的密度是________g·cm-3。
12.【有机化学基础】(15分)
有机物K是治疗高血压药物的重要中间体,它的合成路线如下(部分转化条件略去)。



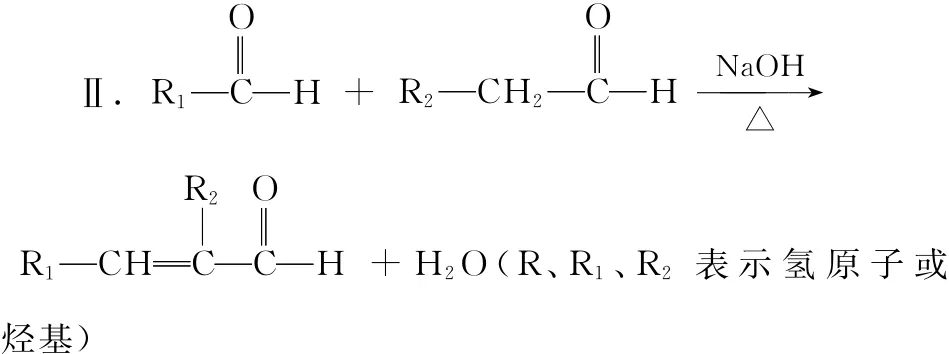
(1)A的结构简式是________。
(2)B→C的反应类型是________。
(3)F中含有的官能团是________。
(4)G与E生成H的化学方程式是________________。
(5)C→D的化学方程式是________________________。
(6)I的结构简式是________。
(7)有关J的说法中,正确的是________(填字母)。
a.能与NaHCO3反应
b.能与NaOH反应
c.能与新制Cu(OH)2反应
【参考答案及解题提示】
1.D 【解析】硫酸钡不溶于水,可作钡餐,但钡离子能使蛋白质发生变性,对人体有害,故A错误;蚕丝的主要成分为蛋白质,完全燃烧可生成水、二氧化碳和氮氧化合物等,故B错误;二氧化硅对光具有良好的全反射作用,Si为常见的半导体材料,而光导纤维的主要成分是SiO2,太阳能电池使用的材料是单质硅,故C错误;“地沟油”中主要含油脂,还含有害物质,不能食用,但可用来制肥皂(碱性条件下水解)或燃油(油脂能燃烧),故D正确。
2.B 【解析】Na2O2与H2O的反应为歧化反应:此反应生成1mol O2转移2mol电子,故生成0.2mol O2,转移电子的数目为0.4 NA,故A正确;一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的氢氧化铁胶粒的个数小于NA个,故B错误;电解精炼铜时,阴极是铜离子放电,若转移了NA个电子,有0.5mol铜单质生成,质量为0.5mol×64g/mol=32g,故C正确;pH=1说明氢离子的浓度为c(H+)=0.1mol/L,所以n(H+)=0.1mol/L×1L=0.1mol,即为0.1 NA个,故D正确。
4.C 【解析】X、Y、Z、W是原子序数依次增大的短周期元素,X元素X的一种原子核内无中子,应为H元素;Y、Z易形成质量比为3∶4和3∶8的两种常见化合物,则形成两种化合物为YZ、YZ2,所以该常见化合物为CO、CO2,则Y为C元素,Z为O元素;W所在的周期数和族序数相同,而且原子序数大于O,所以W为Al元素。W为Al元素,其最高价氧化物对应水化物是两性氢氧化物,故A错误;电子层数越多,原子半径越大,电子层相同时,原子序数越大,半径越小,所以原子半径:Z<Y<W,故B错误;H、C可以形成既有极性键也有非极性键的化合物,如C2H6,故C正确;原子最外层电子数:O>C>Al,即Y>Z>W,故D错误。
5.D 【解析】将SO2通入BaCl2溶液不能发生反应,再滴入稀硝酸发生氧化还原反应生成硫酸钡,但SO2通入BaCl2溶液中不反应,则开始不能生成亚硫酸钡沉淀,现象不合理,A错误;将稀H2SO4滴入淀粉溶液中,加热一段时间,冷却后加入氢氧化钠溶液中和稀硫酸,至溶液呈碱性时再加入新制Cu(OH)2悬浊液并加热,然后根据是否生成砖红色沉淀判断淀粉的水解情况,该实验中没有用氢氧化钠溶液中和稀硫酸,则该结论不一定合理,B错误;过氧化钠具有强氧化性,可氧化亚铁离子,则不能说明FeCl2溶液部分变质,C错误;氯水先氧化碘离子产生I2,碘单质遇淀粉变蓝,则由现象可知还原性:I->Fe2+,D正确。
6.C 【解析】根据图示信息知道,碳电极上产生氢气,应该是正极,该电极上发生得电子的还原反应:2H2O+2e-,故A正确;由于金属Li可以和水之间反应生成氢氧化锂和氢气,但是和有机电解质不反应,所以有机电解质和水溶液不可以互换区域,故B正确;金属Li可以和水之间反应生成氢氧化锂和氢气应是自发的氧化还原反应,即为,标准状况下产生22.4L的氢气时,金属锂是负极,负极消耗锂的质量为14g,故C错误;该原电池是将化学能转化为电能的装置,装置不仅可提供电能,并且反应产物是氢气,能提供能源,故D正确。
7.C 【解析】0.1mol·L-1CH3COONa溶液与0.05mol·L-1盐酸等体积混合后发生反应CH3COONa+反应后是含等物质的量CH3COONa、NaCl、CH3COOH的混合溶液,因为溶液显酸性,则说明CH3COOH的电离大于CH3COO-水解。弱电解质的电离程度是很微弱的。所以c(Cl-)>c(H+),因此故该溶液中各离子浓度的大小关系为c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),A错误;溶液中存在电荷守恒c(H+)+c(NH+4)=c(OH-)+c(Cl-),由于c(H+)<c(OH-),则c(NH+4)>c(Cl-),则说明氨水电离程度大于铵根离子的水解程度,则c(NH3·H2O)<c(Cl-),故c(NH+4)>c(Cl-)>c(NH3·H2O)>c(OH-),故B错;pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合得到醋酸和醋酸钠的混合溶液,溶液呈酸性,则c(CH3COO-)>c(Na+),c(H+)>c(OH-),则c(CH3COO-)+c(H+)>c(Na+)+c(OH-),C正确;向浓度为0.1mol·L-1的NaHCO3溶液中滴加少量盐酸会产生二氧化碳,则),故D错误。
8.(1)Fe3++3H+(1分),加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解 (2分)
(2)Fe3+和SO2生成红棕色的Fe(SO2反应速率较快(2分),而反应2Fe3++反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液 (2分)
(3)Ba2++
(4)3Fe2++(1分)
(5)2NO+O2
(6)实验Ⅱ中溶液中检出Fe2+和SO,说明Fe3+氧化SO2生成SO,氧化性Fe3+>SO(2分) 实验Ⅲ中溶液变黄色、Ⅳ中检出Fe3+和NO生成,说明酸性条件下NO-3氧化Fe2+,氧化性NO-3>Fe3+(2分) 所以,在酸性条件下,氧化性强弱:NO-3>Fe3+>SO(1分)
【解析】(1)配制FeCl3溶液时,常常加入盐酸,目的是抑制;加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解。(2)由题意可知,溶液中Fe3+呈黄色,与SO2生成红棕色的Fe(SO2)3+6,后Fe3+与SO2发生氧化还原反应,生成Fe2+,得到浅绿色溶液,所以实验Ⅰ中溶液颜色变化的原因为Fe3+和SO2生成红棕色的Fe(SO2)36+反应速率较快而反应反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液。(3)反应Ⅱ中Ba2+与SO2-4生成BaSO4沉淀,发生反应的离子方程式是。(4)实验Ⅲ中,浅绿色溶液变为黄色的原因是硝酸将Fe2+氧化为Fe3+,反应的方程式为(5)实验Ⅳ中液面上方有少量红棕色气体生成,是由于NO与氧气反应生成红棕色的NO2,发生反应的方程式是2NO+O2(6)实验Ⅱ中溶液中检出Fe2+和SO2-4,说明Fe3+氧化SO2生成SO2-4,氧化性Fe3+>SO2-4;实验Ⅲ中溶液变黄色、Ⅳ中检出Fe3+和NO生成,说明酸性条件下NO-3氧化Fe2+,氧化性:NO-3>Fe3+;所以,在酸性条件下,氧化性强弱:NO-3>Fe3+>SO2-4。
9.(1)①-538 (1分) ②ABC (3分) ③500 (1分)加压 (1分)
(3)300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小 (2分) 300℃之前,反应未平衡,反应向右进行,脱氮率增大 (2分),300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小 (2分)
【解析】(1)①化学反应的焓变等于反应物旧键断裂吸收的能量和产物中新键生成释放的能量之差,所以2NO(g)+2-946-4×750)kJ/mol=-538kJ/mol。②t1时正反应速率仍然在变化,说明没有达到平衡状态,故A错误;平衡常数只受温度的影响,反应在恒温、恒容的密闭体系中进行,K始终不变,故B错误;t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故C错误;反应前后气体的系数和变化,所以总压不变的状态证明达到了平衡状态,故D正确。
③NO和CO反应生成CO2和N2,反应方程式为

起始浓度:1×10-23.6×10-200
转化浓度:0.9×10-20.9×10-20.9×10-20.45×10-2
平衡浓度:0.1×10-22.7×10-20.9×10-20.45×10-2
10.(1)氧化 (1分)
(2)1 (1分) 3 (1分) 8H+(1分) 2 (1分)3 (1分) 4 (1分)

【解析】(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,Ce元素的化合价由+4价降低为+3价,则CeO2在反应中作氧化剂。(2)反应中Cr元素化合价由+6价降低到+3价,S元素化合价由+4价升高到+6价,则最小公倍数为6,由电子守恒和原子守恒、电荷守恒可知配平后的离子方程式为4H2O。(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,反应的化学方程式为4Na+(4)①FeS除去Cu2+的反应是沉淀的转化,即;②对滤液Ⅱ加H2O2的目的是将Fe2+氧化为Fe3+,然后调pH使Fe3+转化为氢氧化铁沉淀,从而除去Fe3+;③NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶。
11.(1)8 (1分) 4 (1分) 1s22s22p63s23p63d5(1分)
(2)分子晶体 (1分) 5 (1分) 金属键、共价键(1分)
(3)平面正三角形 (1分) SO3等 (1分)
(4)C、N、O、S (1分)
(5)sp2、sp3(1分) 极性键、配位键 (1分) 9∶1(1分)

(2)取代反应 (1分)
(3)醛基 (1分)

(7)b (1分) c (1分)

(作者单位:北京市顺义区第八中学)

