“超级全能生”2017高考全国卷26省联考(乙卷)(本卷适用于全国卷Ⅰ地区)
“超级全能生”2017高考全国卷26省联考(乙卷)(本卷适用于全国卷Ⅰ地区)
[编者按]本次考试由新东方优能中学、《教学考试》杂志社、天利38套共同发起组织,全国26个省市的数十万考生参加,试题创新度较高,吻合高考命题趋势,本刊特刊发以供广大读者考前模拟检测,希望对大家备考有所帮助。
可能用到的相对原子质量:H—1 C—12 O—16 Al—27 N—14 S—32 Fe—56
第Ⅰ卷(选择题 共42分)
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
7.化学与生产、生活密切相关。下列叙述正确的是( )
A.铜既可以发生析氢腐蚀又可以发生吸氧腐蚀
B.在正规化学试卷的开始处总有“可能用到的相对原子质量”一项,如H—1、C—12、S—32、Cl—35.5、Cu—64等,这些数值准确的概念应该是某种元素的平均相对原子质量
C.氨气可用作制冷剂,是因为氨气溶于水生成的一水合氨电离而吸热
D.标准状况下,2.24L甲醛所含共价键数目为0.4 NA
8.下列化学反应的离子方程式正确的是( )
③等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:
④Na2O2加入H218O中:2Na2O2+4OH-+18O2↑
A.①③B.③④
C.②③D.①②
9.已知在NaHSO3溶于水后,它的电离程度远大于水解程度,已知有平衡,欲使溶液中c(HSO-3)、c(H2SO3)、c(OH-)均下降,可采用的方法是( )
A.加适量水B.通入Cl2
C.加消石灰固体D.加热
10.下列叙述错误的是( )
A.在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+
B.40mL 1mol/L CH3COONa溶液与20mL 1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(H+)>c(Cl-)>c(OH-)
C.已知:Ksp[Cd(OH)2]=7.2×10-15,Ksp[Co(OH)2]=1.8×10-15,则在常温下的Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的4倍
D.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液中:2c(OH-)=2c(H+)+c(HA)-c(A-)
设计成如图所示的原电池。下列判断不正确的是( )

A.为证明反应的发生,可取甲中溶液加入酸性高锰酸钾溶液
B.反应开始时,甲中石墨电极上Fe3+被还原,乙中石墨电极上发生氧化反应
C.电流计读数为零时,在甲中加入FeCl2固体后,甲中石墨电极为负极
D.此反应正反应方向若为放热反应,电流计读数为零时,降低温度后,乙中石墨电极为负极
12.用下列实验装置进行相应实验,不能达到实验目的的是( )

A.甲:完成“喷泉”实验
B.乙:除去硫酸铜晶体中的结晶水
C.丙:收集NO气体
D.丁:检验铁粉与水蒸气反应产生的氢气
下列关于该化合物的说法正确的是( )
A.1mol该有机物充分燃烧将消耗氧气24mol
B.1mol该化合物最多可以与9mol H2发生加成反应
C.既可以使溴的四氯化碳溶液褪色,又可以使酸性KMnO4溶液褪色
D.该化合物至少有11个碳原子处于同一平面上
第Ⅱ卷(非选择题 共58分)
二、非选择题(包括必考题和选考题两部分)
(一)必考题(本题共3小题,共43分)
26.(14分)短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B、D、E均能形成共价型化合物。A和B形成的化合物的水溶液呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是___________(填元素符号,下同);非金属性最强的是________。
(2)由A分别和B、D、E所形成的共价化合物中,热稳定性最差的是________(用化学式表示)。
(3)A和C 形成的化合物的电子式为________。
(4)C和E各自的最高价氧化物对应的水化物之间反应的离子方程式为__________________________________。
(5)C的单质在氧气中燃烧的产物存在的化学键类型为________;其化学反应方程式为_____________________。
(6)仅根据熵判据________(填“能”或“不能”)准确推测D的单质燃烧的自发性。
27.(14分)利用氢气对废气进行处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
②2H2O(l)+571.6kJ/mol
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式:________________________________________。
(2)某研究小组探究如下:向2L恒容密闭容器中充入2mol NO发生反应O2(g),在不同的温度下,反应过程中NO的物质的量与时间的关系如图所示:

①T2温度下,在0~5min内,v(O2)=__________mol·L-1·min-1;该温度下反应2NO(g)的平衡常数K=________(计算结果保留到小数点后两位)。
②该反应进行到M点放出的热量________(填“>”“<”或“=”)进行到W点放出的热量;M点时再加入一定量NO,平衡后NO的转化率______(填“变大”“变小”或“不变”)。
③反应开始至平衡的过程中,容器中下列各项发生变化的是________(填序号)。
A.混合气体的密度
B.逆反应速率
C.单位时间内,N2和NO的消耗量之比
D.气体的平均相对分子质量
(3)氢气虽为一种理想燃料,但不利于储存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是________(填序号)。
A.增加LaNi5H6(s)的量
B.升高温度
C.使用催化剂
D.减小压强
28.(15分)某科研小组以某种铝硅酸盐矿物——钾长石(K2Al2Si6O16)为主要原料提取氧化铝、碳酸钾等物质,工艺流程如图所示。

(1)若用氧化物的形式表示物质的化学组成,则该矿物(K2Al2Si6O16)可表示为____________________________。
(2)煅烧过程中钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式:____________________________________________________。
(3)钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的KAlO2和NaAlO2,在浸出液中通入过量CO2,发生反应的离子方程式为_____________________。
(5)“转化”时加入NaOH的主要作用是________________________(用离子方程式表示)。
(6)上述工艺中可以循环利用的主要物质是__________、__________和水。
(二)选考题(从给出的2个小题中任选一题作答,若多做则按所做第1题计分)
35.[化学—物质结构与性质](15分)
已知A、B、C、D、E五种元素均位于前四周期,原子序数依次增大。下表给出五种元素的相关信息,根据以下信息填空。

元素相关信息A原子所处的周期数、族序数都与其原子序数相等B原子的最外层p 轨道的电子为半充满结构C原子L电子层上有2对成对电子D元素的主族序数与周期数的差为4 E 元素位于周期表的第六列
(1)E 原子的核外价电子排布式为________。
(2)已知BA5为离子化合物,写出其在A2C中反应的化学方程式:_________________________________________。
(3)B的基态原子中能量最高的电子的电子云在空间有________个伸展方向,该原子轨道的空间伸展方向呈________形。
(4)B、C两种元素的第一电离能的大小关系为________(用元素符号表示)。
(5)BD3分子中,中心原子的杂化方式为_____________,其分子的立体构型为________。
(6)在ED3溶液中,一定条件下存在组成为[EDn(A2C)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[EDn(A2C)6-n]x++xR—H→Rx[EDn(A2C)6-n]+xH+。将含0.001 5mol[EDn(A2C)6-n]x+的溶液与R—H完全交换后,中和生成的H+需25.00mL浓度为0.120 0mol/L的NaOH溶液,则该配离子的化学式为________。
(7)金属Al与本题中提到的B的原子可组成一种新型无机非金属材料AlB,具有耐高温、耐磨性能。它的晶体类型为________,其晶胞与金刚石晶胞相似,已知晶胞边长为apm,则该晶胞的密度为________g/cm3。(用含a、NA的式子表示)
36.[化学—有机化学基础](15分)
有机物X是某种药物的主要成分,工业上合成该化合物的一种路线如下(部分反应物、反应条件略去):

已知:酯与含羟基的化合物可发生酯交换反应:

(1)反应①所需的试剂是________;反应②的反应类型是________。
(2)B 中含氧官能团的名称是________;反应④的产物除了X以外,另一种产物的名称是_____________________。
(3)D在一定条件下能发生缩聚反应生成高分子化合物,该高分子化合物的结构简式为___________________。
(4)反应③的化学方程式为_________________________。
(5)E的同分异构体有多种,写出符合下列条件的有机物的结构简式:_____________________________________。
Ⅰ.苯环上一氯代物只有一种 Ⅱ.与氯化铁溶液发生显色反应 Ⅲ.能与碳酸氢钠溶液反应放出CO2
【参考答案及解题提示】
7.D 【解析】A项,铜的活动性比H弱,因此不能发生析氢腐蚀,错误;B项,试卷中提供的相对原子质量为近似相对原子质量,错误;C项,液氨作制冷剂,是因为液氨容易汽化,汽化时吸热,错误;D项,标准状况下甲醛为气体,2.24L甲醛所含共价键数目为0.4 NA,正确。
8.C 【解析】①中HI为强酸,应拆为离子形式,错误;④Na2O2与水的反应中,Na2O2既作氧化剂又作还原剂,因此生成的氧气中不含18O,错误。
9.B 【解析】A项,HSO-3的电离程度大于水解程度,NaHSO3溶液显酸性,加适量水稀释,酸性减弱,则c(OH-)增大,错误;B项,通入Cl2,发生反应HSO-3+Cl2+c(OH-)均减小,正确;C项,加消石灰,固体c(OH-)增大,错误;D项,加热,电离平衡、水解平衡均向正反应方向移动,c(HSO-3)减小,但该离子以电离为主,c(H+)增大,c(OH-)减小,错误。
10.B 【解析】A项,Fe3+水解:Fe3++3H+,加入MgO,c(H+)减小,能促进水解反应不断正向进行,将Fe3+转化为Fe(OH)3,正确;B项,反应后得到等物质的量浓度的CH3COONa、CH3COOH、NaCl的混合溶液,溶液呈酸性,说明CH3COOH的电离程度大于CH3COONa的水解程度,则c(CH3COO-)>c(Cl-)>c(H+)>c(OH-),错误;C项,该混合悬浊液中=4,正确;D项,反应后得到等物质的量浓度的HA和NaA混合溶液,根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-)及物料守恒:2c(Na+)=c(A-)+c(HA),可得:c(HA)+2c(H+)=c(A-)+2c(OH-),即2c(OH-)=2c(H+)+c(HA)-c(A-),正确。
11.A 【解析】A项,酸性高锰酸钾能氧化Fe2+和Cl-,不能用酸性高锰酸钾溶液证明该反应的发生,错误;B项,反应开始时,甲中石墨电极上Fe3+得电子变成Fe2+,被还原,乙中石墨电极上I-失去电子变成I2,被氧化,正确;C项,G示数为零时,原电池反应达到平衡,甲中溶入FeCl2固体,平衡2Fe3+++I2向逆反应方向移动,甲中Fe2+被氧化为Fe3+,发生氧化反应,甲中石墨为负极,正确;D项,降低温度后,平衡2Fe3+++I2向正反应方向移动,乙中I-被氧化为I2,发生氧化反应,乙中石墨作负极,正确。
12.A 【解析】A项,氯气在水中溶解度不大,通入水中不能形成喷泉,错误;B项,除去硫酸铜晶体中的结晶水,可以在坩埚中加热,正确;C项,NO的密度比CO2小,且与CO2不反应,可以用向下排CO2法收集,正确;D项,可以用火柴点燃肥皂泡检验铁与水蒸气反应生成的氢气,正确。
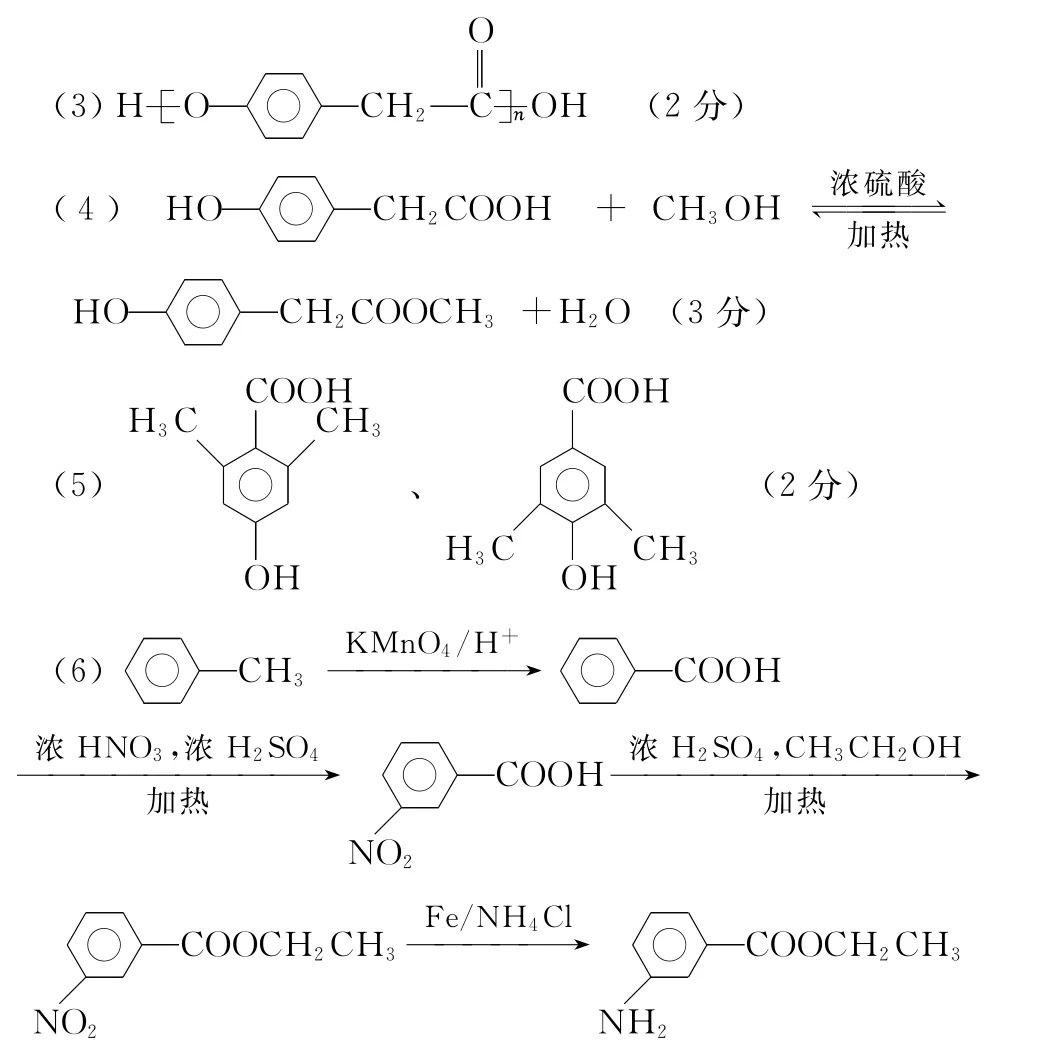
26.(14分)
(1)Na (1分) Cl (1分)
(2)PH3(2分)
(3)Na+[H]-(2分)
(4)H++OH-
(2分)
(6)不能 (2分)
【解析】根据提供信息,可以推断A为H,B为N,C为Na,D为P,E为Cl。(1)五种元素中,Na的原子半径最大;根据非金属性强的元素位于元素周期表的右上方,故Cl的非金属性最强。(2)非金属性越强,氢化物越稳定,非金属性:N>P、Cl>P,故P的氢化物PH3的稳定性最差。(3)Na、H形成NaH,为离子化合物,电子式为Na+[H]-。(4)Na、Cl的最高价氧化物的水化物分别为NaOH、HClO4,分别为强碱、强酸,反应的离子方程式为(5)Na在O2中燃烧生成Na2O2,Na2O2中含有离子键和非极性共价键。(6)判断反应的自发性,要综合焓判据和熵判据,故不能仅根据熵判据准确推测P单质燃烧的自发性。
27.(14分)
(1)2H2(g)+
ΔH=-752.1kJ/mol (2分)
(2)①6.25×10-2(2分) 0.44 (2分) ②<(2分) 不变 (2分) ③BC (2分)
(3)BD (2分)
【解析】(1)根据盖斯定律,由①-②,可得:2H2(g)+N2(g)+2H2O(l),则ΔH=-180.5kJ/mol-571.6kJ/mol=-752.1kJ/mol。(2)①v(O2)=达平衡时,NO为0.5mol,N2、O2均为0.75mol,则K=②M点NO的转化率低于W点NO的转化率,故放出热量少。M点时再充入NO,相当于增大压强,该反应前后气体分子数不变,因此加压平衡不移动,NO的转化率不变。③A项,反应体系全为气体,气体质量不变,容器体积不变,因此密度始终不变,错误;B项,反应过程中各物质的浓度发生变化,因此逆反应速率发生变化,正确;C项,N2和NO的消耗量分别代表逆反应速率和正反应速率,因此比值会发生变化,正确;D项,反应体系全为气体,反应前后气体分子数不变,因此平均相对分子质量不变,错误。(3)A项,增加固体的量,平衡不移动,错误;B项,该反应为放热反应,升高温度,平衡逆向移动,释放气态氢,正确;C项,使用催化剂,平衡不移动,错
误;D项,减小压强,平衡逆向移动,释放气态氢,正确。28.(15分)
(1)K2O·Al2O3·6SiO2(2分)
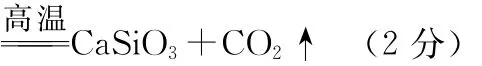
(3)AlO-2+2H2O+
(2分)
(4)碱 (1分) 抑制AlO-2的水解 (2分) 提高浸取速率 (2分)
(5)HCO-3
(6)Na2CO3(1分) CO2(1分)
【解析】(1)该矿物可表示为K、Al、Si的氧化物,根据金属的活动性顺序以及原子守恒,该矿物可表示为K2O·Al2O3·6SiO2。(4)浸取时应抑制AlO-2的水解,因此应保持溶液呈碱性。(5)根据通入过量CO2,反应后滤液中含有HCO-3,加入NaOH溶液发生反应:HCO-3+。(6)根据工艺流程图知,
Na2CO3、CO2可以循环利用。35.(15分)
(1)3d54s1(2分)
(3)3 (1分) 哑铃(或纺锤) (1分)
(4)N>O (2分)
(5)sp3(1分) 三角锥形 (1分)
(6)[CrCl(H2O)5]2+(2分)
【解析】根据提供信息,可以推断A为H,B为N,C为O,D为Cl,E为Cr。(1)Cr的核外价电子排布式为3d54s1。(2)NH5为离子化合物,由NH+4、H-组成,即为NH4H,在H2O中发生氧化还原反应:NH3↑+H2↑。(3)N的基态原子中能量最高的电子为2p轨道上的电子,其电子云在空间有3个伸展方向,呈哑铃(或纺锤)形。(4)N原子2p轨道上半充满,为稳定结构,其第一电离能比O大。(5)NCl3中N形成3个共价键,有一对孤对电子,因此N的杂化类型为sp3,分子的空间构型为三角锥形。(6)n(H+)=n(OH-)=0.025L×0.120mol/L=0.003mol,根据离子交换反应,则1∶x=0.001 5∶0.003,解得x=2,Cr为+3价,则n=3-x=1,故该配离子的化学式为[CrCl(H2O)5]2+。(7)该晶体熔点高,硬度大,则为原子晶体。其晶胞与金刚石晶胞相似,金刚石晶胞中含有8个C,则AlN晶胞中含有4个N、4个Al,故密度为
36.(15分)
(1)浓硝酸、浓硫酸 (1分) 还原反应 (1分)
(2)硝基 (1分) 甲醇 (1分)(4分)