化学思想方法在实验考查中的渗透
江苏 陈 方
化学思想方法在实验考查中的渗透
江苏 陈 方
有关背景
普通高中《化学课程标准(实验)》中明确提出了高考对化学思想方法的考查要求,并在“化学实验基础”中提到“初步认识实验方案设计、实验条件控制、数据处理等方法在化学学习和科学研究中的应用”。研究近年高考化学实验试题也能发现,涉及“比较、分类(类比)思想”“变量控制思想”“绿色化学思想”等的考查成了独特而靓丽的风景。本文举例分析、阐述了这些思想方法在解决化学实验类试题中的价值,引导学生在学习过程中,不断体验和运用这些思想方法,进而不断形成化学核心素养。
有关思想方法
1.比较、分类(类比)思想
类比是根据两个(或两类)对象之间在某些属性上的相同或相似所作的一种类推,化学学习中该策略运用得比较普遍。比较是对两种或两种以上易混淆的相关事物进行对比分析的一种常用方法。比较不仅能揭示新概念的关键特征,而且能更容易掌握新概念的内涵。它们均是精加工的重要方法。
不同物质的属类、结构、性质、制备等诸方面可能有某些相似甚至相同之处。学习中运用类比这种科学方法,可将不同物质进行由此及彼的联系,进而简化思维过程,提高学习效率。
例1 某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出如下的问题,进行探究。请你协助该小组的同学完成下列研究。
【提出问题】
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?③CuO能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、________(填试剂),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80~100℃时,得到黑色固体粉末,继续加热到1 000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,A的化学式为__________。
(3)为解决问题③,设计的实验装置如下图所示(夹持及尾气处理装置未画出):

实验中观察到CuO变为红色物质,无水CuSO4变蓝色。同时生成一种无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是___________________________________________。
(2)根据“实验方案(2)”,得出的+1价Cu和+2价Cu稳定性大小的结论是_________________________________;________________________________。
(3)CuO能被NH3还原。该反应的化学方程式为_________________________________________________________。
【问题讨论】(略)
解析:(1)类比Al(OH)3的实验室制法和两性的检验方法,可以利用CuSO4溶液和适量的NaOH溶液制得Cu(OH)2,把制得的Cu(OH)2分成两份,一份加盐酸,另一份加入NaOH溶液,观察蓝色沉淀是否溶解。(2)98g Cu(OH)2固体受热分解可以得到80g CuO,CuO在高温条件下继续受热分解如果全部生成Cu,应得到64g Cu,但实验中A的质量为72g,且加入硫酸溶液变蓝,说明有Cu2O的存在,Cu2O在酸性条件下发生反应生成Cu2+和Cu,由此证明A应为Cu2O,质量恰好为72g。该实验说明在高于1 000℃时,+1价Cu比+2价Cu稳定;在溶液中+2价Cu比+1价Cu稳定。(3)略。
参考答案:
【实验方案】(1)盐酸、NaOH溶液 (2)Cu2O
【实验结论】(1)Cu(OH)2既能溶于盐酸,又能溶于NaOH溶液
(2)在高于1 000℃时,+1价Cu比+2价Cu稳定;在溶液中+2价Cu比+1价Cu稳定
例2 (2016新课标Ⅱ,28)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是____________________________________________。
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________________________________________________。
(4)丙组同学取10mL 0.1mol·L-1KI溶液,加入6mL 0.1mol·L-1FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);
实验①和③说明:在I-过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是____________________,生成沉淀的原因是______________________(用平衡移动原理解释)。
解析:本题题干部分就已阐明实验意图“探究Fe2+、Fe3+的性质”,显然有将Fe2+、Fe3+的性质进行对比的意味。由于两种离子中铁的价态的不同,它们的氧化性、还原性存在差异。其中(1)(2)(3)(5)主要涉及Fe2+的还原性,其中(2)和(3)则是比较了不同条件下(有氧和无氧)Fe2+的还原性;而(4)则主要是围绕Fe3+的氧化性而进行的实验探究。
参考答案:

2.变量控制思想
控制变量法是化学实验设计类试题中的一种常用思想方法,通过控制变量可以对影响实验结果的多个因素逐一进行探究。当影响实验某项内容的变量有多个(多方面)时,往往先控制某些变量不变化,而只改变某个变量,弄清在其他量不变的情况下,这个变量对实验结果的影响,进而得出相关结论。然后再确定另一个变量,重新进行相关分析。最后综合得出相关结论。该法是化学学习中常用的探究问题和分析解决问题的科学方法之一,可以使研究的问题简单化、条理化、规律化。这一思想在化学学习中将会被逐渐渗透,特别是在实验研究中将成为一种重要的方法。
例3 (2016北京,26)用零价铁(Fe)去除水体中的硝酸盐(NO-3)已成为环境修复研究的热点之一。
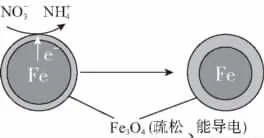
(1)Fe还原水体中NO3-的反应原理如图所示。
①作负极的物质是________。
②正极的电极反应式是___________________________。
(2)将足量铁粉投入水体中,经24小时测定NO-3的去除率和pH,结果如下:
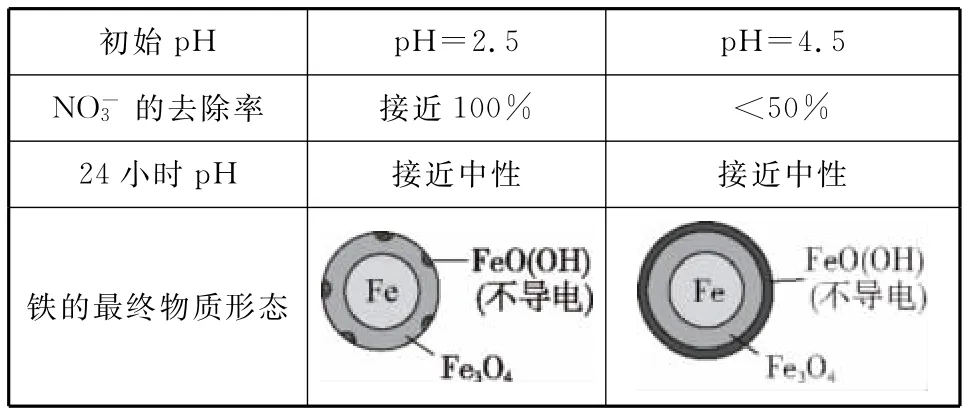
______初始pH pH=2.5 pH=4.5________NO-3的去除率_______接近100%<50%___________24小时pH 接近中性接近中性铁的最终物质形态
pH=4.5时,NO3-的去除率低。其原因是__________。
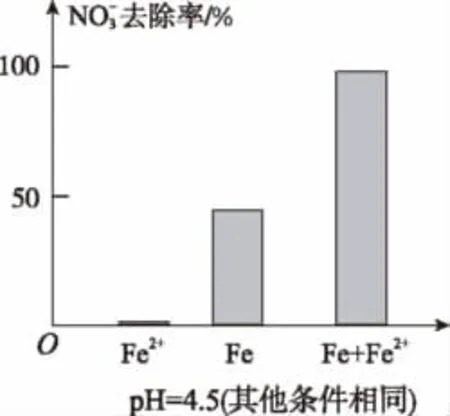
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_____。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:________。
(4)其他条件与(2)相同,经1小时测定NO-3的去除率和pH,结果如下:

____初始pH pH=2.5 pH=4.5____NO-3_的去除率______约10%约接近中性________接近中性3%_____1小时pH
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:__________________。
解析:(1)略。(2)通过控制变量(pH),测得相同时间后NO-3的去除率的高低,分析相关原因。显然,pH较高时,Fe3+较易水解生成FeO(OH)(据题中图示),阻碍电子转移,所以NO-3的去除率低。(3)①从图中可以看出,在pH=4.5(其他条件相同)时,只加入铁粉或只加入Fe2+,都不及同时加入铁粉和Fe2+对NO-3的去除率高,说明不符合假设Ⅰ,而是由于Fe2+破坏FeO(OH)生成了四氧化三铁。这是典型的变量控制思想的体现和应用,也用了对比的方法。②据题意,利用有关守恒原理并结合酸性条件,可写出有关离子方程式为2H+;加入Fe2+之所以可以提高NO-3的去除率,是因为减少了FeO(OH)的生成,产生更多的Fe3O4,增强了导电性。另外生成了H+,可以减慢pH增大的速度,使NO-3的去除率增大。
(4)此问可看作综合了(2)(3)两问,主要运用了比较的思想方法。
参考答案:
(2)Fe3+较易水解生成FeO(OH),FeO(OH)不导电,阻碍电子转移
(3)①本实验条件下,Fe2+不能直接还原NO-3;在Fe和Fe2+共同作用下能提高NO-3的去除率②Fe2++,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移
(4)由于pH越高,Fe3+越容易水解生成FeO(OH),FeO(OH)又不导电,所以NO-3的去除率越低;初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足
3.绿色化学思想
化学新课程中的实验,理应体现绿色化学思想,遵循绿色化设计原则,即原料的绿色化、化学反应的绿色化、产品的绿色化。在原料、反应(包括催化剂、溶剂)和产品的绿色化中,化学反应的“原子经济性”至关重要,化学反应应最大限度地利用原料分子中的每一个原子,使它们都结合到目标分子(产物)中去,从而达到零排放(即没有副反应、不生成副产物、不产生废弃物)。当实验过程中产生有毒、有害物质或污染物时,要学会运用化学知识和方法去防治污染,增强学生对自然和社会的责任感,使学生将来在面临与化学有关的社会问题时,能做出更明智、更科学的决策。
例4 (2016新课标Ⅰ,26节选)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。

甲
回答下列问题:
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图乙装置进行实验。

乙
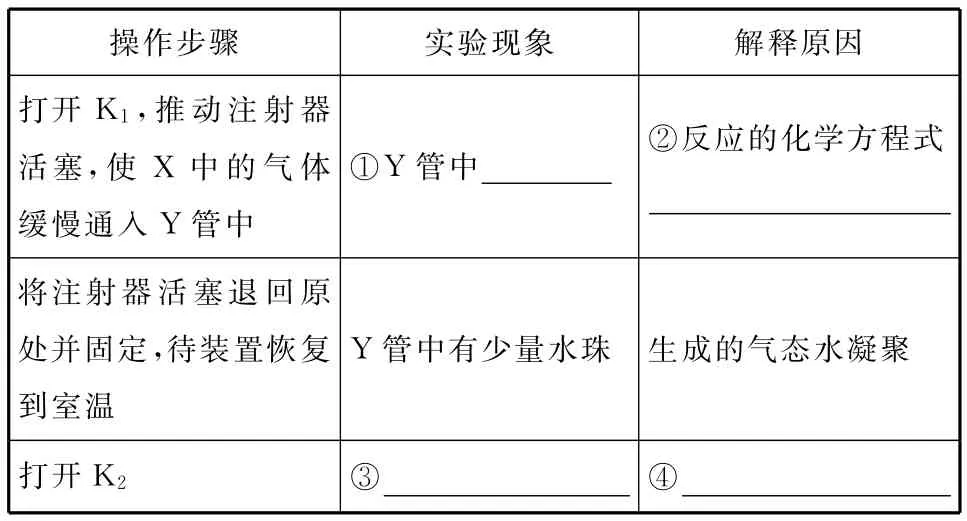
______操作步骤____________实验现象解释原因打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中①Y 管中________②反应的化学方程式将注射器活塞退回原处并固定,待装置恢复到室温Y管中有少量水珠生成的气态水凝聚打开K2______________________③_______________④__________________
解析:题干部分即阐明“氮的氧化物(NOx)是大气污染物之一”,围绕氮的氧化物的处理方法展开实验探究,其中F装置不仅可以防止NH3的逸出而导致产生的污染而且可防止倒吸。图乙的Z装置,其中的NaOH溶液可吸收NO2,防止其污染空气。
参考答案:
(2)①红棕色气体慢慢变浅
③Z中NaOH溶液产生倒吸现象
④反应后气体分子数减小,Y管中压强小于外界压强
传统的化学教学往往只关注知识教学,忽视科学方法和科学观念(思想)的教学,或者顾此失彼,处理不好三者的关系。化学实验作为中学化学教学中的重要内容,既要通过实验探究活动,掌握基本的化学实验技能和方法,进一步体验实验探究的基本过程,认识实验在化学科学研究和化学学习中的重要作用,提高化学实验能力;又要在教学中让学生不断体验并尝试运用诸如“比较、分类(类比)”“变量控制”“绿色化学”等学科思想方法。进而逐渐形成学生的“实验探究”“分类表征”“模型认知”“绿色应用”等化学核心素养。
(作者单位:江苏省溧水高级中学)

