经导管动脉化疗栓塞治疗与联合索拉非尼治疗肝细胞癌合并门静脉癌栓的疗效观察
王 建,陈卫东,刘兴洲,吴永丰
·肿瘤与转化·
经导管动脉化疗栓塞治疗与联合索拉非尼治疗肝细胞癌合并门静脉癌栓的疗效观察
王 建,陈卫东,刘兴洲,吴永丰
目的 观察经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)治疗与联合索拉非尼治疗肝细胞癌合并门静脉癌栓的疗效。方法 回顾性分析2010年7月—2013年11月东南大学附属中大医院江北院区收治的肝细胞癌合并门静脉癌栓患者107例,符合入组条件的40例中,21例接受TACE联合索拉非尼治疗(联合治疗组),19例接受单纯TACE治疗(TACE组),观察患者生存时间及严重并发症发生率。结果 联合治疗组和TACE组的中位生存时间分别为8.4个月和5.7个月(P<0.001),疾病无进展生存期分别为7.3个月和4.3个月(P=0.002),2组严重并发症发生率分别为19.1%和15.8%(P=0.559)。结论TACE联合索拉非尼较单纯TACE治疗肝细胞癌合并门静脉癌栓未增加严重并发症发生率,并可有效延长患者生存时间。
肝细胞癌;门静脉癌栓;经导管动脉化疗栓塞;索拉非尼
肝癌是世界上最常见的恶性肿瘤之一,发病率居第5位,病死率居第3位[1],其中以肝细胞癌(hepatocellular carcinoma,HCC)多见。门静脉癌栓(portal vein tumor thrombosis,PVTT)形成是晚期肝癌的主要标志,发生率高达39.6%~62.8%[2-3],若不及时有效治疗,患者中位生存时间(median survival time,MST)仅为2.7~4.0个月[4-5]。索拉非尼是目前唯一经多中心随机对照研究证实可以延长此类患者生存期的靶向治疗药物[6-7];而在临床实际中,经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)是失去外科切除机会的晚期肝癌患者最常见的治疗选择。TACE联合索拉非尼治疗晚期肝癌的相关文献报道较多,而针对合并PVTT的HCC疗效鲜见报道。本研究回顾性分析TACE治疗与联合索拉非尼治疗HCC合并PVTT的疗效。
1 资料与方法
1.1 资料
1.1.1 临床资料 回顾性分析2010年7月—2013年11月东南大学附属中大医院江北院区收治的HCC合并PVTT患者107例。
1.1.2 入组标准
1.1.2.1 纳入标准 ①18~80周岁;②影像学、实验室检查、组织/细胞学活检证实的HCC合并PVTT;③Child-Pugh评分A或B;④东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分0~3分;⑤未接受过其他针对HCC合并PVTT的治疗。
1.1.2.2 排除标准 ①曾经接受或同时伴随有其他针对HCC合并PVTT的治疗方式;②肝功能Child-Pugh评分C;③ECOG评分4分;④服用索拉非尼时间不足3个月或因严重不良反应中断治疗者;⑤服用索拉非尼期间同时接受其他化疗药物或中医药治疗的患者。
按照入组标准,HCC合并PVTT患者40例作为研究对象,其中TACE联合索拉非尼治疗21例(联合治疗组)、单纯TACE治疗19例(TACE组)。2组一般资料年龄、性别、PVTT分型、远处转移、肝动脉-门静脉瘘、ECOG评分、Child-Pugh评分及甲胎蛋白水平差异均无统计学意义(P>0.05,表1)。
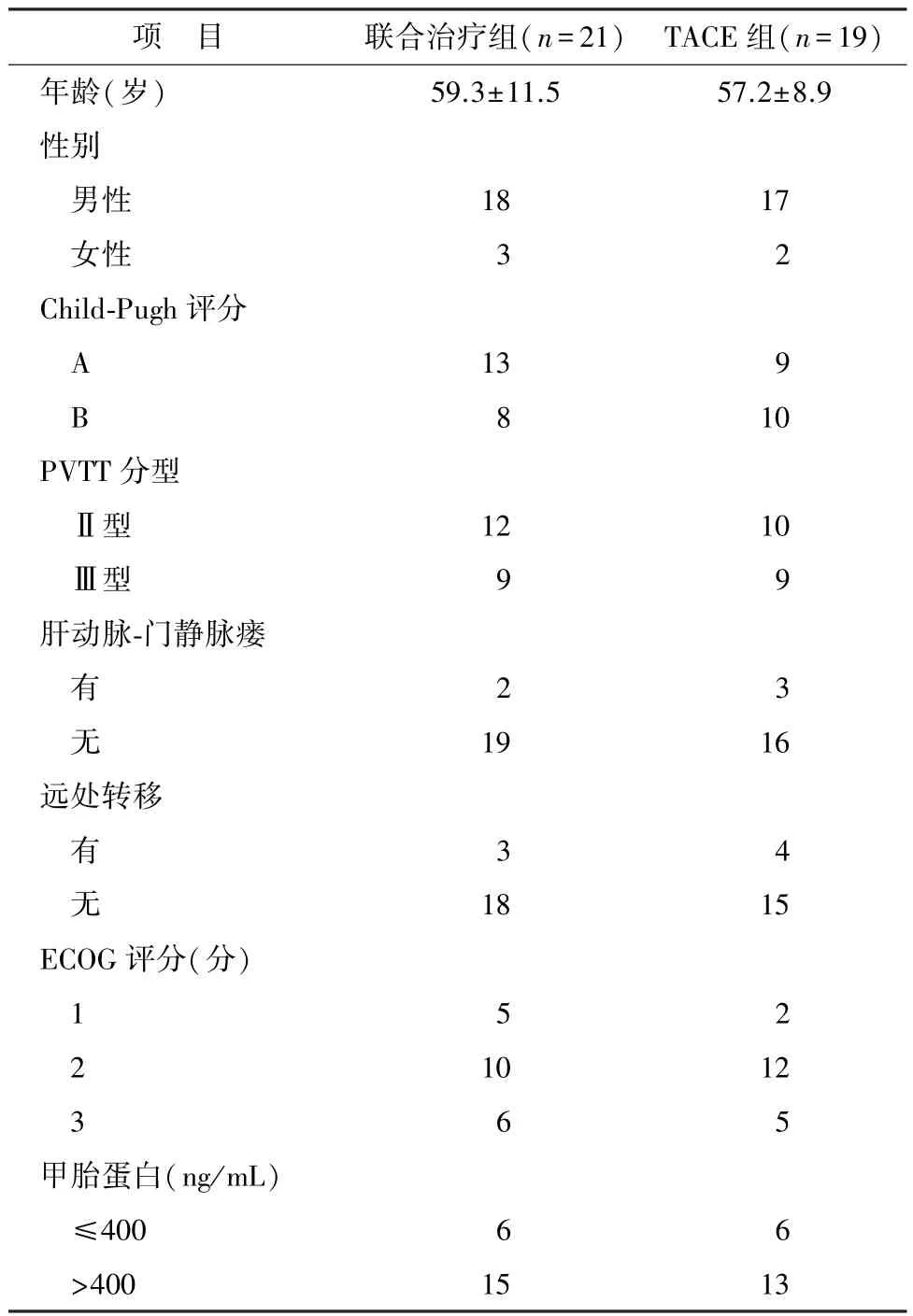
表1 2组基线特征
1.2 方法
1.2.1 TACE TACE采用Seldinger穿刺法经皮行股动脉穿刺,将美国Cook公司的5F肝动脉导管置入肿瘤供血动脉,必要时采用美国Cook公司的3F微导管进行超选择。通常使用超液化碘油(4~20 mL)以及2~3种化疗药物(如铂类、吡柔比星、羟喜树碱等)的混悬液进行化疗栓塞。化疗药物、碘油剂量根据患者肝功能情况、肿瘤大小、肿瘤血供情况以及是否合并肝动脉-门静脉瘘决定。后续TACE治疗方案依据影像学随访,如发现有残留病灶或新发病灶,在患者肝功能和一般状况允许下行再次TACE治疗。
1.2.2 索拉非尼 索拉非尼(德国拜耳药业,甲苯磺酸索拉非尼片,每片200 mg)的初始剂量为每次400 mg、2/d,首次服用时间为TACE术后1周左右;患者若再次接受TACE治疗,则在手术前1天停服索拉非尼。服用索拉非尼过程中,若患者出现Ⅲ级及Ⅲ级以上不良反应时,则将药物剂量减半(400 mg/d);当患者不良反应缓解后逐渐恢复到既定剂量。若患者出现无法耐受的药物不良反应或本人拒绝继续服用,则中断服药。
1.2.3 随访 术后第3天、第1周复查肝肾功能、血常规、凝血功能。每2个月复查CT或MRI平扫+增强评价肝内肿瘤及PVTT大小、范围变化情况;彩色多普勒超声评估门静脉通畅情况。
1.2.4 疗效及不良反应评价标准 ①疗效评价,依据实体肿瘤疗效评价标准修订版[8],分为完全缓解(complete response,CR):肿瘤病灶动脉期增强显影均消失;部分缓解(partial response,PR):肿瘤病灶(动脉期增强显影)的直径总和缩小≥30%;疾病稳定(stable disease,SD):肿瘤病灶(动脉期增强显影)减小范围<30%或增大范围<20%;进展(progression disease,PD):肿瘤病灶(动脉期增强显影)的直径总和增大范围≥20%或者出现新发病灶。疾病控制率(disease control rate,DCR)=[(CR+PR+SD)/总数]× 100%。②患者总生存时间(overall survival,OS),患者首次接受TACE+索拉非尼或TACE治疗之日起到患者死亡时间或最后1次随访时间;无进展生存时间(progress free survival,PFS),患者首次接受TACE+索拉非尼或TACE治疗之日起到观察到疾病进展或者发生因为任何原因的死亡的时间。③患者在治疗中出现的相关不良反应的评估和分级参照通用不良事件术语标准4.0版,1~2级为轻微并发症,3~4级为严重并发症。
1.3 统计学处理 应用SPSS 19.0软件,计量资料采用独立样本t检验,计数资料采用χ2检验,对于计数<5的变量采用Fisher的精确检验;采用Kaplan-Meier生存曲线分析患者的MST以及PFS。P<0.05为差异有统计学意义。
2 结果
2.1 疗效 肝内肿瘤病灶,联合治疗组CR 1例、PR 7例、SD 6例、PD 7例,DCR为66.7%;TACE组CR 0例、PR 4例、SD 5例、PD 10例,DCR为47.4%;2组DCR差异无统计学意义(P=0.218)。PVTT,联合治疗组CR 2例、PR 3例、SD 9例、PD 7例,DCR为66.7%;TACE组CR 0例、PR 2例、SD 4例、PD 13例,DCR为31.58%;2组DCR差异有统计学意义(P=0.028)。
2.2 OS 截止到随访终点,仅联合治疗组尚有1例存活,其余入组病例均观察到死亡事件发生。联合治疗组PFS 7.3个月,TACE组PFS 4.3个月,2组差异有统计学意义(P=0.002,图1)。联合治疗组MST 8.4个月,TACE组MST 5.7个月,2组差异有统计学意义(P<0.001,图2)。

图1 2组无进展生存曲线
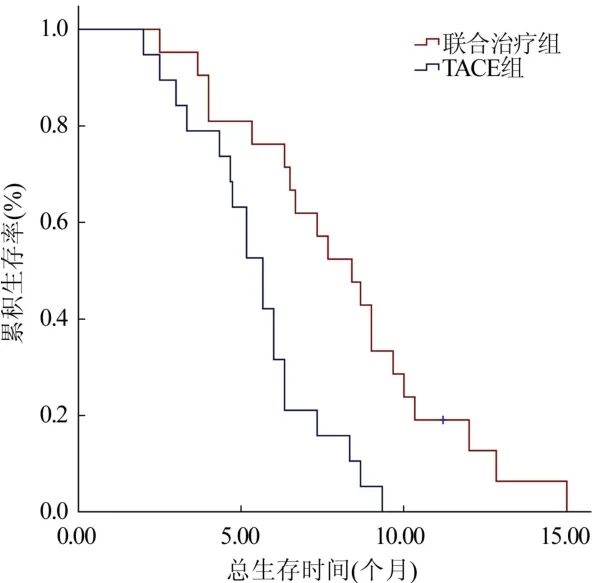
图2 2组总生存曲线
2.3 并发症 联合治疗组术后18例(85.7%)发生31例次1~2级并发症,TACE组术后15例(78.9%)发生16例次1~2级并发症,所有1~2级并发症均经保守或对症处理后缓解。联合治疗组术后4例(19.1%)发生4例次3~4级并发症,TACE组术后3例(15.8%)发生3例次3~4级并发症,2组3~4级并发症发生率差异无统计学意义(P=0.559,表2)。
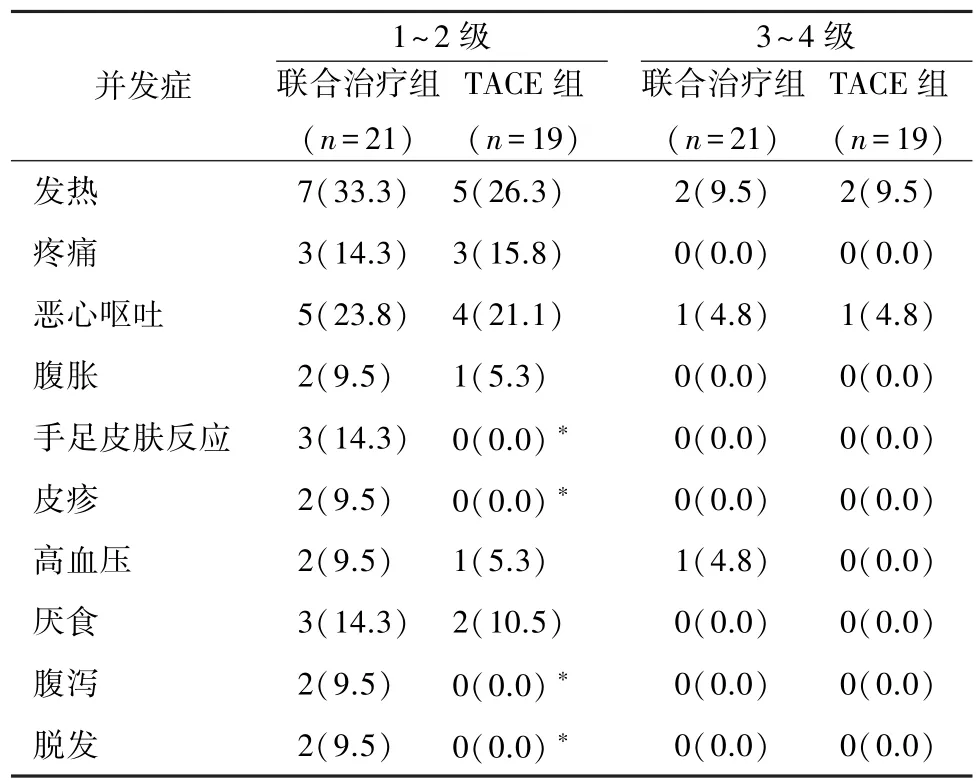
表2 患者并发症发生情况[n(%)]
3 讨论
我国是肝癌高发国家,每年肝癌新发病例人数占全球一半左右。由于肝癌本身起病隐匿、症状不典型,加上我国目前肝癌早期筛查尚未普及和规范,多数患者就诊时已达晚期,而HCC又常合并有PVTT[5]。PVTT可阻断或减少肝脏血供,加重肝损伤,且易导致肝内转移。门静脉高压可能引起一系列严重并发症,如消化道出血、肝性脑病等,因此此类患者预后极差[4]。
既往认为HCC合并PVTT是TACE的禁忌证,而最近的研究表明,有足够侧支循环的病例,经过TACE治疗后并没有导致急性肝功能衰竭等并发症发生率的增加;与此同时,TACE治疗带来的生存获益明显优于保守治疗组,因此TACE对这些患者依然是安全有效的[9-12]。TACE术后可能会诱导血管内皮生长因子水平的高表达,被认为是影响HCC患者TACE术后预后的主要因素[13]。根据巴塞罗那肝癌分期指南的推荐,目前HCC合并PVTT唯一的姑息性治疗药物为索拉非尼。索拉非尼是一种多激酶抑制剂,既可以通过抑制有丝分裂原活化蛋白激酶信号传导通路直接抑制肿瘤细胞生长,也可通过抑制血管内皮生长因子和血小板衍生生长因子而阻断肿瘤新生血管的形成,从而间接抑制肿瘤生长[14]。多项临床研究显示,索拉非尼可延长HCC合并PVTT患者OS[6,15-17]。有文献报道,通过TACE阻断肿瘤血供,造成肿瘤细胞坏死,同时应用索拉非尼抑制肿瘤新生血管形成,理论上可取得更好的疗效[18]。
Abdel-Rahman和Elsayed[19]对11篇TACE联合索拉非尼治疗不可切除晚期HCC的系统综述表明,TACE与索拉非尼的联合治疗较单一TACE或索拉非尼疗效更显著。
Zhu等[20]报道TACE联合索拉非尼后MST和PFS分别为11.0个月和6.0个月。本研究中,联合治疗组MST和PFS分别为8.4个月和5.7个月,可能与本研究中患者基线肝功能及生存状态较差有关。值得注意的是,本研究肝内病灶,2组在DCR方面差异并无统计学意义(P>0.05);但联合治疗组对于PVTT的控制则显示出明显优势,可能与联用索拉非尼后延缓了癌栓进展有关。服用索拉非尼可以引起一系列药物相关并发症,如与TACE联用,可能增加患者并发症发生。本研究中,联合治疗组和TACE组绝大多数并发症均为1~2级,尽管联合治疗组可能增加1~2级并发症的发生,但这些并发症均在保守或对症治疗后得到有效控制;而2组3~4级并发症发生率差异无统计学意义(P>0.05)。由此可见,TACE联合索拉非尼治疗HCC合并PVTT也是相对安全的。
TACE联合索拉非尼对于HCC合并PVTT患者不失为一种安全且有效的治疗方法。本研究的不足之处在于回顾性分析、样本量较小、无法进行影响预后因素的分析等。更确切的循证医学证据需要大样本的、前瞻性、随机、对照研究进一步证实。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]Fong Y,Sun RL,Jarnagin W,et al.An analysis of 412 cases of hepatocellular carcinoma at a Western center[J]. Ann Surg,1999,229(6):790-800.
[3]Ikai I,Arii S,Okazaki M,et al.Report of the 17th nationwide follow-up survey of primary liver cancer in Japan[J]. Hepatol Res,2007,37(9):676-691.
[4]Han K,Kim JH,Ko GY,et al.Treatment of hepatocellular carcinoma with portal venous tumor thrombosis:a comprehensive review[J].World J Gastroenterol,2016,22(1): 407-416.
[5]Chan SL,Chong CC,Chan AW,et al.Management of hepatocellular carcinoma with portal vein tumor thrombosis:review and update at 2016[J].World J Gastroenterol,2016,22(32):7289-7300.
[6]Llovet JM,Ricci S,Mazzaferro V,et al.Sorafenib in advanced hepatocellular carcinoma[J].N Engl J Med,2008,359(4):378-390.
[7]Cheng AL,Kang YK,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phaseⅢrandomised,double-blind,placebo-controlled trial[J].Lancet Oncol,2009,10(1):25-34.
[8]Lencioni R,Llovet JM.Modified RECIST(mRECIST)assessment for hepatocellular carcinoma[J].Semin Liver Dis,2010,30(1):52-60.
[9]Zhao Y,Cai G,Zhou L,et al.Transarterial chemoembolization in hepatocellular carcinoma with vascular invasion or extrahepatic metastasis:a systematic review[J].Asia Pac J Clin Oncol,2013,9(4):357-364.
[10]Xue TC,Xie XY,Zhang L,et al.Transarterial chemoembolization for hepatocellular carcinoma with portal vein tumor thrombus:a meta-analysis[J].BMC Gastroenterol,2013,13:60.
[11]Zhao Y,Duran R,Chapiro J,et al.Transarterial chemoembolization for the treatment of advanced-stage hepatocellular carcinoma[J].J Gastrointest Surg,2016,20(12):2002-2009.
[12]Leng JJ,Xu YZ,Dong JH.Efficacy of transarterial chemoembolization for hepatocellular carcinoma with portal vein thrombosis:a meta-analysis[J].ANZ J Surg,2016,86(10): 816-820.
[13]Li Z,Xue TQ,Chen XY.Predictive values of serum VEGF and CRP levels combined with contrast enhanced MRI in hepatocellular carcinoma patients after TACE[J].Am J Cancer Res,2016,6(10):2375-2385.
[14]Cabrera R,Pannu DS,Caridi J,et al.The combination of sorafenib with transarterial chemoembolisation for hepatocellular carcinoma[J].Aliment Pharmacol Ther,2011,34 (2):205-213.
[15]Bruix J,Raoul JL,Sherman M,et al.Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma:subanalyses of a phaseⅢtrial[J].J Hepatol,2012,57 (4):821-829.
[16]Yu SJ,Kim YJ.Effective treatment strategies other than sorafenib for the patients with advanced hepatocellular carcinoma invading portal vein[J].World J Hepatol,2015,7 (11):1553-1561.
[17]Abdel-Rahman O,Lamarca A.Development of sorafenibrelated side effects in patients diagnosed with advanced hepatocellular carcinoma treated with sorafenib:a systematicreview and meta-analysis of the impact on survival[J].Expert Rev Gastroenterol Hepatol,2017,11(1):75-83.
[18]Dufour JF,Johnson P.Liver cancer:from molecular pathogenesis to new therapies:summary of the EASL single topic conference[J].J Hepatol,2010,52(2):296-304.
[19]Abdel-Rahman O,Elsayed ZA.Combination trans arterial chemoembolization(TACE)plus sorafenib for the management of unresectable hepatocellular carcinoma:a systematic review of the literature[J].Dig Dis Sci,2013,58 (12):3389-3396.
[20]Zhu K,Chen J,Lai L,et al.Hepatocellular carcinoma with portal vein tumor thrombus:treatment with transarterial chemoembolization combined with sorafenib--a retrospective controlled study[J].Radiology,2014,272(1):284-293.
Transcatheter arterial chemoembolization combined with sorafenib in the treatment of hepatocellular carcinoma with portal vein tumor thrombus
WANG Jian,CHEN Weidong,LIU Xingzhou,WU Yongfeng
(Department of General Surgery,Jiangbei Hospital of Zhongda Hospital,Southeast University,Nanjing Jiangsu 210009,China)
Objective To compare the treatment effect of transcatheter arterial chemoembolization(TACE)combined with sorafenib and TACE alone in the treatment of hepatocellular carcinoma(HCC)accompanied by portal vein tumor thrombosis(PVTT).Methods From July 2010 to November 2013,21 patients with HCC accompanied by PVTT
TACE plus sorafenib(combined therapy group)and 19 patients received TACE alone(TACE group).The primary endpoint of this study was the overall survival while the second endpoint was the incidence of severe complications.Results The median overall survival in combined therapy group and TACE group were 8.4 and 5.7 months(P<0.001)and the median progression free survival were 7.3 and 4.3 months(P=0.002)respectively.The incidence of severe complications was 19.1%in combined therapy group and 15.8%in TACE group(P=0.559).Conclusion For patients of HCC with PVTT,the treatment strategy of TACE plus sorafenib may provide a better survival than TACE alone,without increasing the incidence of severe complications.
Hepatocellular carcinoma(HCC);Portal vein tumor thrombosis(PVTT);Transcatheter arterial chemoembolization(TACE);Sorafenib
R735.7
]B
2095-3097(2017)03-0160-04
10.3969/j.issn.2095-3097.2017.03.008
2017-01-22 本文编辑:张在文)
210009江苏南京,东南大学附属中大医院江北院区普外科(王 建,陈卫东,刘兴洲,吴永丰)

