脐带间充质干细胞治疗儿童移植相关并发症的疗效观察
唐飞龙,栾 佐,吴南海,唐湘凤,卢 伟,井远方
·干细胞·
脐带间充质干细胞治疗儿童移植相关并发症的疗效观察
唐飞龙,栾 佐,吴南海,唐湘凤,卢 伟,井远方
目的 探讨脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)治疗异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)后儿童急性移植物抗宿主病(acute graft versus host disease,aGVHD)和出血性膀胱炎(hemorrhagic cystitis,HC)的疗效及安全性。方法 Allo-HSCT后发生aGVHD 15例(合并HC 5例),难治性aGVHD的13例(合并HC 5例)对一线免疫抑制剂及CD25单抗治疗无效,联合静脉滴注UCMSCs治疗。UCMSCs的平均使用剂量为3.6(1.3~6.0)×106/kg,平均使用次数为5(2~21)次,中位随访时间47(36~73)个月。然后观察aGVHD和HC的恢复、再发情况及UCMSCs治疗相关不良反应。结果 13例联合UCMSCs治疗后8例获得完全缓解、5例获得部分缓解;5例HC患儿经水化、碱化治疗后效果欠佳,联合静脉滴注UCMSCs治疗后有效。未观察到UCMSCs治疗相关不良反应。结论 Allo-HSCT后联合UCMSCs治疗儿童aGVHD和HC安全有效。
脐带间充质干细胞;急性移植物抗宿主病;出血性膀胱炎;造血干细胞移植
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)已成为恶性、难治性血液系统疾病及遗传代谢病有效的治疗方法之一。但移植相关并发症,尤其是急性移植物抗宿主病(acute graft versus host disease,aGVHD)和出血性膀胱炎(hemorrhagic cystitis,HC)仍然是影响移植成功率及患者长期生存率的主要因素。现阶段针对aGVHD的常规治疗包括糖皮质激素及免疫抑制剂疗效有限,仅对部分患者有效。HC缺乏针对性的预防和治疗措施,主要以水化、碱化、利尿、膀胱冲洗及药物灌注为主,难治性HC可借助外科干预[1],但疗效均不甚理想。脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)因具有低免疫原性、免疫调节及组织修复作用[2],在aGVHD和HC治疗上取得了令人振奋的疗效,为aGVHD和HC的治疗提供了一种新的有效方法。海军总医院儿科于2010年4月—2013年5月15例行allo-HSCT后发生难治性aGVHD 13例(合并HC 5例),在常规治疗的基础上联合运用UCMSCs静脉滴注,取得较好疗效。
1 资料与方法
1.1 病例资料 2010年4月—2013年5月在海军总医院行allo-HSCT的血液病及遗传代谢病患儿15例,男性9例、女性6例;其中,急性淋巴细胞性白血病(acute lymphoblastic leukemia,ALL)2例,急性髓系白血病(acute myelocytic leukemia,AML)5例,骨髓增生异常综合征(myelodysplastic syndrome,MDS) 3例,再生障碍性贫血(aplastic anemia,AA)3例,幼年型粒单核细胞(juvenile myelomonocytic leukemia,JMML)1例,肾上腺脑白质营养不良(adrenoleukodystrophy,ALD)1例。15例一般情况见表1。
1.2 方法
1.2.1 骨髓移植 15例中,血缘造血干细胞移植(hematopoietic stem cell transplantation,HSCT)13例;非血缘脐血移植(umbilical cord blood transplantation,UCBT)2例,其中病例12为单份UCBT、病例15为双份UCBT。人类白细胞抗原(human leukocyte antigen,HLA)配型不全相合者11例,除2例行UCBT外,余9例为血缘骨髓造血干细胞+外周血干细胞移植(peripheral blood stem cell transplantation,PBSCT);HLA配型全相合者4例,病例2行血缘骨髓造血干细胞+PBSCT,余3例为血缘PBSCT移植。骨髓造血干细胞/PBSCT单个核细胞中位数为19.04(5.20~30.00)×108/kg,CD34+细胞的中位数为5.14(2.69~14.46)×106/kg。UCBT单个核细胞中位数为2.74 (1.16~4.32)×108/kg,CD34+细胞的中位数为1.82 (0.87~2.76)×106/kg。见表1。
1.2.2 预处理方案 15例中,13例采用清髓性预处理,其中11例选用白消安/环磷酰胺(busulfan/ cytoxan,BU/CTX)为基础的预处理方案、2例ALL采用CTX/全身照射(total body irradiation,TBI)为基础的预处理方案;余2例采用非清髓预处理,其中1例采用氟达拉滨(fludarabine/cytoxan,FLU)/CTX预处理方案、1例选用抗胸腺球蛋白(antithymocytic globulin/cytoxan,ATG)/CTX为主的预处理方案。15例具体预处理方案见表1。
1.2.3 并发症及其预防
1.2.3.1 aGVHD 除3例HLA全相合白血病移植患儿选用环孢素A(cyclosporine A,CsA)+短程甲氨蝶呤(methotrexate,MTX)方案预防aGVHD、2例UCBT患儿采用CsA+麦考酚酯(mycophenolate mofetil,MMF)+甲泼尼龙(methylprednisolone,MP)外,余10例均采用CsA+短程MTX+MMF方案预防。CsA 1.5~4 mg/(kg· d),24 h静脉滴注,CsA血质量浓度维持在200~400 ng/mL,肠道恢复正常改为口服。MTX 15 mg/m2、10 mg/m2、10 mg/m2、10 mg/m2分别于移植后+1、+3、+5、+11 d应用。MMF 25 mg/(kg·d),分2次口服,移植后+1~+30 d。按照aGVHD诊断标准[3],15例在行allo-HSCT后均发生aGVHD,发生程度不等的皮肤型aGVHD 15例中,合并10例胃肠道型aGVHD、5例肝脏型aGVHD;aGVHD出现的平均时间为40(+19~+65)d;接受激素联合免疫抑制剂MP 1~2 mg/(kg· d)、他克莫司(tacrolimus,TM)0.03~0.05 mg/(kg· d)及CD25单抗1 mg/(kg·d)治疗后,患儿病情继续进展的加用UCMSCs治疗。见表1。
1.2.3.2 HC 所有移植患儿均给予充分水化、碱化等措施预防HC,预处理期间使用CTX患儿则在静脉滴注的同时和静脉滴注后3、6、9 h给予美司钠解救,总剂量为CTX的200%。15例发生aGVHD患儿合并Ⅲ~Ⅳ度HC 5例,出现的中位时间为27(-2~+43)d,经水化、碱化尿液2周症状不缓解或加重后给予UCMSCs治疗(表1)。
1.2.4 UCMSCs制备、输注及疗效判断
1.2.4.1 UCMSCs制备 UCMSCs由海军总医院儿科实验室(符合生物治疗要求的良好作业规范标准)制备,已通过相关伦理委员会批准,且获脐带捐献者家属同意,患儿治疗前其家属均签署UCMSCs治疗同意书。制备具体步骤:①用75%乙醇浸泡足月健康产新生儿脐带组织30 s,无菌磷酸盐缓冲溶液冲洗后将脐带组织剪切至约1 cm×1 cm×1 cm大小并移至离心管中,经0.2%Ⅱ型胶原酶(美国Sigma公司)37℃消化13~15 h;②再用含10%胎牛血清的达伯克改良伊格尔培养基(美国Gibco公司)洗涤细胞,1 600 r/min离心(离心半径13.5 cm)5 min后加入适量生长培养基重悬细胞,按2.0×104/cm2接种于培养瓶,置于含5%CO2的细胞培养箱(MCO-20AIC,日本SANYO公司)中培养;③待细胞贴壁生长至80%汇合后,以0.25%胰蛋白酶-0.02%乙二胺四乙酸消化液(美国Gibco公司)消化,进行传代培养,收集3代细胞;④利用流式细胞仪(FACSCalibur,美国Becton-Dickimson公司)鉴定显示UCMSCs高表达CD13、CD29、CD44、CD90、CD105,低表达CD34、CD45和HLA-DR;⑤第3代经鉴定的UCMSCs用于临床研究,且使用前需行细胞培养液污染、胎牛血清残留量、内毒素、支原体等相关检测及细胞活性鉴定。1.2.4.2 UCMSCs使用 参考文献[4-5],静脉滴注UCMSCs平均细胞数为3.6(1.3~6.0)×106/kg,平均次数为5(2~21)次,每周1次;使用前给予异丙嗪预防过敏,静脉滴注时间>1 h,使用后1周内观察疗效、不良反应及血常规、生化检验结果。
1.2.5 疗效评估与观察
1.2.5.1 aGVHD疗效评估 完全缓解(complete remission,CR):aGVHD症状完全消失(包括皮疹消退,胆红素正常,无aGVHD所致腹泻发生);部分缓解(partial remission,PR):至少1个脏器减少至少1个级别;进展:脏器均无改善,甚至进展[6]。
1.2.5.2 HC疗效观察 每日检查尿常规,记录体温、症状、体征、尿色、尿量以及尿路刺激症状、肉眼血尿、镜下血尿消失时间。
随访时间到2016年5月。
2 结果
2.1 aGVHD 15例allo-HSCT发生aGVHD患儿在一线免疫抑制剂及CD25单抗治疗的基础上,病例5、6 aGVHD患儿达CR;13例难治性aGVHD患儿症状均无明显改善,予以次数不等的UCMSCs静脉滴注治疗,其中8例CR、5例达PR,总有效率(CR+PR)为100%。其中13例皮肤型aGVHD患儿在UCMSCs静脉滴注后均达到CR,改善中位时间为静脉滴注后22(8~32)d;5例肝脏型aGVHD患儿中,病例4、8经UCMSCs治疗后PR,余3例达CR,缓解中位时间为静脉滴注后3(12~46)d;10例胃肠道型aGVHD患儿中,病例1、11、14(均为重度aGVHD)经UCMSCs治疗后达PR,余7例达CR,缓解中位时间为静脉滴注后39(11~59)d。见表2。
2.2 HC 5例HC患儿在静脉滴注次数不等UCMSCs后均达不同程度缓解(表2)。UCMSCs使用平均次数为4(3~7)次,尿路刺激症状消失中位时间为治疗后15(8~30)d,肉眼血尿消失中位时间为治疗后28(12~49)d,镜下血尿消失中位时间为治疗后36 (15~54)d。
2.3 随访 截至2016年5月,随访中位时间47 (36~73)个月,3例死亡;其中,病例1移植后+102 d死于严重肺部真菌感染,病例8移植后约10个月死于慢性移植物抗宿主病合并肺部感染,病例11于移植后5个月死于巨细胞病毒间质性肺炎。病例14失访;余11例均存活,随访期内存活患儿未出现aGVHD及HC复发,且均未出现UCMSCs治疗相关不良反应(表2)。
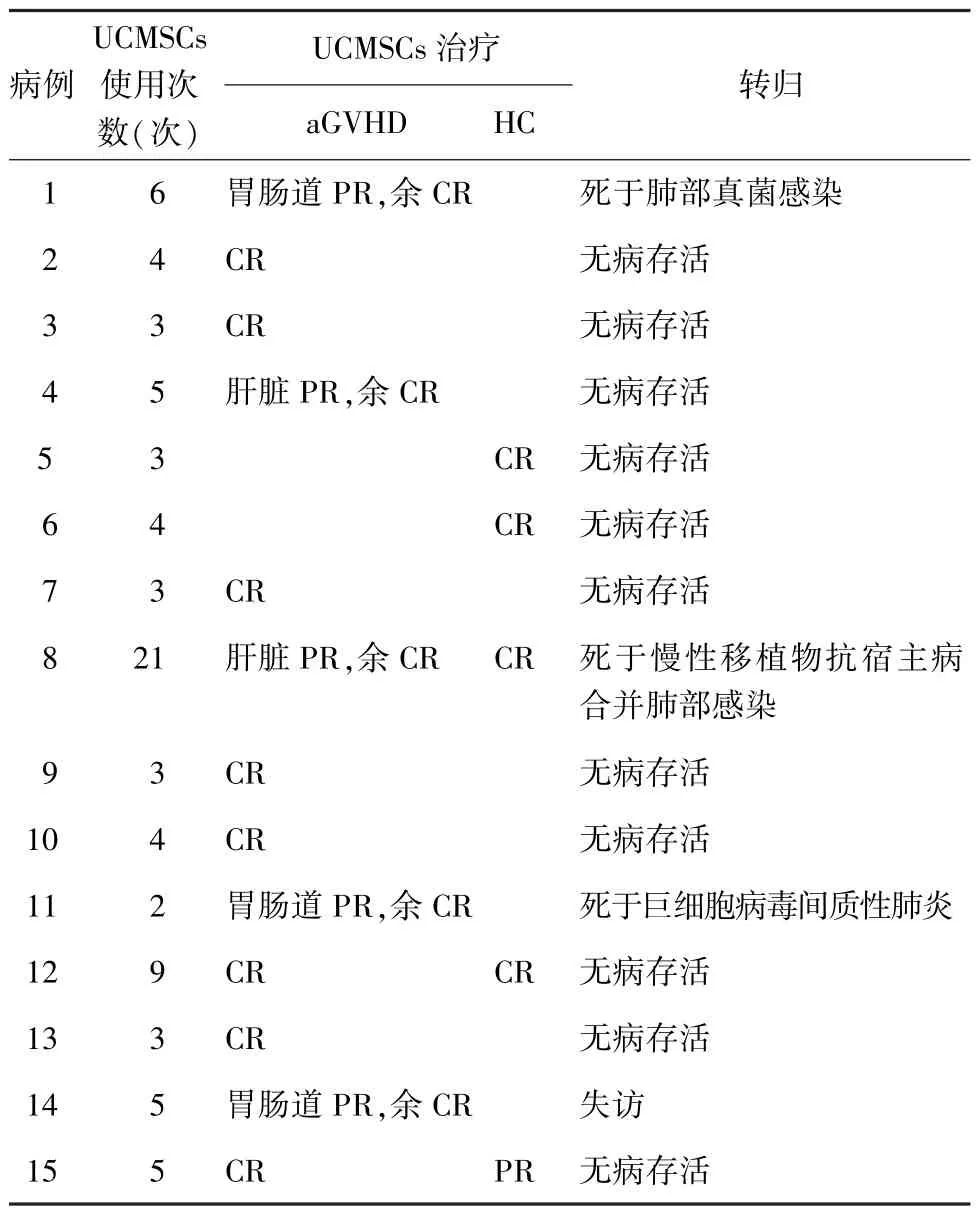
表2 15例治疗情况及转归
3 讨论
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我更新和多向分化潜能的成体干细胞,可来源于骨髓、脂肪、脐带等不同组织,且在不同培养条件下可向肌腱、神经、脂肪、肌肉、骨骼、软骨细胞等组织细胞分化,具有低免疫原性、支持造血、免疫调控、促进植入和组织修复等特点。本研究使用的UCMSCs与脂肪、骨髓来源的MSCs相比,具有增殖能力更强、免疫原性更低、取材方便、无伦理限制等特点,是MSCs临床应用更为理想的种子细胞。Bartholomew等[7]早期进行狒狒同种异体皮肤移植后就发现MSCs输注可显著推迟皮肤排异时间。此外,体外实验也显示,当组织器官有炎症或者损伤时,MSCs会迅速归巢到炎症或损伤部位发挥免疫调节及组织修复作用[8]。目前MSCs已成功应用于allo-HSCT后严重并发症如aGVHD、HC的治疗。
MSCs治疗aGVHD的具体作用机制尚未完全阐明,一般认为MSCs对T淋巴细胞激活和增殖具有非选择性和剂量依赖性抑制作用,这一抑制作用得益于MSCs分泌的可溶性细胞因子,如前列腺素E2、转化生长因子-β、吲哚胺2,3-双加氧酶、肝细胞生长因子等[9]。MSCs还可以通过诱导CD25+调节性T细胞的产生来发挥免疫调节作用,CD25+调节性T细胞被证实可诱导免疫耐受及抑制炎症反应[10-11]。此外,MSCs可减少辅助性T细胞1(helper T cell 1,Th1)、Th17炎症因子的释放,增加抗炎作用的Th2细胞因子的分泌[12],在抗炎、预防aGVHD发生或减轻其严重程度的同时,且不削弱移植物抗白血病作用[13]。
aGVHD是allo-HSCT后最主要并发症,也是直接影响患者预后及allo-HSCT成功与否的关键。2004年Le Blanc等[14]首次报道MSCs对常规治疗无效的aGVHD治疗有效以来,越来越多的临床研究结果显示MSCs对于allo-HSCT后重度移植物抗宿主病有预防及治疗作用[4,14]。Chen等[15]用UCMSCs治疗19例激素耐药型aGVHD患儿,11例均CR、4例PR、4例无效。乔淑敏等[4]报道UCMSCs成功治疗5例重度aGVHD儿童,所有患儿经UCMSCs治疗后均达不同程度的缓解,且治疗过程中未出现UCMSCs治疗相关不良反应。本研究15例aGVHD患儿中,13例对一线免疫抑制剂和CD25单抗治疗无效,经UCMSCs静脉滴注治疗后均达不同程度缓解,与国外报道基本一致[14]。本研究13例难治性皮肤型aGVHD患儿经UCMSCs治疗后均可达到CR,且较胃肠道型aGVHD及肝脏型aGVHD改善时间要短。除与aGVHD程度及个体差异有关外,是否能说明UCMSCs对治疗皮肤型aGVHD要优于肝脏型、胃肠道型aGVHD尚需要更大样本和更深入的临床研究。
HC是HSCT后主要并发症之一,HSCT后180 d HC发生率为7%~70%[16]。大多数研究认为其发生多与血小板减少、预处理药物毒性、全身大剂量放疗、病毒感染、移植物抗宿主病及免疫紊乱等因素有关[17-18]。各种因素均可造成尿道黏膜上皮细胞损伤,加之移植后抗排异药物的使用使骨髓受到抑制、血小板计数低下,最终患者膀胱顺应性降低,出现血尿、尿频、尿急及排尿困难等症状。Ringden等[5]用MSCs治疗成人7例allo-HSCT后发生Ⅱ~Ⅳ度HC,静脉滴注中位细胞数为1.0(0.7~2.0)×106/kg MSCs后,5例症状得到控制。本研究5例HC患儿经静脉滴注UCMSCs后症状均可不同程度缓解,有效率达100%,优于国外文献报道[5]。原因:①本研究所用UCMSCs取自正常足月产胎儿脐带,较文献报道骨髓源性MSCs具有更强的增殖及组织修复能力[19];②本研究5例静脉滴注的UCMSCs中位细胞数(3.0×106/kg)高于文献报道(1.0×106/kg)[5]。但UCMSCs治疗HC效果是否呈剂量依赖性,目前尚缺乏对照研究,相信随着UCMSCs治疗HC理论基础及临床研究的深入、大样本对照研究的开展定会给予解答。
本研究15例行allo-HSCT后发生难治性aGVHD 13例(合并HC 5例),经UCMSCs治疗后均达不同程度缓解,且静脉滴注后无任何不良反应。UCMSCs为HSCT后发生重度aGVHD和HC并发症患儿提供了一种新的安全有效的治疗手段,但如何优化UCMSCs静脉滴注剂量、时机、途径与疗程亟待进一步研究。相信随着UCMSCs免疫调节机制研究的不断深入及临床研究的不断推进,UCMSCs的临床应用也将有更为广阔的前景。
[1]Kurosawa K,Urakami S,Ishiwata K,et al.Significance of urological surgical treatment for viral hemorrhagic cystitis after allogeneic hematopoietic stem cell transplantation[J]. Hinyokika Kiyo,2016,62(11):563-567.
[2]Ringden O,Le Blanc K.Mesenchymal stem cells for treatment of acute and chronic graft-versus-host disease,tissue toxicity and hemorrhages[J].Best Pract Res:Clin Haematol,2011,1(24):65-72.
[3]Rowlings PA,Przepiorka D,Klein JP,et al.IBMTR severity index for grading acute graft-versus-host disease:retrospective comparison with Glucksberg grade[J].Br J Haematol,1997,97(4):855-864.
[4]乔淑敏,陈广华,王易,等.脐带间充质干细胞治疗儿童异基因造血干细胞移植后急性移植物抗宿主病疗效观察[J].中国实验血液学杂志,2013,21(3):716-720.
[5]Ringden O,Uzunel M,Sundberg B,et al.Tissue repair using allogeneic mesenchymal stem cells for hemorrhagic cystitis,pneumomediastinum and perforated colon[J].Leukemia,2007,21(11):2271-2276.
[6]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:北京科学出版社,2007:268-271.
[7]Bartholomew A,Sturgeon C,Siatskas M,et al.Mesenchymal stem cells suppress lymphocyte proliferation in vitro and prolong skin graft survival in vivo[J].Exp Hematol,2002,30(1):42-48.
[8]Sun Z,Wang S,Zhao RC.The roles of mesenchymal stem cells in tumor inflammatory microenvironment[J].J Hematol Oncol,2014,7(1):2-21.
[9]Bernardo ME,Fibbe WE.Mesenchymal stromal cells:sensors and switchers of inflammation[J].Cell Stem Cell,2013,13(4):392-402.
[10]Selmani Z,Naji A,Zidi I,et al.Human leukocyte antigen-G5 secretion by human mesenchymal stem cells is required to suppress T lymphocyte and natural killer function and to induce CD4+CD25highFOXP3+regulatory T cells[J].Stem Cells,2008,26(1):212-222.
[11]Burr SP,Dazzi F,Garden OA,et al.Mesenchymal stromal cells and regulatory T cells:the Yin and Yang of peripheral tolerance?[J].Immunol Cell Biol,2013,91(1):12-18.
[12]Amir AL,Hagedoorn RS,van Luxemburg-Heijs SA,et al. Identification of a coordinated CD8 and CD4 T cell response directed against mismatched HLA classⅠcausing severe acute graft-versus-host disease[J].Biol Blood Marrow Transplant,2012,18(2):210-219.
[13]Fowler DH,Gress RE.Th2 and Tc2 cells in the regulation of GVHD,GVL,and graft rejection:considerations for the allogeneic transplantation therapy of leukemia and lymphoma[J].Leuk Lymphoma,2000,38(3/4):221-234.
[14]Le Blanc K,Rasmusson I,Sundberg B,et al.Treatment of severe acute graft-versus-host disease with third party haploidentical mesenchymal stem cells[J].Lancet,2004,363 (9419):1439-1441.
[15]Chen T,Yang M,Qiao M,et al.Clinical study of umbilical cord-derived mesenchymal stem cell for treatment of nineteen patients with steroid-resistant severe acute graft-versus-host disease[J].Cytotherapy,2014,16(4 Suppl):S34.
[16]Uhm J,Hamad N,Michelis FV,et al.The risk of polyomavirus BK-associated hemorrhagic cystitis after allogeneic hematopoietic SCT is associated with myeloablative conditioning,CMV viremia and severe acute GVHD[J].Bone Marrow Transplant,2014,49(12):1528-1534.
[17]徐宏贵,方建培,黄绍良,等.儿童造血干细胞移植后出血性膀胱炎:临床特征与危险因素[J].中国组织工程研究与临床康复,2008,12(8):1596-1600.
[18]Fu HX,Xu LP,Liu DH,et al.Higher proportions of peripheral CD19+CD5+B cells predict the effect of corticosteroid in patients with late-onset hemorrhagic cystitis after allogeneic hematopoietic stem cell transplantation[J].Chin Med J(Eng1),2011,124(10):1517-1523.
[19]Choudhery MS,Badowski M,Muise A,et al.Comparison of human mesenchymal stem cells derived from adipose and cord tissue[J].Cytotherapy,2013,15(3):330-343.
Therapeutic effect of umbilical cord-mesenchymal stem cell on transplantation-related complications in children
TANG Feilong1,LUAN Zuo1,2,WU Nanhai2,TANG Xiangfeng2,LU Wei2,JING Yuanfang2
(1.Postgraduate School,Anhui Medical University,Hefei Anhui 230032,China;2.Department of Pediatrics,Navy General Hospital,Beijing 100048,China)
Objective To evaluate the efficacy and safety of umbilical cord mesenchymal stem cells(UCMSCs)in children with acute graft versus host disease(aGVHD)and hemorrhagic cystitis(HC)after allogeneic hematopoietic stem cell transplantation(allo-HSCT).Methods A total of 15 pediatric patients with refractory aGVHD or HC after allo-HSCT.Thirteen pediatric patients with aGVHD include 5 cases of HC with first-line immunosuppressor and CD25 monoclonal antibody. After failure treatment we gave combined intravenous infusion with UCMSCs.The mean dose of UCMSCs was 3.6×106/kg[range(1.3—6.0)×106/kg]cells per kg bodyweight and the mean therapeutic times were 5(range 2—21).Then we observed the recovery,recurrence of aGVHD and HC and adverse reactions for 47 months(range 36—73).Results Thirteen cases after combined treatment with UCMSCs administration,and 8 patients had a complete response and 5 patients had a partial response.With a poor outcome after hydration and alkalization in 5 cases HC patients,symptoms disappeared after combined intravenous infusion with UCMSCs.No patients had obvious side effect after infusion with UCMSCs.Conclusion UCMSCs are safe and effective for the combined treatment in children with aGVHD or HC after allo-HSCT.
Umbilical cord mesenchymal stem cells(UCMSCs);Acute graft versus host disease(aGVHD);Hemorrhagic cystitis(HC);Hematopoietic stem cell transplantation(HSCT)
R726
B
2095-3097(2017)03-0132-05
10.3969/j.issn.2095-3097.2017.03.002
2017-01-16 本文编辑:徐海琴)
国家自然科学基金青年科学基金项目(81601055)
230032安徽合肥,安徽医科大学研究生学院(唐飞龙,栾 佐);100048北京,海军总医院儿科(栾 佐,吴南海,唐湘凤,卢 伟,井远方)
栾 佐,E-mail:luanzuo@yahoo.com

