甘薯茎尖快速剥离及成苗技术研究
辛国胜,邱鹏飞,商丽丽,韩俊杰,张 磊,李美玲,王 鹏,刘庆昌
(1山东省烟台市农业科学研究院,烟台 265500;2中国农业大学,北京 100094)
甘薯茎尖快速剥离及成苗技术研究
辛国胜1,邱鹏飞1,商丽丽1,韩俊杰1,张 磊1,李美玲1,王 鹏1,刘庆昌2
(1山东省烟台市农业科学研究院,烟台 265500;2中国农业大学,北京 100094)
以优质食用型甘薯品种‘烟薯25’为材料,在室内和田间条件下,进行不同茎尖剥离方式对比试验、茎尖成苗对比试验、病毒检测试验、试管苗快繁试验以及产量对比试验,研究甘薯高效脱毒的最佳方式。结果表明:采用“一刀切”的茎尖剥离技术平均茎尖成活率和成苗率比常规的层层剥离技术分别高219.2%和429.7%,茎尖培养的最佳培养基配方为MS+0.08 mg/L IBA+0.06mg/L 6-BA;经病毒检测,采用“一刀切”技术病毒脱除率为50%,而常规技术为25%;通过6种不同快繁培养基配方的试验发现,MS+0.04 mg/L IBA+0.05 mg/L GA为最理想的快繁培养基;经田间产量对比分析,脱毒苗鲜薯产量比不脱毒苗平均增产19.9%、薯干增产19.6%,单株结薯数增加0.6块,大中薯率提高3.8%。
甘薯;脱毒;茎尖快速剥离;快繁
在甘薯中已鉴定出20余种病毒和类病毒,它们能造成甘薯产量、品质逐年下降[1-2]。病毒在甘薯中依赖胞间连丝和营养物质流两种途径传播,茎尖是病毒不能到达和存活的组织[3-4],因此,茎尖脱毒是解决甘薯病毒病的主要措施[5]。当前的茎尖剥离技术是将无菌材料放于解剖镜下,逐层剥离到带1—2个叶原基为止,然后切取0.2—0.4 mm的茎尖[5-10],为防止剥离出的茎尖变干,应选择荧光灯或玻璃纤维灯为好,同时在材料下要垫一块湿润的无菌滤纸[11]。由于甘薯茎尖剥离是在无菌操作台上进行,无菌风持续在吹,虽然下面垫湿润滤纸,但由于操作时间长,很容易造成茎尖干燥,致使成活率下降。针对这种情况,烟台市农业科学研究院选择通过国家鉴定的优质食用型甘薯品种‘烟薯25’作为试验材料,探讨创新甘薯茎尖的快速剥离方法,以期达到脱毒效果好、剥离速度快、成活率高的目的。
1 材料与方法
1.1 试验材料
以通过国家鉴定的优质食用型甘薯品种‘烟薯25’作为试验材料。
1.2 试验方法
1.2.1 茎尖分生组织植株再生
1.2.1.1 外植体处理 选择完好、无病害、未经脱毒的‘烟薯25’薯块在培养箱中萌发薯苗,等薯苗长至18 cm左右,剪取1 cm左右顶芽,用0.1%的多菌灵消毒8 min,清水冲洗10 min左右,然后用滤纸吸干表面水分,在超净工作台上先用70%乙醇浸泡10 s,无菌水冲洗后,再用0.1%HgCl2消毒10 min,无菌水冲洗5次后待用[5-6]。
1.2.1.2 茎尖剥离 将消毒好的‘烟薯25’顶芽利用解剖镜于无菌环境下切取0.2—0.4 mm微茎尖,试验采用两种方法:一是采用常规的层层剥离方法(以下标注为a),茎尖带1—2个叶原基;二是剥离到还剩5—6层时,采用“一刀切”的快速剥离技术,即一刀切下,然后用解剖针分离的快速剥离技术(以下标注为b)。
1.2.1.3 茎尖诱导培养基激素配方设计 设计3种诱导培养基配方。处理1:MS+0.1 mg/L IAA+0.1 mg/L 6-BA,诱导20 d后转至MS培养基上;处理2:MS+0.08 mg/L IBA+0.06 mg/L 6-BA,诱导20 d后转至MS培养基上;处理3:MS+0.1 mg/L IBA+0.07 mg/L 6-BA,诱导20 d后转至MS培养基上。
1.2.1.4 茎尖诱导培养条件 光照14 h/d,光强1 500—2 000 lx,温度25—28℃,100 mL三角瓶,每瓶
装入培养基25 mL,接种1个茎尖,塑料薄膜封口。每处理接种10瓶,2次重复。
1.2.2 ‘烟薯25’脱毒苗的驯化与病毒检测
将经诱导及培养获得的‘烟薯25’茎尖苗培养30—50 d,待苗长到8—10 cm时,进行单或双茎节段繁殖,一般每株切取4—5段,转入MS培养基或改良的MS培养基上培养,30 d左右每个茎尖苗即可形成多个植株,待多个植株长到7 cm以上时,选取其中一部分进行驯化,将瓶苗移至大棚内消毒过的通气性较好的地块内,用塑料进行拱形覆盖,5—6 d后逐步打开塑料,在大棚的自然温光条件下驯化,驯化成功后即可嫁接指示植物进行病毒检测,本研究选用的指示植物为巴西牵牛[12]。嫁接方法:将待检测的甘薯茎端嫁接到长有3—4片叶的巴西牵牛幼苗侧干上,套上塑料袋5 d后,解袋,10—15 d病毒就会在巴西牵牛体内繁殖积累,如果巴西牵牛嫁接后新生叶出现黄化、明脉、褪绿斑点、沿脉变色等症状[13-14],则说明该株系带病毒,无症状说明该株系不携带病毒。鉴定结果中若一个茎尖苗系中有一株带有病毒,则需淘汰整个茎尖苗系,鉴定无病毒的茎尖苗可以进行扩繁。
1.2.3 脱毒试管苗的组培快繁
1.2.3.1 植物材料 以经过病毒检测确定无毒的‘烟薯25’试管苗为材料,进行单或双茎节段繁殖[15-16]。培养基采用三角瓶(100 mL)分装,每瓶装25 mL培养基,接种3个茎节。培养15 d后,观察植株长势(强:平均株高>5 cm、茎粗>0.3 cm,中:平均株高3—5 cm、茎粗0.2—0.3 cm,弱:平均株高<3 cm、茎粗<0.2 cm)、根系发育(好:平均根系长>6 cm、粗>0.08 cm,中:平均根系长4—6 cm、粗0.06—0.08 cm,差:平均根系长<4 cm、粗<0.06 cm),并测定成活率、节间长度、茎粗、茎高。
1.2.3.2 培养基处理 设6个固体培养基处理。pyj1:MS不加激素;pyj2:MS+0.04 mg/L IBA;pyj3:MS+0.04 mg/L IBA+0.05 mg/L GA;pyj4:1/2MS不加激素;pyj5:1/2MS+0.04 mg/L IBA;pyj6:1/2MS+0.04 mg/L IBA+0.05 mg/L GA。
1.2.3.3 培养条件 每处理接种10瓶,3次重复,在25℃左右、光强2 000—3 000 lx、14 h/d光照条件下培养[17]。
1.2.4 ‘烟薯25’脱毒苗的增产效果
试验设脱毒与非脱毒两个处理,脱毒苗选用经病毒检测无病毒的快繁原种苗,非脱毒苗选择非脱毒种薯萌发的薯苗,试验地点在烟台市农业科学研究院2号试验地,采取随机区组排列,3次重复,小区5行区,行长3 m,行距0.8 m,面积12 m2,于2012年5月12日栽插,栽植密度62 430株/hm2;10月13日收获,大田生长期153 d。每小区测中间3行鲜薯产量,3次重复平均数据作为最终产量。
2 结果与分析
2.1 ‘烟薯25号’茎尖分生组织植株再生研究
两种茎尖剥离方式3种诱导培养基共计6个处理(其处理分别用a+1、a+2、a+3、b+1、b+2、b+3表示),接种7—10 d后,成活的茎尖开始形成愈伤组织,茎尖开始变绿。接种10—18 d后,愈伤组织继续膨大,芽开始转绿并萌动生长。20 d后,成活的茎尖转移到无激素的MS培养基上,继续培养30—40 d,此时各处理的茎尖成苗率有差异,采用“一刀切”的茎尖剥离技术平均茎尖成活率和成苗率分别为53.3%和33.3%,比常规的层层剥离技术(平均茎尖成活率和成苗率分别为16.7%和6.7%)分别提高219.2%和429.7%。“一刀切”的茎尖剥离技术3种培养基的处理中,以MS+0.08 mg/L IBA+0.06 mg/L 6-BA茎尖诱导效果最好,茎尖成活率为60.0%,成苗率为40.0%,“一刀切”的茎尖剥离技术3种处理的茎尖成活率显著高于常规技术。说明采用“一刀切”的茎尖剥离技术,配合MS+0.08 mg/L IBA+0.06 mg/L 6-BA的诱导培养基配方是‘烟薯25’茎尖诱导培养的最佳方法(表1、图1、图2)。
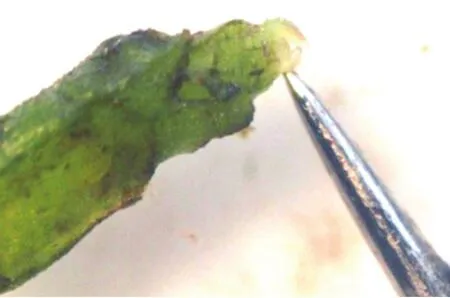
图1 传统的层层茎尖剥离方法Fig.1 The traditional peeling method of stem tip w ith layer by layer

表1 不同剥离技术与外源激素对‘烟薯25’茎尖分生组织培养的影响Table 1 Effects of different stripping technology and exogenous hormones on the stem tip m eristem culture of‘Yanshu 25’

图2 “一刀切”的茎尖剥离技术Fig.2 ‘One size fits all’stripping technology of stem tip
2.2 ‘烟薯25’脱毒苗的驯化与病毒检测
将经诱导及培养获得的25个‘烟薯25’茎尖苗进行扩繁、驯化成功后,用指示植物巴西牵牛进行嫁接病毒检测,每株系嫁接5株,最终确定了a+2-2、b+1-3、b+1-5、b+2-1、b+2-3、b+2-5、b+2-7、b+2-8、b+3-1、b+3-3、b+3-4株系无病毒症状,常规层层剥离技术有1个株系不带病毒,病毒脱除率为25%,而通过快速剥离技术得到的20个株系,10个株系不带病毒,病毒脱除率为50%(表2)。
2.3 ‘烟薯25’脱毒试管苗的组培快繁研究
将确定无病毒的株系按6个处理进行试管苗快繁试验,在15 d时,观察植株长势、根系发育,并测定成活率、节间长度、茎粗、茎高。结果表明:6个处理中,以处理3和处理6综合性状最好,成活率、根系发育、生长势均最好,节间长度、茎粗、茎高以处理3最高,处理6次之。因此MS、1/2MS+0.04 mg/L IBA+0.05 mg/L GA可以作为‘烟薯25’试管苗快繁的理想培养基,考虑到节间长度长有利于单茎节扦插快繁操作[18-19],确定MS+0.04 mg/L IBA+0.05 mg/LGA为‘烟薯25’试管苗快繁最理想的培养基(表3)。
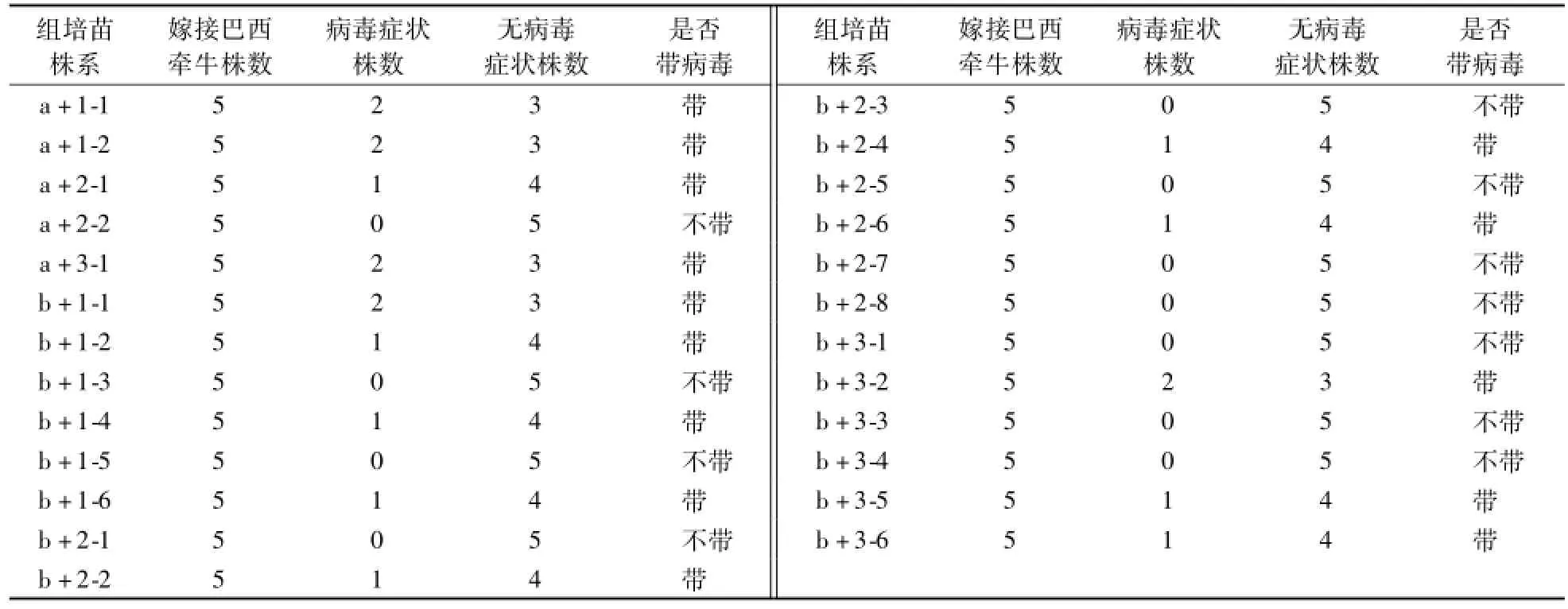
表2 ‘烟薯25’脱毒茎尖苗的病毒检测Table 2 Virus detection of virus-free stem tip seed ling of‘Yanshu 25’
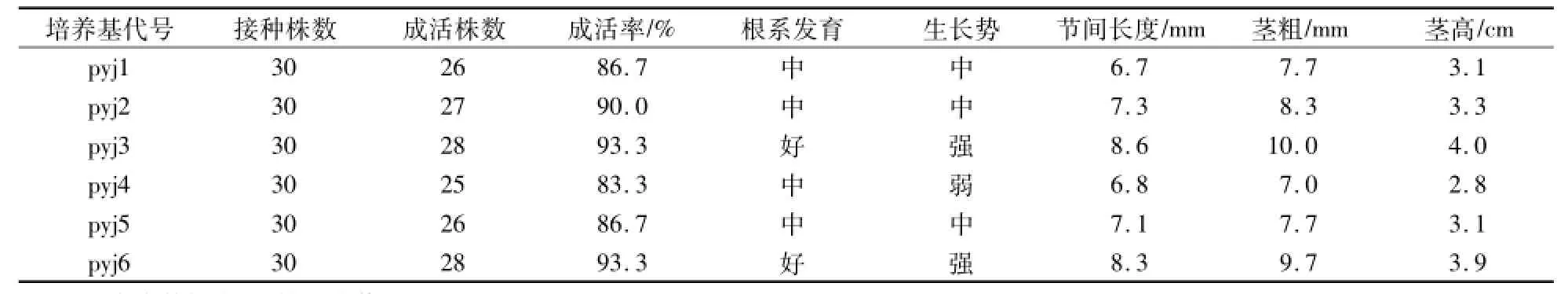
表3 不同快繁培养基对‘烟薯25’的试管苗繁殖效果Table 3 The propagation effects of‘Yanshu 25’p lantlets in different propagation medium
2.4 ‘烟薯25’脱毒苗的增产效果
试验结果表明,‘烟薯25’脱毒苗比非脱毒苗生长势强,单株结薯数增加0.6块,大中薯比率提高3.8%,脱毒苗增产效果显著,鲜薯产量平均增产19.9%,达极显著水平;薯干产量平均增产19.6%,达显著水平(表4)。
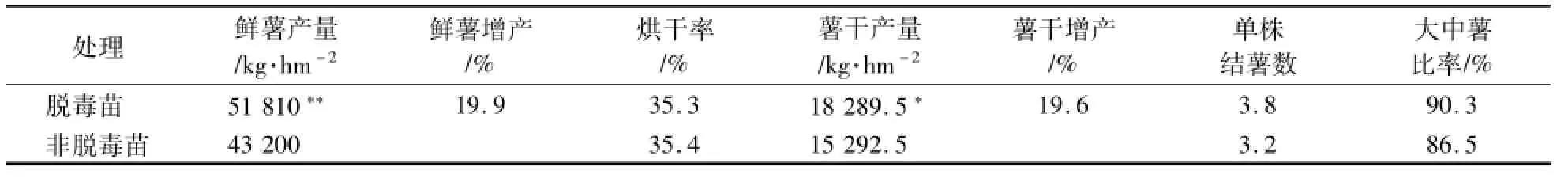
表4 ‘烟薯25’脱毒苗的增产效果及显著性测验(t测验)Table 4 Stim ulation effects of‘Yanshu 25’virus-free seed lings and significance test of average yield(t-test)
3 结论与讨论
绝大多数无性繁殖植物均容易感染病毒病,如马铃薯[6]、甘蔗[20]、牡丹[21]、铁皮石斛[22]等,解决脱毒问题只能靠茎尖培养,有些植物如马铃薯先经高温处理后,再进行茎尖培养,脱毒效果更好[10]。利用茎尖剥离技术对甘薯进行脱毒也是行之有效的[1-4],很多材料中均没有提出详细的茎尖剥离技术,大都笼统地表述为利用镊子等工具剥离至0.2—0.3 mm或剥离至剩余1—3片叶原基[7-9]。当前常用的甘薯茎尖剥离技术主要采用层层剥离法[9],在实际操作中,操作难度较大,极易损伤茎尖组织,致使成苗率较低。而且传统的层层剥离法增加了茎尖剥离的操作时间,容易造成茎尖干燥,这也可能导致茎尖成苗率低。针对这些实际问题,烟台市农业科学研究院提出了“甘薯茎尖快速剥离技术”,这套技术不只是局限于剥离环节,还包含了试验材料的快速生长培育(有利于茎尖的分离)、看准部位一刀切下的把握水平、茎尖组织分离等环节。该技术操作方便、快速,由于有外层叶原基的保护,茎尖不容易遭到破环,也不容易干燥,因此成活率提高,且随着技术的熟练,容易获得更小的茎尖,从而提高脱毒效果。本研究中,层层剥离法剥离的茎尖成活率最高仅为10%,而新技术茎尖成活率和成苗率分别为53.3%和33.3%,比常规的层层剥离技术分别提高219.2%和429.7%。
本研究在病毒检测时采用了指示植物巴西牵牛进行病毒检测,研究表明,该方法具有灵敏度高、准确性好、可以排除外界环境毒源的干扰、不受季节限制、成本低等优点[20,22]。利用该技术检测的常规剥离技术得到的4个株系只有1个株系不带病毒,说明传统方法剥离难度大,剥离越小,成苗率越低,而成活的多为剥离较大的,因此带毒率相对较高。新方法在茎尖剥离过程中对误操作造成茎尖过大的材料,一般选择丢弃,只保留小的茎尖,因此带毒率相对较低。
在茎尖诱导培养基配方的选择上,很多材料均采用较高的激素浓度,茎尖诱导率较高[7-11],但均没有对后代变异情况做出分析。本试验考虑到高浓度激素容易引起茎尖变异,在试验中设定的激素浓度较低,虽然茎尖诱导率较低,但在生产实践中,没有发现变异株。
本试验主要是针对甘薯茎尖进行的剥离方式及成苗技术的研究,有利于解决目前甘薯茎尖脱毒存在的剥离困难、成苗率低或不成苗等难题,为甘薯脱毒提供了一种新的技术,对更好解决生产上因病毒病危害造成产量、品质下降的问题具有重要意义。
[1]唐丽,邹永祥,涂雅珍,等.植物组培脱毒技术在甘薯上的应用研究[J].西南农业学报,2008,21(3):882-884.
[2]张振臣,马淮琴,张桂兰.甘薯病毒病研究进展[J].河南农业科学,2000(9):19-22.
[3]张振臣,乔奇,秦艳红,等.我国发现由甘薯褪绿矮化病毒和甘薯羽状斑驳病毒协生共侵染引起的甘薯病毒病害[J].植物病理学报,2012,42(3):328-333.
[4]康明辉,刘德畅,海燕,等.甘薯脱毒技术的原理及方法[J].种业导刊,2010(1):14-15.
[5]张军云,张钟,张建康,等.紫甘薯组培快繁技术研究[J].中国农学通报,2014,30(4):96-100.
[6]冯光慧,杜虎平,李夏隆,等.携病毒马铃薯茎尖分化成苗与脱毒率检测[J].西北植物学报2015,35(3):622-627.
[7]赵雨佳,黄振霖,欧建龙,等.高淀粉甘薯茎尖脱毒与组培技术研究[J].南方农业,2012,6(4):82-84.
[8]王碧琴,盖安俊.紫色甘薯茎尖脱毒与快繁及试管苗移植技术研究[J].江西科学2010,28(2):196-202.
[9]杨贤松,杨占苗,高峰,等.紫色甘薯的茎尖培养与脱毒[J].热带作物学报,2007,28(3):68-73.
[10]秦梅,张燕,徐美恩,等.甘薯茎尖脱毒及组培快繁技术[J].安徽农业科学,2014,42(32):11238-11239,11258.
[11]颜廷进,王庆美,张立明.提高甘薯茎尖分生组织培养诱导率的研究[J].山东农业科学,1997(2):18-20.
[12]张希太,张彦波,肖磊,等.利用巴西牵牛试管苗检测甘薯组培苗病毒技术研究[J].农学学报,2013,3(12):16-22.
[13]王丰.甘薯病毒病脱毒技术及检测[J].植物检疫,2003,17(5):295-298.
[14]陈玉霞,谷峰,张朝臣,等.甘薯病毒病检测技术研究[J].湖北植物,2013(3):31-33,36.
[15]周志林,唐君,张允刚,等.甘薯脱毒试管苗高效快繁体系研究[J].西北农业学报,2008,17(1):257-262.
[16]李怀情,牛力立,赵佐敏,等.紫云甘薯组培脱毒及离体快繁技术研究[J].种子,2014,33(10):131-134.
[17]王碧琴,盖安俊.紫色甘薯茎尖脱毒与快繁及试管苗移植技术研究[J].江西科学,2010,28(2):196-202.
[18]翁定河.甘薯脱毒苗生产力表现研究[J].杂粮作物,2006,26(1):31-32.
[19]廖平安,勒文奎,郭春强.脱毒甘薯的增产潜力分析[J].作物杂志,2002(6):16-17.
[20]陈敏敏,孙建.甘蔗茎尖脱毒及再生苗扩繁中培养条件的优化[J].上海农业学报,2015,31(3):35-39.
[21]朱向涛,王雁,吴倩,等.江南牡丹茎段愈伤组织诱导与植株再生[J].核农学报,2015,29(1):56-62.
[22]张志勇,齐泽民,黄作喜.铁皮石斛生物技术研究进展[J].核农学报,2014,28(4):605-610.
(责任编辑:闫其涛)
Research on the technology of seedling and rapid stripping of sweet potato stemtip
XIN Guo-sheng1,QIU Peng-fei1,SHANG Li-li1,HAN Jun-jie1,ZHANG Lei1,LIMei-ling1,WANG Peng1,LIU Qing-chang2
(1Yɑntɑi Acɑdemy of Agriculturɑl Sciences,Yɑntɑi265500,Chinɑ;2ChinɑAgriculture University,Beijing 100094,Chinɑ)
Comparison experiments of different stem tip stripping ways,stem tip seedling,yield,and experiments of virus detection and rapid propagation of plantlets in laboratory and field were conducted to study the best way of detoxification of sweet potato,taking high quality edible sweet potato variety‘Yanshu 25’as material.The results showed that the stem tip survival rate and seedling rate of“one size fits all”stripping technology were 219.2%and 429.7%higher than those of conventional peeling technology,the bestmedium for stem tip culture was MS+0.08 mg/L IBA+0.06 mg/L 6-BA.After virus detection,the virus removal rate of“one size fits all”technology could reach 50%,while that of the conventional technique was 25%.Experiments of different propagation culture showed that MS+0.04 mg/L IBA+0.05 mg/L GA was the best one.Field tests showed that fresh yield and dry matter yield of virus-free seedlings increased by 19.9%and 19.6% respectively.The tuber number per plant increased 0.6,and the rate of large and medium potato increased by 3.8%.
Sweet potato;Detoxification;Rapid stripping of stem tip;Propagation
S632.04
A
1000-3924(2017)01-069-05
2015-09-21
国家甘薯产业技术体系(CARS-11-C-09);山东省现代农业产业技术体系薯类创新团队(SDAIT-10-011-02);国家“863”计划(2012AA101204);山东省科技发展计划(2014GNC111004)
辛国胜(1972—),男,硕士,研究员,主要从事甘薯遗传育种、栽培及脱毒组培研究。E-mail:guoshengx@sina.com

