抗菌钛合金Ti6Al4V-6Cu生物安全性初步研究
李抒缦, 许雄程, 钟 泉, 陈 超, 骆 凯
引导骨组织再生术(guided bone regeneration,GBR)是指以膜材料作为屏障,阻止骨缺损周围软组织长入,为骨组织再生提供空间[1-3]。钛网具有一定的机械性能,可持续为严重骨缺损部位提供稳定的骨生长空间,因而广泛应用于临床[4-7]。研究发现,由于钛网等植入物表面吸附蛋白的存在,容易导致口腔致病菌黏附到植入物表面,引发局部感染,影响骨再生[8-9]。因此,在GBR治疗时使用本身具有抑菌活性的材料具有重要的临床意义。近年来,铜离子因其独特的抗菌性能,常被用于制备具有抗菌活性的植入物材料[10]。研究表明,利用3D打印技术中的选择性激光熔化技术(selective laser melting,SLM)制备含铜钛合金材料Ti6Al4V-6Cu具有较强的抗菌性能[11]。本研究拟在其前期研究工作基础上,通过体内、外实验初步探讨Ti6Al4V-6Cu的生物安全性,为将来利用3D打印制备具有抗菌性能的个性化钛网应用于GBR提供实验依据。
1 材料和方法
1.1. 材料
1.1.1样品 Ti6Al4V-6Cu由中科院海西研究院先进制造技术集成研究所利用SLM技术制备,规格为10 mm×10 mm×3 mm,主要成分:铝:5.5~6.5 wt.%;钒:3.5~4.5 wt.%;铜:5.5~6.0 wt.%;碳:0~0.08 wt.%;铁:0~0.25 wt.%;氧:0~0.31 wt.%;氮:0~0.05 wt.%;氢:0~0.12 wt.%;钛:依据合金配平。

A:7~8为Ti6Al4V-6Cu;9~10为Ti6Al4V;B:体式显微镜下观察结果.图1 Ti6Al4V-6Cu肉眼及镜下观察Fig 1 The characterization of Ti6Al4V-6Cu
1.1.2细胞和动物 MC3T3-E1细胞(中国科学院上海生命科学研究院);健康Wistar大鼠(南京军区福州总医院比较医学科);健康成年新西兰大耳兔(南京军区福州总医院比较医学科)。
1.1.3试剂 DMEM培养液、胎牛血清(fetal bovine serum,FBS,美国Hyclone公司);青霉素、链霉素(上海碧云天生物技术研究所);胰蛋白酶(美国Gibco公司);二甲基亚砜(美国Invitrogen公司);MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,美国Sigma公司];苏木精(国药集团化学试剂有限公司);伊红[中国医药(集团)上海化学试剂公司];其他如丙酮、多聚甲醛、乙醇、乙二胺四乙酸二钠(EDTA)、二甲苯、氯仿、异丙醇、甲醛、冰醋酸、NaCl、KCl等为国产分析纯试剂(分析纯AR,汕头市西陇化工有限公司)。
1.1.4仪器 HEAL FORCE超净工作台(苏州净化设备有限公司);生物安全柜(力申科学仪器有限公司);细胞培养箱(德国Heraeus公司);全自动酶标仪(美国iMARK公司);电热恒温水槽(DK-8D,上海精宏实验设备有限公司);倒置相差显微镜(广州光学仪器厂);倒置相差荧光显微镜(带摄影系统)(日本Olympus公司);电子天平(德国Sartorius公司公司);台式离心机(Labofuge 400R,德国Heraeus);生物组织包埋机(宏业医用仪器有限公司);石蜡组织切片机(德国Leica公司)。
1.2方法
1.2.1材料浸提液的制备 参照文献[12]方法,Ti6Al4V-6Cu材料经丙酮、无水乙醇、75%乙醇、三级水逐级超声清洗、烘干、高温高压消毒。按材料表面积和浸提液介质3 cm2/mL的比例加入DMEM低糖培养液,取等体积DMEM低糖培养液作空白对照,置于细胞培养箱(37 ℃、体积分数为0.05的CO2)中浸提72 h备用。
1.2.2体外细胞毒性实验 参照文献[13]方法,将MC3T3-E1细胞悬液以每孔5×103个接种于96孔培养板(n=6),细胞培养箱(37 ℃、体积分数为0.05的CO2)中培养。将材料浸提液按照100%,50%,25%,1%的浓度与DMEM低糖培养液进行配比,并使各浓度均含10%胎牛血清。阳性对照组为苯酚浓度6.4 g/mL的含10%胎牛血清的DMEM低糖培养液;阴性对照组为含10%胎牛血清的空白对照浸提液。24 h后细胞生长至近汇合。弃原培养液,各组加入96孔培养板中(200 μL/孔),置于细胞培养箱中继续培养。分别于培养后第1,3,5天采用MTT比色法检测细胞的增殖能力,即取各组细胞各6孔,每孔加入200 μL新鲜配制5 g/L的MTT,37 ℃孵育4 h后小心吸弃各孔内培养液,每孔加入200 μL二甲基亚砜,低速震荡10 min,酶标仪检测各孔492 nm处光密度值(optical density,OD)。重复实验3次。计算细胞相对增殖率(relative growth rate,RGR):
RGR=(ODsample-ODblank)/(ODnegative-ODblank)×100%
其中,ODsample为实验组;ODnegative为阳性对照组;ODblank为阴性对照组即空白对照浸提液组。细胞增殖百分率与毒性分级的对应关系为:增殖率≥100%为0级,75%~99%为1级,50%~74%为2级,25%~49%为3级,1%~24%为4级,0%为5级。0,1级反应为无毒性反应。
1.2.3短期全身毒性实验 参照文献[14]方法,选取130~150 g的健康Wistar大鼠20只,雌雄各半,随机分为2组:实验组以浓度为100%材料浸提液按5 mL/kg体质量的剂量对大鼠进行灌胃;用相同剂量的空白对照浸提液对对照组大鼠进行灌胃。每天灌胃1次,连续1周。灌胃结束后,相同环境下继续常规饲养1周,每天观察大鼠体征并称体质量。同时计算各动物每周体质量相对增长率[体质量相对增长率(%)=体质量增长量/原始体质量×100%]。2周后,处死大鼠,解剖观察大鼠心、肝、脾、肺、肾等重要脏器有无充血、出血、水肿或其他变化,并取肝、肾进行常规组织病理切片观察。
1.2.4急性溶血实验 参照文献[16],选取体质量 2.5~3 kg 健康成年新西兰大耳兔耳缘静脉采血8 mL,加入肝素钠抗凝,用10 mL生理盐水稀释备用。实验组按表面积与浸提液体积比为1.25 cm2/10 mL的标准,将待测样品与适量生理盐水混合,每组各3管。阴性对照组每管加10 mL生理盐水,共3管;阳性对照组每管加10 mL超纯水,共3管。37 ℃水浴30 min。每管加稀释血0.2 mL,轻轻混匀后置于37 ℃水浴60 min。取各试管内液体3 000 r/min 离心 5 min,吸取上清200 μL于酶标仪检测各组于492 nm 处OD。实验重复3次。按下列公式计算溶血率:
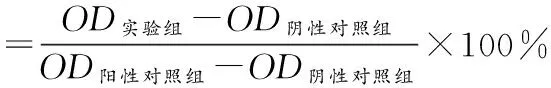
1.3统计学处理 采用SPSS 18.0软件进行统计学处理,检测结果采用单因素方差分析,以P<0.05为差别具有统计学意义。
2 结 果
2.1体外细胞毒性试验
2.1.1MC3T3-E1细胞生长情况观察 MC3T3-E1细胞体外培养1 d时,镜下可见实验组、阳性对照组和阴性对照组中细胞的状态已有明显区别。不同浸提液浓度实验组和阴性对照组中细胞几乎全部贴壁,而阳性对照组中细胞大部分未贴壁。培养5 d时,镜下观察不同浸提液浓度实验组和阴性对照组中的细胞,未发现明显区别。浸提液各组和阴性对照组细胞数量均明显增加,细胞伸展良好,呈椭圆形或梭形,细胞质饱满,具有良好的折光性,还可见圆形的正在分裂的细胞;阳性对照组中大部分细胞未贴壁,细胞正常形态消失,可见部分细胞崩解,核固缩,细胞缩成小圆形漂浮在培养液中(图2)。
2.1.2MTT检测结果 细胞在培养1,3,5 d时,各不同浸提液浓度实验组和阴性对照组比较,差别均无统计学意义(P>0.05);不同浸提液浓度实验组和阴性对照组OD值均明显高于阳性对照组(P<0.05,图3)。细胞毒性分级标准和评定结果见表2。根据公式计算出各组的RGR值,对照表1评定出各组的细胞毒性等级结果显示各实验组评定结果为合格(表2)。

A:100%材料浸提液组;B:阴性对照组;C:阳性对照组.图2 培养5 d各组细胞的形态学观察( ×40)Fig 2 The morphological observation of each group of cells cultured( ×40)

表1 细胞毒性分级标准和评定结果
2.2短期全身毒性试验
2.2.1大鼠生长状况观察 实验过程中,2组大鼠饮食均正常,生长状态良好,行动反应敏捷,皮毛光亮,体质量增量正常,无晕厥、死亡等中毒反应。2组大鼠体质量相对增长率比较,差别无统计学意义(P>0.05,表3)。
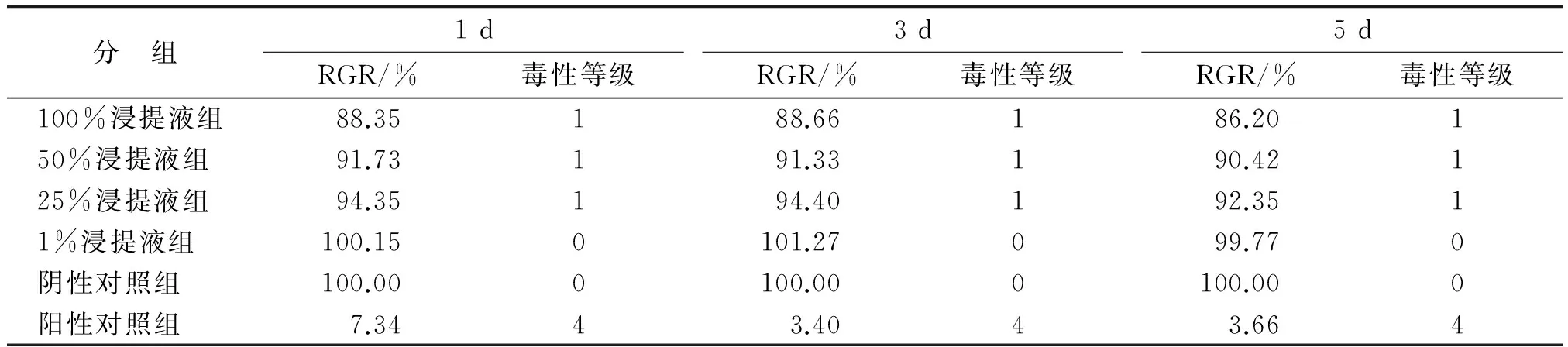
表2 体外培养不同时间点各组细胞相对增值率及细胞毒性等级比较
RGR:细胞相对增殖率.

图3 体外培养1,3,5 d各组细胞MTT检测结果Fig 3 The parameters of MTT test of each group of cells cultured in vitro
Tab3The relative growth rate of weight of two groups of rats

分 组体质量相对增长率/%第1周第2周实验组25.24±1.6816.87±2.50对照组18.04±6.5816.50±3.83

2.2.2大鼠肝、肾组织病理学观察 2组大鼠处死后立即取出肝脏和肾脏进行肉眼观察,可见2组大鼠的肝脏、肾脏颜色、大小无明星差异,无水肿和出血等异常病变;H-E染色后镜下观察肝脏和肾脏的组织切片,实验组和对照组无显著差异,未发现肝、肾细胞出现溶解、萎缩、变性、坏死等病理性变化(图4,5)。

A:实验组; B:对照组.图4 大鼠肝脏组织学观察 (H-E染色 ×40)Fig 4 The histological observation of livers of rats(H-E staining ×40)

A:实验组;B:对照组.图5 大鼠肾脏组织学观察(H-E染色 ×40)Fig 5 The histological observation of kidneys of rats (H-E staining ×40)
2.3溶血试验 实验组即抗菌钛合金Ti6Al4V-6Cu的体外溶血率为2.50%,符合YY/T 0127.1-1993规定的溶血率<5%的标准,证明该材料无溶血反应(表4)。
3 讨 论
近年来,生物医用材料的研发日益成为材料学研究的热点。由于生物医用材料最终将植入人体内,因此对生物材料的生物安全性检测显得尤为重要。

表4 各组试管吸光度值检测结果
体外细胞毒性试验是医疗器械生物安全性评价中一项重要的评价项目,是国内外医疗器械生物学评价系列测试项目中的首选项目[16-17]。体外细胞毒性试验方法有多种,包括:琼脂覆盖法、滤过法、同位素标记法、流式细胞术和色度法如四偶氮唑盐微量酶反应比色法(MTT法)等[18]。其中MTT法由于检测时间较短,操作简便,检测成本低,无需复杂、昂贵的检测设备等特点,成为近年来应用较为广泛的细胞毒性评价方法。
将Ti6Al4V-6Cu样品置于浸提介质(培养液)中一定时间后,材料中的元素会释放到浸提介质中,利用该浸提液与受试细胞相互作用检测细胞毒性。材料浸提液对细胞增殖的影响,可反映出金属材料是否对细胞具有毒性[12,19]。本研究镜下观察结果显示:不同浓度材料浸提液组中MC3T3-E1细胞在1 d时就已贴壁生长,但尚未完全伸展。培养3~5 d时细胞完全伸展,胞体呈圆形或椭圆形,细胞质饱满,有良好的折光性,生长旺盛,可见圆形的分裂细胞,细胞数量与阴性对照组试验结果相同。统计结果显示:MC3T3-E1细胞在1%,25%,50%及100%四个不同浓度的抗菌钛合金Ti6Al4V-6Cu浸提液中培养1~5 d后,细胞相对增殖率与阴性对照组比较,差别无统计学意义。上述结果表明,利用SLM技术制备的抗菌钛合金Ti6Al4V-6Cu无细胞毒性。
GBR中所使用的屏障膜需要在口腔内存留一定的时期,因此需要对植入材料进行全身毒性实验以评价材料的生物安全性。本研究选择将制备的材料浸提液通过灌胃方法对钛合金Ti6Al4V-6Cu的短期全身毒性进行评价。结果表明,与对照组比较,采用Ti6Al4V-6Cu浸提液对大鼠灌胃,大鼠生长状态良好,体质量增量正常,饮食正常,活动灵敏反应迅速,无中毒症状出现。2组大鼠的肝脏和肾脏组织学染色后未见明显的病理性变化。该结果提示,Ti6Al4V-6Cu无短期细胞毒性。
GBR中使用的屏障膜材料在植入后包绕在血液中,并在植入期内持续与血液相互作用。因此,植入材料的组成成分、结构和理化性质对血液的影响至关重要[20-21]。血液相容性试验是针对与循环血液接触的医疗器械而进行的一系列生物学评价,用于评价医疗器械和血液的相互作用[22]。正常情况下红细胞与血浆等渗,出入红细胞内的水分维持平衡;当血浆渗透压低于红细胞内渗透压时,过量的水分进入红细胞,造成红细胞膨胀甚至破裂,血红蛋白逸出进入血浆即表现为溶血。造成溶血的原因有机械力如压力、流变、生物毒素以及各种生化方面的因素[23]。溶血可导致重要脏器血栓形成,进而对这些脏器造成继发损害。作为血液相容性试验中的一个重要评价指标,凡是与循环血液接触的医疗器械都有必要进行溶血实验。本实验采用体外间接法检测抗菌钛合金Ti6Al4V-6Cu材料浸提液的溶血作用。结果显示,新型抗菌钛合金Ti6Al4V-6Cu溶血率为2.50%,符合国家标准(溶血率<5%),提示Ti6Al4V-6Cu具有较佳的血液相容性。
本研究通过体外细胞毒性试验、短期全身毒性实验和溶血实验对抗菌钛合金Ti6Al4V-6Cu的生物安全性进行了初步评价,结果初步证实SLM技术制备的抗菌钛合金Ti6Al4V-6Cu具有良好的生物安全性,后续还将对该材料的生物相容性做进一步的研究,以利于材料最终应用于临床。
[1] Esposito M, Grusovin M G, Felice P,etal. The efficacy of horizontal and vertical bone augmentation procedures for dental implants - a cochrane systematic review[J].EurJOralImplantol,2009,2(3):167-184.
[2] Dahlin C, Linde A, Gottlow J,etal. Healing of bone defects by guided tissue regeneration[J].PlastReconstrSurg, 1988,81(5): 672-676.
[3] Buser D, Bragger U, Lang N P,etal. Regeneration and enlargement of jaw bone using guided tissue regeneration[J].ClinOralImplantsRes,1990,1(1):22-32.
[4] Corinaldesi G, Pieri F, Marchetti C,etal. Histologic and histomorphometric evaluation of alveolar ridge augmentation using bone grafts and titanium micromesh in humans[J].JPeriodontol,2007,78(8):1477-1484.
[5] Proussaefs P, Lozada J. Use of titanium mesh for staged localized alveolar ridge augmentation: clinical and histologic-histomorphometric evaluation[J].JOralImplantol, 2006,32(5):237-247.
[6] Stefano D A, Greco G B, Cinci L,etal. Horizontal-guided bone regeneration using a titanium mesh and an equine bone graft[J].JContempDentPract, 2015,16(2):154-162.
[7] Maiorana C, Santoro F, Rabagliati M,etal. Evaluation of the use of iliac cancellous bone and anorganic bovine bone in the reconstruction of the atrophic maxilla with titanium mesh: a clinical and histologic investigation[J].IntJOralMaxillofacImplants, 2001,16(3):427-432.
[8] Lathif S, Kumar A T, Choudhary S,etal. Use of titanium mesh for staged 3D localized alveolar ridge augmentation[J].IntJOralHealSci,2014,4(1):42-45.
[9] Funato A, Ishikawa T, Kitajima H,etal. A novel combined surgical approach to vertical alveolar ridge augmentation with titanium mesh, resorbable membrane, and rhPDGF-BB: a retrospective consecutive case series[J].IntJPeriodonticsRestorativeDent,2013,33(4):437-445.
[10] Wang Q, Ren L, Li X,etal. Antimicrobial Cu-bearing stainless steel scaffolds[J].MaterSciEngCMaterBiolAppl, 2016,68(1):519-522.
[11] Guo S, Lu Y, Wu S,etal. Preliminary study on the corrosion resistance, antibacterial activity and cytotoxicity of selective-laser-melted Ti6Al4V-xCu alloys[J].MaterSciEngCMaterBiolAppl,2017,72(1):631-640.
[12] 全国量和单位标准化技术委员会.GB/T 16886.12/ISO 10993-12:27第五章:样品制备和参照材料[S].北京:中国标准出版社,2012:87-95.
[13] 全国量和单位标准化技术委员会.GB/T 16886.5/ISO 10993-5:2009第六章:体外细胞毒性试验[S].北京:中国标准出版社,2012:96-123.
[14] YY/T0244-1996.口腔材料生物试验方法短期全身毒性试验:经口途径[S].北京:中国标准出版社,1996:66-69.
[15] 全国量和单位标准化技术委员会.GB/T 16886.4/ISO 10993-4:2002第十一章:与血液相互作用试验选样[S].北京:中国标准出版社,2012:222-243.
[16] 郝和平. 医疗器械生物学评价实施指南[M]. 北京:中国标准出版社,2000:100-101.
[17] Polyzois G L.Invitroevaluation of dental materials[J].ClinicalMaterials,1993,16(1):21-60.
[18] 李 瑞,王青山. 生物材料生物相容性的评价方法和发展趋势[J]. 中国组织工程研究与临床康复, 2011,15(29):5471-5474.
[19] Hanks C T, Wataha J C, Sun Z.Invitromodels of biocompatibility: a review[J].DentMater,1996,12(3):186-193.
[20] Wataha J C. Biocompatibility of dental casting alloys: a review[J].JProsthetDent,2000,83(2):223-234.
[21] 冯颖芳, 康浩方, 张 震. 钛合金医用植入材料的研究及应用[J]. 稀有金属, 2001,25(5):349-354.
[22] 乔春霞,候 丽, 赵增琳. 医疗器械溶血性能评价方法-ASTM直接接触法和间接接触法的比较[J]. 生物医学工程研究, 2014,33(4):264-267.
[23] 乔春霞,候 丽,赵增琳,等. 医疗器械溶血性能三种评价方法的比较[J]. 中国医疗器械信息, 2013,19(7):61-65.

