蛋白质组学检测P4HB蛋白在结直肠癌组织中的表达及其意义
陈德波 ,洪成业, 王青兰, 洪志鹏, 施凉潘, 池 畔
结直肠癌(colorectal cancer, CRC)是一种常见的严重危害人类健康的恶性肿瘤,全世界每年大约有100万的新发、50万的死亡病例[1]。在我国,CRC位居消化道恶性肿瘤的第3位,且随着国民生活水平的提高及饮食结构的改变,发病率还有逐年升高的趋势。目前对CRC的诊断尚无敏感性和特异性均较高的血清学指标[2]。寻找与CRC发生、发展相关的新的肿瘤标志物,将有助于CRC的早期诊断和预后判断,并为开发药物治疗的新靶点提供理论指导。
1 材料与方法
1.1材料
1.1.1标本 收集2008年5-7月在福建医科大学附属协和医院结直肠外科行手术治疗的CRC患者12例,男性7例,女性5例;年龄中位数67岁(47~85岁)。CRC组织及与其配对的正常黏膜组织均取自CRC患者手术切除的新鲜样本,正常黏膜组织为距癌组织>10 cm的肠黏膜,离体30 min内取材,立即置-80 ℃液氮保存。所有标本均经病理确诊,患者术前均未行新辅助放化疗。
另外收集2000年1月-2004年6月接受手术治疗的CRC患者187例的蜡块标本,男性115例,女性72例;年龄(58.81±12.90)岁(24~81岁);AJCC/UICC分期均为Ⅰ~Ⅲ期。患者术前均未接受任何有关CRC的治疗。收集同期手术切除和门诊肠镜检查室活检的腺瘤患者62例的标本,男性46例,女性16例;年龄(56.35±14.13)岁(13~81岁)。取187例癌组织及其中150例癌旁组织、62例腺瘤组织构建组织芯片。所有病例以手术日为随访起点,截止日期为2009年6月。
1.1.2试剂 IPG干胶条pH 4~7,24 cm(17-6002-46)、2-D Quant定量试剂盒(80-6483-56)及考马斯亮蓝R-350(17-0518-01)(瑞典Amersham Bioscience公司);脯氨酰-4-羟化酶(prolyl 4-hydroxylase subunit beta,P4HB)兔抗人多克隆抗体(ab137110,英国Abcam公司);二抗——辣根过氧化物酶(AP)标记山羊抗兔IgG(sc-2004)及内参照β-tublin抗体(sc-33749)(美国Santa Cruz公司);羊抗兔二抗(ZDR-5118,北京中杉金桥公司);增强化学发光剂(RPN2132,美国GE公司)。
1.1.3仪器 等电聚焦电泳系统Ettan IPGphor II(GE-057_TY5740)、大型垂直电泳系统Ettan DALTsix(GE-060_TY6368)、凝胶及图像扫描仪(GE-081_TY0338)(美国GE公司);Imaging Master 2D 5.0凝胶图像分析软件(瑞典Amersham Bioscience公司);4700串联飞行时间质谱仪及质谱分析软件(美国Applied Biosystems公司)。
1.2方法
1.2.1蛋白质组学分析 组织蛋白提取、双向凝胶电泳、扫描分析、选取差异的蛋白点、挖点、图像采集与分析、质谱图的获取、质谱数据的分析方法及结果采用GPS(美国Applied Biosystems公司)-MASCOT(英国Matrix Science公司)进行数据库检索。在NCBInr数据库中进行蛋白鉴定,具体见文献[3]。
1.2.2Western-blot验证 对12例CRC组织及对应的正常黏膜组织进行验证。CRC组织及其癌旁组织各取50 mg,在液氮下碾磨成粉。加入裂解液(7 mol/L尿素、4% Chaps、2 mol/L硫脲、40 mmol/L DTT),4 ℃下离心60 min(40 000 r/min),收集上清液即为提取的总蛋白。取25 μg蛋白进行SDS-PAGE分离。110 V电转 90 min,使蛋白转至PVDF膜上,1% BSA室温下封闭1 h。一抗(兔抗人P4HB抗体,稀释浓度为1∶1 000)室温孵育30 min后4 ℃冰箱过夜,TBST洗膜10 min×3次;AP标记的羊抗兔二抗体中(稀释浓度为1∶2 000)室温孵育1 h,TBST洗膜15 min×4次;ECL发光、曝光。以β-tubulin表达作为内参对照。胶片由Image scanner扫描仪扫描分析。
1.2.3组织芯片与免疫组织化学染色 组织芯片的构建源自Ⅰ~Ⅲ期的187例癌组织、150例正常黏膜组织及62例腺瘤蜡块标本。利用组织阵列仪在蜡块组织芯取材(直径1 mm),每例癌标本取2个组织芯,正常黏膜组织芯列于癌组织芯旁作为对照。每例腺瘤标本取1个组织芯。采用En Vision二步法检测P4HB蛋白在CRC组织、腺瘤组织及正常黏膜组织的表达。一抗浓度为1∶100,4 ℃孵育过夜。DAB显色约10 min,苏木精复染和盐酸乙醇分化后脱水、封片。用PBS代替一抗作为阴性对照。由2名病理医生镜检读片,评价表达情况,包括染色强度、细胞定位及阳性率。
结果判读:P4HB阳性信号均定位于癌细胞的胞质,胞质中可见棕黄色或棕褐色颗粒。具体判断标准[4]:根据阳性细胞在全部癌细胞中所占比例以及阳性细胞染色强度判定实验结果;每张芯片随机观察5个高倍镜视野(5×40),根据视野的细胞着色强度分别记分,不着色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。然后随机取5个视野对染色细胞分布进行记分,总染色细胞数<5%为0分,5%~25%为1分,25%~75%为2分,>75%为3分。将细胞染色强度记分与染色细胞数记分的乘积作为每个标本的最后积分,<3为阴性,≥3为阳性(过表达)。
2 结 果
2.1CRC组织与正常黏膜组织双向电泳差异表达蛋白质点的质谱鉴定 通过比对获取的高分辨率和高清晰度的12例24块蛋白电泳图谱,发现40个表达量相差≥2倍的差异表达蛋白质点,进行MALDI-TOF-MS质谱分析后,通过SEQUEST搜索和SWISS PROT数据库检索与比对分析,共鉴定出35个蛋白质,其中17个在癌组织中上调,18个下调。图1为差异表达的蛋白质点P4HB经质谱鉴定获得的肽质量指纹谱。其中,CRC组织表达上调的P4HB平均丰度为正常黏膜2.01倍(P<0.05),作为候选蛋白,故以Western-blot和免疫组织化学法对其在CRC组织中的表达进一步验证和分析。
2.2Western-blot检测P4HB蛋白在CRC中的表达 以β-tubulin的表达作为内对照,12个癌组织P4HB/β-tubulin灰度比为(1.36±0.54),正常黏膜为(0.74±0.35),二者间差别有统计学意义(P<0.05,图2)。
2.3免疫组织化学检测P4HB蛋白在CRC中的表达 构建了3张组织芯片,应用免疫组织化学方法分析,结果显示,P4HB蛋白主要表达于在癌细胞的胞质中,在正常组织中亦可见少许表达(图3)。在150例正常黏膜组织中,P4HB表达阳性率为12.67%(19/150),而在187例CRC样本中,有43.85%(82/187)癌组织细胞质出现阳性反应,62例腺瘤组织中有19.35%(12/62)P4HB表达呈阳性(表1)。两两比较结果显示,P4HB在正常组织、腺瘤与CRC组织中差别均具有显著性(P<0.001)。
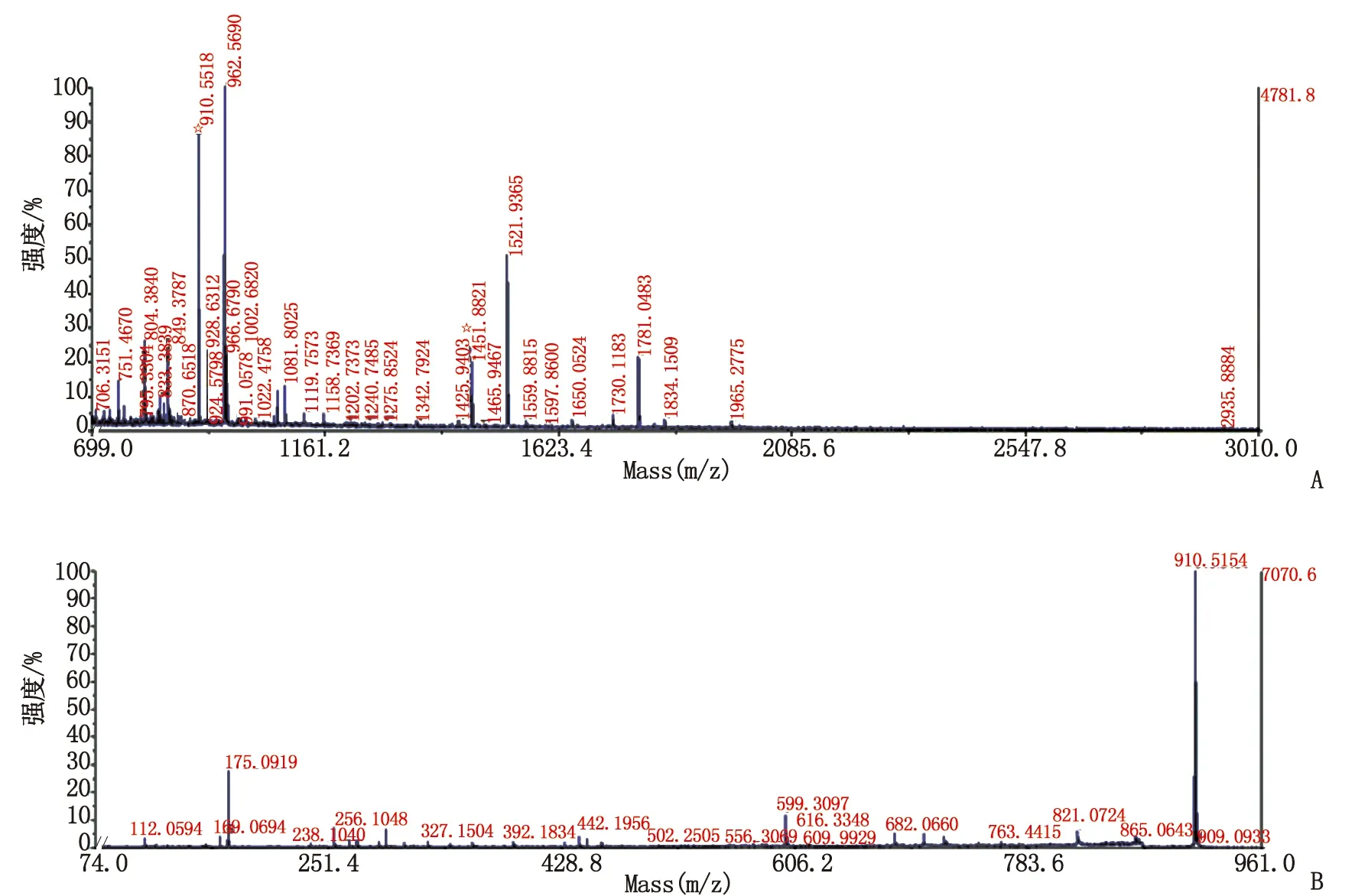
A:P4HB的肽质量指纹谱,肽片段信号与P4HB相符的用星号表示;B:MALDI-TOF MS鉴定的峰值为910.55的肽段序列为SVTEQGAELSNEER,质谱鉴定出的该蛋白质为P4HB的肽片段之一.图1 正常肠黏膜组织和结直肠癌组织差异表达的蛋白质点(P4HB)的MALDI-TOF-MS质谱结果(肽质量指纹谱)Fig 1 MALDI-TOF-MS (peptide mass fingerprint) of protein spots (P4HB) expressed in normal intestinal mucosa and colorectal cancer tissues
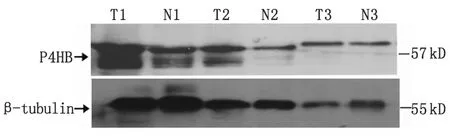
β-tubulin作为内参照;T:癌组织;N:正常黏膜组织.图2 Western-blot方法测定P4HB蛋白在结直肠组织中的表达Fig 2 The expression of P4HB protein in colorectal tissues was detected by Western-blot
表1P4HB在结直肠癌组织、腺瘤和正常肠黏膜中免疫组织化学表达
Tab1PDI immunoreactivity in normal tissue, adenoma, and CRC tissue respectively
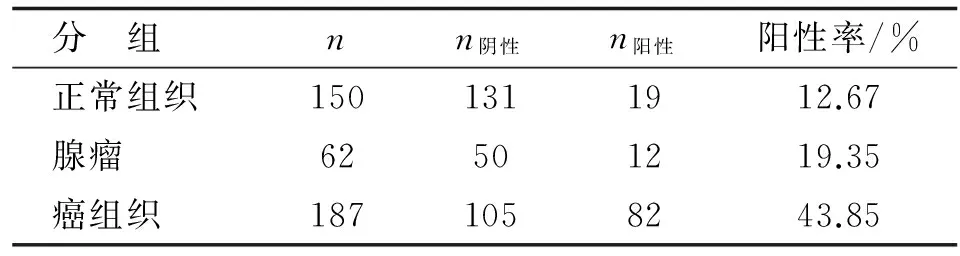
分 组nn阴性n阳性阳性率/%正常组织1501311912.67腺瘤62501219.35癌组织1871058243.85
χ2=45.730,P<0.001.
2.4P4HB蛋白表达与CRC临床病理特征的关系 P4HB在中低分化、肿瘤直径>4 cm及Ⅲ期CRC组织中明显高表达,差别均具有显著性(P<0.05),而未发现不同性别、年龄、病变部位等因素与P4HB蛋白的表达有关(P>0.05,表2)。
2.5P4HB蛋白表达与CRC患者的预后分析 采用Kaplan-Meier方法进行统计分析。随访时间最长为112月,随访期内共有98例死亡,89例存活。Log-rank检验结果显示,在CRC患者中,P4HB表达阳性组与阴性组的生存时间差别无统计学意义(P>0.05,图4)。
3 讨 论
CRC是严重危害人类健康的恶性肿瘤之一。30%~40%患者出现症状时已属于局部进展期或已发生远处转移,无法通过单纯的手术治疗取得痊愈[5]。因此,寻找CRC的早期筛查、诊断以及疗效判定的肿瘤分子标志物已引起了各国科学家的广泛关注。
蛋白质组学可以从整体的角度分析机体内动态变化的蛋白质组成成分、表达水平及修饰状态,了解蛋白质之间的相互作用和联系,揭示蛋白质功能与生命活动的规律。双向凝胶电泳与质谱相结合技术是目前研究复杂蛋白质表达水平改变最直接、有效的方法。本研究中笔者结合MALDI-TOF-MS对筛选出来的差异蛋白质点进行质谱分析,最终从40个蛋白中鉴定出35个差异蛋白质。
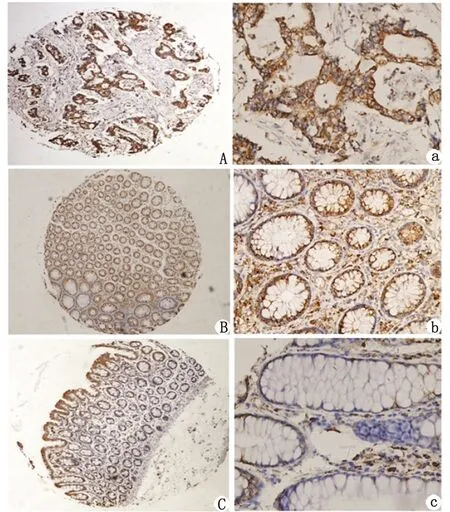
CRC(A-a)、腺瘤(B-b)、正常肠黏膜(C-c);左侧放大倍数×100,右侧放大倍数×200.图3 免疫组织化学方法检测组织芯片中结直肠癌组织、腺瘤和正常肠黏膜P4HB蛋白的表达Fig 3 The expression of P4HB in different tissues using immunohistochemically analysis
Tab2Relationship between the expression of P4HB protein and clinicopathologic features of CRC

临床病理特征nP4HB蛋白表达(-)(+)性别 男11463(55.3)51(44.7) 女7342(57.5)31(42.5)年龄/岁 >609249(53.3)43(46.7) ≤609556(58.9)39(41.1)d肿瘤/cm☆ >411543(37.4)72(62.6) ≤47262(86.1)10(13.9)分化☆ 高分化5136(70.6)15(29.4) 中低分化13669(50.7)67(49.3)位置 结肠7244(61.1)28(38.9) 直肠11561(53.0)54(47.0)TNM分期☆ Ⅰ+Ⅱ10670(66.0)36(34.0) Ⅲ8135(43.2)46(56.8)
表中数据为n(%). 同指标内比较,☆:P<0.05.
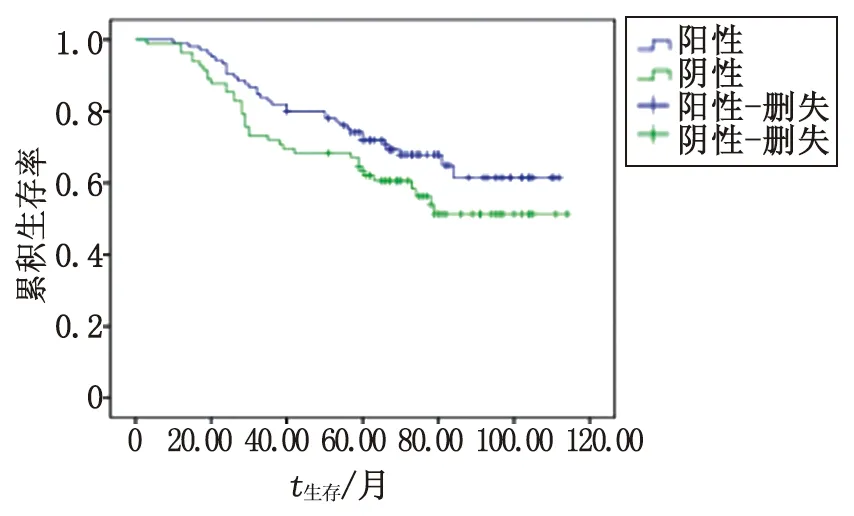
与阴性组的生存时间无显著性差异,P=0.110.图4 不同P4HB表达状态的结直肠患者生存曲线Fig 4 Validationof the expression of P4HB in different tissues using immunohistochemically analysis
P4HB也称为蛋白质二硫键异构酶(protein disulphide isomerase,PDI),由人类染色体17q25上的P4HB基因编码,是一个关键的翻译后修饰的胶原合成酶,参与抗氧化和解毒反应[6-7]。既往多项研究发现,肿瘤细胞中高表达的P4HB与肿瘤进展有关。Chen等研究显示,P4HB异构体在肺腺癌过度表达,可协助清除因肿瘤代谢增加而产生的有毒物质[8];Goplen等发现,P4HB的水平在恶性胶质瘤中上调,转移灶的P4HB表达强度较原发灶升高[9];Bartkowiak等发现,P4HB在乳腺癌肿瘤细胞中的表达明显升高[10];Colas等发现,P4HB在子宫内膜癌组织中的表达倍数高于配对的正常组织[11];Kallen等研究发现,P4HB高表达可导致多形性胶质母细胞瘤对替莫唑胺的耐药,且在复发的多形性胶质母细胞瘤表达较高[12];Yang等发现,P4HB在肺癌组织的表达明显高于癌旁正常肺组织,并且其表达水平与肺癌的分化程度及临床分期密切相关,分化程度越低、临床分期越高,表达水平越高[13];Xia等发现,P4HB在肝癌组织和细胞系中高表达,并且高表达的P4HB水平与更晚期的疾病和较差的生存率相关[14]。Tomonaga等利用琼脂糖双向电泳研究发现,P4HB在结直肠肿瘤中表达上调,进一步免疫印迹验证分析显示,在大部分肿瘤组织样本中只有一个快迁移条带高表达,可能为一个裂解的P4HB片段,而不是异构体;认为针对这种P4HB蛋白质的裂解片段的检测可能有助于大肠癌的早期诊断[15]。
总之,根据双向凝胶电泳结合质谱分析鉴定出P4HB在CRC组织中表达上调,且P4HB表达的上调与CRC更晚的分期、低分化及较大的肿瘤相关,而与CRC的预后无关,说明P4HB在CRC的发生、发展过程中起一定作用。P4HB蛋白有可能为研究CRC癌变过程中的生物学行为提供新的分子标记物。
[1] Weitz J, Koch M, Debus J,etal. Colorectal cancer[J].Lancet, 2005, 365(9454): 153-165.
[2] Siena S, Sartore-Bianchi A, Di Nicolantonio F,etal. Biomarkers predicting clinical outcome of epidermal growth factor receptor-targeted therapy in metastatic colorectal cancer[J].JNatlCancerInst, 2009, 101(19): 1308-1324.
[3] Chen D B, Chen F L, Lu X R,etal. Identification of prohibitin as a potential biomarker for colorectal carcinoma based on proteomics technology[J].IntJOncol, 2010,37(2):355-365.
[4] Wang S M, Lin L Z, Zhou D H,etal. Expression of prolyl 4-hydroxylase beta-polypeptide in non-small cell lung cancer treated with Chinese medicines[J].ChinJIntegrMed, 2015,21(9):689-696.
[5] Penland S K, Goldberg R M. Current strategies in previously untreated advanced colorectal cancer[J].Oncology(WillistonPark), 2004,18(6):715-722, 727; discussion 727-729.
[6] Galligan J J, Petersen D R. The human protein disulfide isomerase gene family[J].HumGenomics, 2012,6(1):6.
[7] Pajunen L, Jones T A, Goddard A,etal. Regional assignment of the human gene coding for a multifunctional polypeptide (P4HB) acting as the beta-subunit of prolyl 4-hydroxylase and the enzyme protein disulfide isomerase to 17q25[J].CytogenetCellGenet, 1991,56(3-4):165-168.
[8] Chen G, Gharib T G, Huang C C,etal. Proteomic analysis of lung adenocarcinoma: identification of a highly expressed set of proteins in tumors[J].ClinCancerRes, 2002,8(7):2298-2305.
[9] Goplen D, Wang J, Enger P O,etal. Protein disulfide isomerase expression is related to the invasive properties of malignant glioma[J].CancerRes, 2006,66(20):9895-9902.
[10] Bartkowiak K, Effenberger K E, Harder S,etal. Discovery of a novel unfolded protein response phenotype of cancer stem/progenitor cells from the bone marrow of breast cancer patients[J].JProteomeRes, 2010,9(6):3158-3168.
[11] Colas E, Perez C, Cabrera S,etal. Molecular markers of endometrial carcinoma detected in uterine aspirates[J].IntJCancer, 2011,129(10):2435-2444.
[12] Kallen A N, Zhou X B, Xu J,etal. The imprinted H19 IncRNA antagonizes let-7 microRNAs[J].MolCell, 2013,52(1):101-112.
[13] Yang X, Shao H, Liu W,etal. Endoplasmic reticulum stress and oxidative stress are involved in ZnO nanoparticle-induced hepatotoxicity[J].ToxicolLett, 2015,234(1):40-49.
[14] Xia W, Zhuang J, Wang G,etal. P4HB promotes HCC tumorigenesis through downregulation of GRP78 and subsequent upregulation of epithelial-to-mesenchymal transition[J].Oncotarget, 2017,8(5): 8512-8521.
[15] Tomonaga T, Matsushita K, Yamaguchi S,etal. Identification of altered protein expression and post-translational modifications in primary colorectal cancer by using agarose two-dimensional gel electrophoresis[J].ClinCancerRes, 2004,10(6):2007-2014.

