大鼠蛛网膜下腔出血后海马区磷酸化细胞外调节蛋白激酶1/2表达与细胞自噬的关系
安朝旺, 刘 瑶, 任艺艺, 李建民, 孙竹梅, 赵雅宁
细胞外调节蛋白激酶1/2(extracellular regulated protein kinases,ERK1/2)是有丝分裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)家族成员之一,活化后经多级激酶的级联反应把细胞外刺激信号向细胞内传递,引起下游转录因子活化,从而调控细胞的存活与死亡。多种中枢神经疾病(如脑卒中、脑创伤、阿尔茨海默病等)的患者脑内均可检测到激活的ERK1/2(即磷酸化ERK1/2),是神经细胞存活的调控靶点之一[1-3]。
自噬是细胞通过溶酶体途径对功能受损的白质和细胞器进行识别、降解和修复的现象,对维持细胞内环境的平衡起到不可忽视的作用,决定了细胞的转归——恢复、修复、损伤、加重或死亡[4]。自噬被证实广泛存在于缺血、缺氧性脑血管疾病中。本课题组前期的研究也发现,蛛网膜下腔出血(subarachnoid hemorrhage, SAH)的病理过程中伴随自噬的发生,提高自噬程度可降低SAH后早期脑损伤(early brain injury, EBI)的神经细胞死亡率,促进神经功能恢复[5]。本研究建立大鼠SAH模型,应用高、低剂量的ERK1/2抑制剂(U0126)进行干预,观察海马区p-ERK1/2、自噬关键因子Beclin-1和微管相关蛋白1轻链3-Ⅱ(microtubule-associated protein 1 light chain 3, LC3-Ⅱ)的表达以及神经细胞的存活情况等,探讨SAH后ERK1/2激活与神经细胞自噬的关系,为SAH后EBI的早期救治提供理论依据。
1 材料与方法
1.1材料 清洁级雄性SD大鼠144只,体质量350~450 g[北京维通利华实验动物技术有限公司,合格证号SCXK(京)2009-003]。p-ERK1/2兔多克隆抗体(美国BD公司);LC3-Ⅱ兔多克隆抗体(日本MBL公司);Beclin-1兔多克隆抗体(美国Affinit公司)。
1.2方法
1.2.1动物模型制作 将120只大鼠分为假手术组(Sham组)、蛛网膜下腔出血组(SAH组)、低剂量U0126组(LU0126组)、高剂量U0126组(HU0126组)。每组又根据造模成功后6,24,72 h分别分为3个亚组。模型制作过程中,SAH组死亡7只,1只模型不符合标准被剔除;LU0126组和HU0126组分别死亡6只,各有2只模型不符合标准被剔除。死亡和剔除大鼠共24只,均依次补齐,最终每组30只大鼠纳入统计学分析。采用经典的自体血二次枕大池注血法(向枕大池注射自体动脉血0.3 mL,2次注血间隔48 h)制备SAH大鼠模型[6]。Sham组向枕大池注入0.3 mL等渗生理盐水2次,余操作均与SAH组一致。LU0126组和HU0126组分别于造模前30 min侧脑室注射U0126(分别为每只5,10 g/L),再制备SAH模型。模型判定标准:(1)第2次枕大池注血时,在穿刺部位可见少量血性脑脊液渗出,说明穿刺针位置准确;(2)剥离脑组织时,肉眼可见脑底基底池部位有显眼的血性液体散在分布,或光镜下见蛛网膜下腔有明显血性液体(图1)。
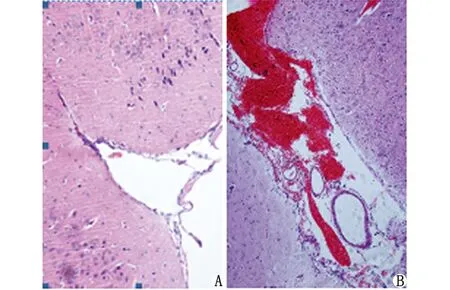
A:Sham组;B:SAH组,蛛网膜下腔有明显血性液体.图1 SAH动物模型的判定(H-E染色 ×200)Fig 1 Determination of SAH animal model(H-E ×200)
1.2.2水迷宫实验测试行为学表现 参照文献[7]的方法进行水迷宫实验。将受试大鼠按顺时针方向依次由第一、二、三、四象限头面向水迷宫桶池壁放入水中,迷宫系统追踪并记录造模成功72 h后的大鼠90 s内找到并成功爬上平台的时间,即逃避潜伏期,以大鼠停留平台10 s以上为记录标准。同时,观察并记录大鼠穿越原平台的次数,即撤去水中隐匿平台后,依次从第一、二、三象限入水点将造模成功72 h后的大鼠面向池壁放入水中,观察并记录大鼠穿越原平台的次数。
1.2.3脑组织海马区形态结构观察 各组于各时间点分别取5只大鼠,常规麻醉后处死;4%多聚甲醛灌注固定后,留取视交叉平面至大脑横裂脑组织。经石蜡包埋、冠状切片(片厚5 μm)后,进行H-E染色。用带有测微尺的光学显微镜(40×10)计数海马区存活神经元的数量,每只动物取5张海马CA1区切片,每张切片选取4个不重复的视野,即每组有100个视野。采用Motic-6.0图像采集及分析系统计算每个视野的存活神经元数(有明显细胞膜、细胞核、核仁为存活神经细胞)。
神经元存活率=存活的神经元数/神经元总数
1.2.4免疫组织化学法和Western-blot检测海马区p-ERK1/2,Beclin-1及LC3-Ⅱ蛋白表达
1.2.4.1免疫组织化学法 标本采集同1.2.3,切片常规脱蜡至去离子水、滴加复合消化液、37 ℃温箱孵育20 min,PBS洗涤3 次,每次5 min;3%过氧化氢封闭内源性过氧化物酶15 min,PBS洗涤3次;滴加兔抗鼠p-ERK1/2,Beclin-1和LC3-Ⅱ多克隆抗体(1∶200,1∶250,1∶250),4 ℃过夜;37 ℃复温45 min,PBS洗涤,滴加生物素化二抗;37 ℃孵育40 min,PBS洗涤,DAB显色,苏木精轻度复染、脱水透明、封片。每张切片在海马CA1区随机选取3~5个视野,光学显微镜(40×10)下观察免疫阳性产物细胞的定位情况。结果判断以胞核呈棕黄色为阳性结果。
1.2.4.2Western-blot法 各组于各时间点分别取5只大鼠,按规定的时间点处死后,快速断头取脑,用冰箱中预冷的器械在冰上分离出双侧海马组织,称量0.6 g,加入裂解液,冰浴中匀浆,4 ℃离心5 min,3 000 r/min。取上清,考马斯亮蓝法蛋白质定量,样品制备,转膜、加入抗体(p-ERK1/2为1∶1 000,Beclin-1和LC3-Ⅱ为1∶1 500,β-actin为1∶2 000)、室温孵育2~3 h,加入二抗、封闭,ECL显色。Bio-Rad系统测定吸光度,以目的条带与内参照β-actin的平均吸光度的比值表示蛋白水平。
各因子的灰度值=目的因子灰度值/内参的平均灰度值
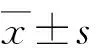
2 结 果
2.1水迷宫检测结果 与Sham组比较,SAH组大鼠在造模成功72 h后的逃避潜伏期明显延长、穿台次数明显减少(P<0.05);与SAH组比较,LU0126和HU0126组大鼠相应时间点的逃避潜伏期明显延长、穿台次数明显减少(P<0.05);与LU0126组比较,HU0126组大鼠相应时间点的逃避潜伏期明显延长、穿台次数明显减少(P<0.05)(表1,图2)。
2.2H-E染色结果 Sham组海马区神经细胞排列整齐、细胞形态结构正常,神经元胞体较大,胞核大而圆,核仁清晰。SAH组于造模成功6 h时海马区可见神经细胞变性水肿,细胞轮廓模糊;24 h时可见死亡神经细胞,表现为细胞出现核溶解、核碎裂或核消失、结构不清,神经元结构松散,呈三角形,细胞核固缩,出现胞核消散征象;72 h时脑组织构造被破坏,核膜碎裂、核仁消散。与Sham组比较,SAH组各时间点神经元存活比率均明显降低(均为P<0.05);LU0126和HU0126组神经细胞形态结构损伤进一步加重,视野中存活神经细胞数量降低,与SAH组比较,各时间点神经元存活比率均明显降低(均为P<0.05);与LU0126组比较,HU0126组各时间点神经细胞存活比率均明显降低(均为P<0.05,表2,图3)。
表1各组大鼠水迷宫潜伏期和穿台次数的比较
Tab1Comparison of the incubation period and the number of times in the water-maze test in rats of each group

分 组t潜伏期/sn穿台次数Sham组21.12±0.1411.67±2.40SAH组60.14±1.34☆7.88±2.08☆LU0126组72.88±8.62★5.95±1.78★HU0126组84.98±1.56★◇3.27±1.52★◇
n=10. Sham:假手术;SAH:蛛网膜下腔出血; LU0126:蛛网膜下腔出血+低剂量ERK1/2抑制剂;HU0126:蛛网膜下腔出血+高剂量ERK1/2抑制剂. 与Sham组比较,☆:P<0.05;与SAH组比较,★:P<0.05;与LU0126组比较,◇:P<0.05.
表2各组大鼠海马CA1区存活神经细胞率比较
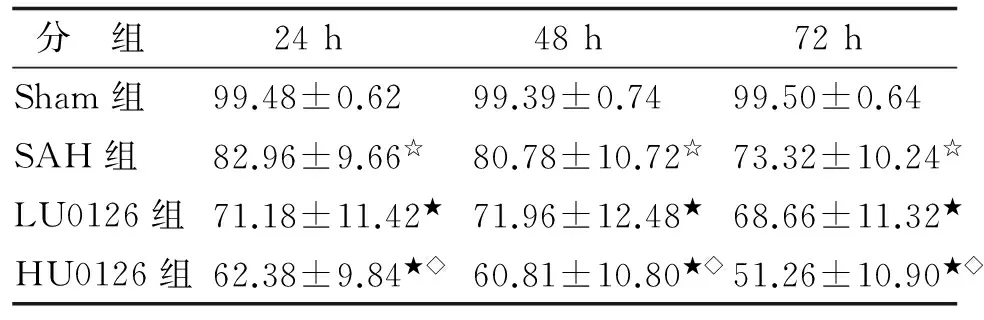
Tab 2 Comparison of neural cell survival rate in hippocampual CA1 region of each group %
n=15. Sham:假手术;SAH:蛛网膜下腔出血;LU0126:蛛网膜下腔出血+低剂量ERK1/2抑制剂;HU0126:蛛网膜下腔出血+高剂量ERK1/2抑制剂. 与Sham组比较,☆:P<0.05;与SAH组比较,★:P<0.05;与LU0126组比较,◇:P<0.05.
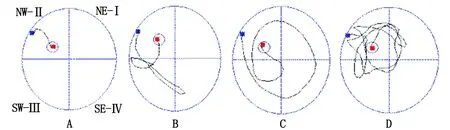
A:Sham组;B:SAH组;C:LU0126组;D:HU0126组.图2 各组大鼠在72 h水迷宫实验的运动轨迹Fig 2 The trajectories of rats in each group in 72 h water maze test
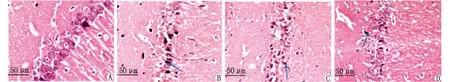
A:Sham组细胞形态结构正常; B:SAH组核膜碎裂、核仁消散; C:LU0126组存活神经细胞减少; D:HU0126组与LU0126组比较,神经细胞存活率降低;箭头指向死亡神经细胞.图3 各组大鼠72 h海马CA1区神经元形态结构变化(H-E ×400)Fig 3 Morphological changes of neurons in hippocampal CA1 region of 72 h rats in each group (H-E ×400)
2.3免疫组织化学染色情况 p-ERK1/2,Beclin-1及LC3-Ⅱ阳性表达主要位于细胞核,阳性细胞的胞核可见细小的棕黄色颗粒(图4)。
2.4Western-blot测定p-ERK1/2、Beclin-1及LC3-Ⅱ的蛋白表达
2.4.1p-ERK1/2的蛋白表达 与Sham组比较,SAH组各时间点p-ERK1/2均明显增加(均为P<0.05);LU0126和HU0126组各时间点p-ERK1/2,Beclin-1及LC3-Ⅱ均明显降低(均为P<0.05);与LU0126组比较,HU0126组各时间点p-ERK1/2均降低(P<0.05,表3,图5)。
2.4.2Beclin-1的蛋白表达 与Sham组比较,SAH组各时间点Beclin-1水平上调(P<0.05);与SAH组比较,LU0126和HU0126组各时间点Beclin-1均持续减少(P<0.05);与LU0126组比较,HU0126组各时间点Beclin-1无明显变化(P>0.05,表3,图5)。
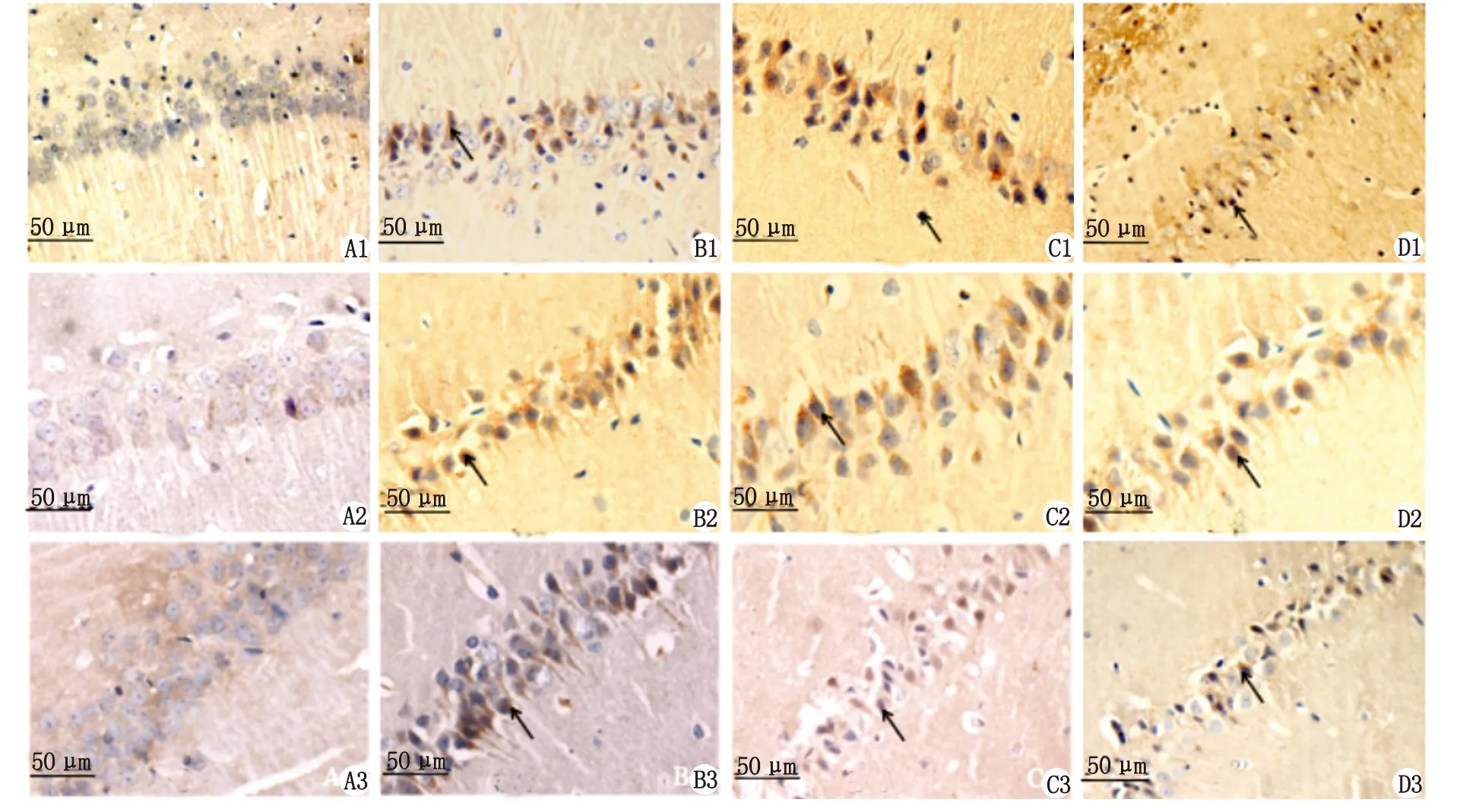
A1~D1:分别为Sham,SAH,LU0126,HU0126组海马区磷酸化ERK1/2的表达;A2~D2:分别为Sham,SAH,LU0126,HU0126组海马区Beclin-1组的表达;A3~D3:分别为Sham,SAH,LU0126,HU0126组海马区LC3-Ⅱ表达. 箭头指向阳性表达细胞.图4 免疫组织化学法检测大鼠海马CA1区磷酸化ERK1/2,Beclin-1和LC3-Ⅱ的表达( ×400)Fig 4 The expressions of phosphorylated ERK1/2, Beclin-1 and LC3-Ⅱ in hippocampus CA1 region were detected by immunohistochemistry( ×400)
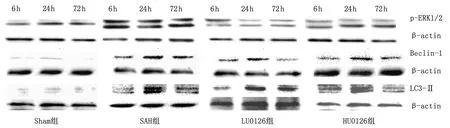
图5 Western-blot分析海马区神经元中p-ERK1/2,Beclin-1和LC3-Ⅱ的表达Fig 5 The expression of p-ERK1/2, Beclin-1 and LC3-Ⅱ in the neuron of hippocampus by Western-blot
2.4.3LC3-Ⅱ的蛋白表达 与Sham组比较,SAH组各时间点LC3-Ⅱ水平上调(P<0.05);与SAH组比较,LU0126和HU0126组各时间点LC3-Ⅱ均持续减少(P<0.05);与LU0126组比较,HU0126组各时间点LC3-Ⅱ无明显变化(P>0.05,表3,图5)。
3 讨 论
ERK1/2信号是连接细胞外信号与膜受体、转录因子和各基因调节的关键信号通路之一,目前在多种神经系统疾病中均证实存在 ERK1/2的活性改变。研究认为,ERK1/2激活可增加神经细胞耐受缺血、缺氧应激损伤的能力,对神经细胞有保护作用[8-9]。例如Zhao等在糖尿病大鼠脑缺血模型中发现,ERK1/2的活性降低伴随DNA依赖蛋白激酶Ku70表达持续减少及神经细胞死亡增多现象[10]。Gatti等研究发现,促黑色素细胞激素对SAH大鼠有保护作用,可减轻血管痉挛,且这种作用与调节ERK1/2的活性有关[11]。本研究中,U0126呈剂量依赖性增加神经细胞死亡率,加重动物学习记忆障碍,说明SAH后ERK1/2的活化对神经细胞具有保护作用。
自噬是真核细胞中产生的一种细胞防御机制,适度自噬激活能够引领细胞结构重建、维持细胞正常生长发育,达到稳定细胞内环境的作用,降低神经细胞死亡的发生,是细胞的第3种死亡方式[12-13]。Lee等在SAH大鼠模型中发现,EBI 阶段会有自噬水平的上调,且在24 h上调最为明显[14]。本实验前期研究也发现,SAH的病理过程中伴随自噬的发生,进一步诱导自噬可减少SAH后EBI的神经细胞凋亡,改善神经功能损伤[15],但SAH后自噬发生的具体机制尚未明确。LC3及Beclin-1是检测自噬必不可少的指标,因此本实验选用LC3-Ⅱ和Beclin-1作为检测自噬水平的指标。本研究结果显示,SAH后加入U0126可导致自噬蛋白分子Beclin-1及LC3-Ⅱ表达显著降低,神经细胞存活率也显著降低,提示 SAH 早期ERK1/2活化可调控自噬的激活。于春艳等发现,氧化应激通过ERK信号途径诱导HeLa细胞发生自噬,被激活的细胞自噬可抑制VK3诱导HeLa细胞凋亡[16]。研究认为,ERK1/2信号激活可通过与雷帕霉素靶蛋白、磷酸化糖原合成酶激酶3β交互作用诱导自噬[17];亦可通过调控Bcl-2家族蛋白表达来调节细胞的自噬发生程度[18]。李冉等在小鼠SAH模型中观察到代谢型谷氨酸受体1选择性拮抗剂可降低海马区Beclin-1及LC3-Ⅱ表达,且这种变化过程中伴随ERK1/2活性的改变,从侧面提示SAH后ERK1/2信号激活与神经细胞自噬有关[19]。本研究结果与此一致,但尚未直接验证ERK1/2信号通路与自噬的关系。U0126是ERK信号通路的特异性阻断剂,可以有效抑制ERK的磷酸化过程,且在加入U0126 24 h左右,抑制ERK信号通路对神经细胞凋亡影响的作用最大[20]。本研究发现,SAH模型大鼠加入不同剂量的U0126可降低Beclin-1及LC3-Ⅱ表达,提示通过ERK1/2的激活调控自噬介导神经元存活,但剂量不同的U0126对自噬影响不大,猜测ERK1/2的浓度对自噬影响不大。因此,笔者认为,SAH后神经细胞自噬可能是ERK1/2信号通路依赖性的。通过调节自噬水平可能是 ERK1/2对SAH后的神经细胞保护机制之一。
表3各组大鼠海马区p-ERK1/2,Beclin-1及LC3-Ⅱ的表达量比较
Tab3Comparison of the expression of p-ERK1/2, Beclin-1 and LC3-Ⅱ in hippocampus CA1 region of rats in each group
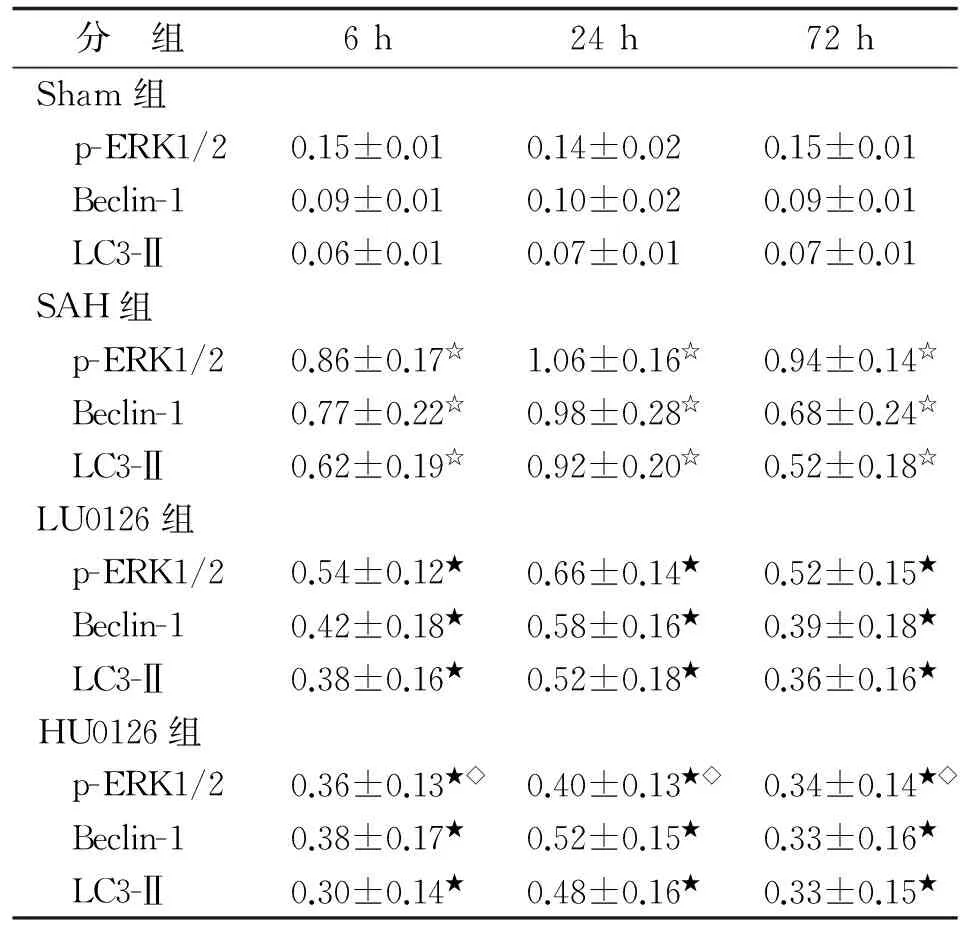
分 组6h24h72hSham组 p-ERK1/20.15±0.010.14±0.020.15±0.01 Beclin-10.09±0.010.10±0.020.09±0.01 LC3-Ⅱ0.06±0.010.07±0.010.07±0.01SAH组 p-ERK1/20.86±0.17☆1.06±0.16☆0.94±0.14☆ Beclin-10.77±0.22☆0.98±0.28☆0.68±0.24☆ LC3-Ⅱ0.62±0.19☆0.92±0.20☆0.52±0.18☆LU0126组 p-ERK1/20.54±0.12★0.66±0.14★0.52±0.15★ Beclin-10.42±0.18★0.58±0.16★0.39±0.18★ LC3-Ⅱ0.38±0.16★0.52±0.18★0.36±0.16★HU0126组 p-ERK1/20.36±0.13★◇0.40±0.13★◇0.34±0.14★◇ Beclin-10.38±0.17★0.52±0.15★0.33±0.16★ LC3-Ⅱ0.30±0.14★0.48±0.16★0.33±0.15★
n=15. Sham:假手术;SAH:蛛网膜下腔出血;LU0126:蛛网膜下腔出血+低剂量ERK1/2抑制剂;HU0126:蛛网膜下腔出血+高剂量ERK1/2抑制剂. 与Sham组比较,☆:P<0.05;与SAH组比较,★:P<0.05;与LU0126组比较,◇:P<0.05.
综上所述,SAH后ERK1/2信号通路的激活可以调控自噬,增加神经细胞的存活率,这为临床上开发更为有效且副作用更少的SAH治疗药物提供一定的理论依据。但ERK1/2信号通路的作用可能涉及其他复杂的分子机制,有待于进一步研究。
[1] Yu X, Guan P P, Guo J W,etal. By suppressing the expression of anterior pharynx-defective-1α and -1β and inhibiting the aggregation of β-amyloid protein, magnesium ions inhibit the cognitive decline of amyloid precursor protein/presenilin 1 transgenic mice[J].FASEBJ, 2015,29(12):5044-5058.
[2] Fu P,Hu Q. 3,4-Dihydroxyphenylethanol alleviates early brain injury by modulating oxidative stress and Akt and nuclear factor-κB pathways in a rat model of subarachnoid hemorrhage[J].ExpTherMed, 2016,11(5):1999-2004.
[3] Li T, Liu H, Xue H,etal. Neuroprotective effects of hydrogen sulfide against early brain injury and secondary cognitive deficits following subarachnoid hemorrhage[J].BrainPathol, 2017,27(1):51-63.
[4] 冯文之, 陈 扬, 俞 立. 细胞自噬分子机制的进展[J]. 生命科学, 2015,27(07):859-866.
[5] 刘俊杰, 李建民, 赵雅宁. PI3K-mTOR信号通路对蛛网膜下腔出血大鼠海马区神经细胞自噬的调控作用[J]. 西安交通大学学报:医学版, 2017,38(2):188-192.
[6] 马朝晖, 李贵福, 罗望池, 等. 改良“二次枕大池注血法”构建Wistar大鼠蛛网膜下腔出血模型[J]. 中国神经精神疾病杂志, 2012,38(3):190-192.
[7] Morris R. Developments of a water-maze procedure for studying spatial learning in the rat[J].JNeurosciMethods, 1984,11(1):47-60.
[8] 朱裕华, 胡安康, 陈仁金, 等. ERK1/2信号通路在IGF-1诱导新生小鼠海马神经干细胞增殖分化中的作用[J]. 神经解剖学杂志, 2013,29(6):609-614.
[9] 周广正, 官亚东, 张 华, 等. 脑缺血损伤后细胞外信号调节蛋白激酶1/2信号通路及胡黄连苷Ⅱ的干预作用[J]. 中国现代医学杂志, 2015,25(27):22-26.
[10] Zhao Y, Li J, Tang Q,etal. Regulation of extracellular signal-regulated kinase 1/2 influences hippocampal neuronal survival in a rat[J].NeuralRegenRes, 2014,9(7):749-756.
[11] Gatti S, Lonati C, Acerbi F,etal. Protective action of NDP-MSH in experimental subarachnoid hemorrhage[J].ExpNeurol, 2012,234(1):230-238.
[12] Liu Y, Levine B. Autosis and autophagic cell death: the dark side of autophagy[J].CellDeath&Differentiation, 2015,22(3):367-76.
[13] Cao J, Xie H, Sun Y,etal. Sevoflurane post-conditioning reduces rat myocardial ischemia reperfusion injury through an increase in NOS and a decrease in phopshorylated NHE1 levels[J].IntJMolMed, 2015,36(6):1529-1537.
[14] Lee J Y, He Y, Sagher O,etal. Activated autophagy pathway in experimental subarachnoid hemorrhage[J].BrainRes, 2009, 128(7):126-135.
[15] 赵雅宁, 赵 旭, 郭向飞. BQ-123通过mTOR-自噬通路对蛛网膜下腔出血大鼠神经细胞凋亡的影响[J]. 郑州大学学报:医学版, 2016,51(6):704-709.
[16] 于春艳, 刘 希, 于春荣, 等. 维生素K3诱导氧化应激经ERK信号途径介导HeLa细胞发生自噬[J]. 吉林大学学报:医学版, 2014,40(2):229-232.
[17] 赵永强, 隽兆东, 管英俊, 等. PI3K与ERK1/2信号传导通路在吡格列酮保护大鼠心肌缺血再灌注损伤中的作用机制[J]. 中国实验诊断学, 2012,16(2):207-210.
[18] 杨 申. P38MAPK抑制剂对血管性痴呆大鼠海马细胞凋亡、Bcl-2、Caspase-3表达及其学习记忆能力的影响[D]. 济南:山东大学, 2013.
[19] 李 冉, 刘 江, 徐爱军, 等. 小鼠蛛网膜下腔出血后海马CA1区mGluR1和ERK1/2的表达变化[J].神经解剖学杂志, 2012,28(1):49-54.
[20] 李琳琳. 水飞蓟宾对脑缺血小鼠神经凋亡和EGFR/ERK信号通路影响的研究[D]. 石家庄:河北医科大学, 2016.

