抗EGFR/CD3双特异性抗体的制备与功能的初步研究
车耀健, 赵宁宁, 胡 妍, 杨丰云, 温振国
近年来,以PD-1/PD-L1抗体为代表的免疫治疗为攻克癌症带来了革命性突破,2个或多个肿瘤免疫靶点药物联合使用是免疫治疗的发展方向。双特异性抗体(bispecific antibody, BsAb)可同时识别并结合2个不同靶点,是肿瘤免疫治疗领域中的一个研发热点[1]。表皮生长因子受体(epidermal growth factor receptor, EGFR)广泛分布于各组织,与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关,其过表达与肿瘤的发生发展、放疗或化疗敏感度以及预后密切相关[2],抗EGFR抗体药物西妥昔单抗(Cetuximab)和尼妥珠单抗(Nimotuzumab)均已上市,用于治疗EGFR+肿瘤。而CD3主要表达于T细胞表面,T细胞与抗CD3抗体(如OKT3[3])结合后能够活化T细胞。EGFR与CD3均为肿瘤免疫重要的分子。本研究尝试通过BsAb的方式将这2种分子的抗体进行关联,从而提高靶向杀伤效果。目前构建BsAb的方法有很多种,如化学偶联、tandem diabody(tandAB)、dual affinityre-targeting(DART)、BiTE、Dock and Lock(DNL)、CrossMAb、knobs-into-holes等[1,4-10]。其中在knobs-into-holes模式中,knob链形成的结构能够特异地插入到hole形成的结构中,从而能够获得异源二聚体的BsAb,同时CD3单链抗体无完整轻链,不会与EGFR抗体的重链错配而失去活性。因此本研究通过knobs-into-holes的方式进行研究,将2个进入临床Ⅱ期研究后中止开发的anti-EGFR抗体(Matuzumab)及anti-CD3单链抗体(HuM291)通过knobs-into-holes的方式组合起来制备BsAb,并通过体外实验初步验证anti-EGFR/CD3抗体的作用。
1 材料与方法
1.1材料
1.1.1细胞和试剂 质粒载体pXC17.4和pXC18.4(瑞士Lonza公司),基因序列由上海生工生物工程有限公司合成。EGFR+的CHO细胞系、Jurkat细胞系(T淋巴瘤细胞系)、U87 Ⅷ(脑胶质瘤细胞系)、HCT-116细胞系(结肠癌细胞系)、Expi 293F悬浮细胞系均由本实验室保存。ExpiFectamine 293 Transfection kit(批号:1870295,美国Thermo Scientific公司),EcoR Ⅰ限制性内切酶(批号:AG50083A,日本Takara公司),Hind Ⅲ限制性内切酶(批号:AG50147A,日本Takara公司),T4 DNA连接酶(批号:1181608,美国NEB生物技术有限公司)。质粒大量提取试剂盒(批号:1502/002,德国Macherey-Nagel公司),10×PBS(批号:13515002)和DMEM(批号:1676986)(美国Corning公司),HiTrap mabselect SuRe 1 mL层析柱(批号:10233639)及superdex 200 increase 10/300分子筛层析柱(批号:10240183)(美国GE Health Care公司),Acqutiy UPLC Protein BEH SEC Column 1.7 μm分子筛分析柱(批号:023370531,美国Waters公司),PE标记的CD3抗体(批号:4285682)及APC标记的CD69抗体(批号:B200047)(美国BD公司)。
1.1.2仪器 CO2细胞培养箱(型号:311,美国Thermo Scientific公司),AKTA蛋白纯化系统(型号:AKTA avant 25,美国GE Health Care公司),凝胶成像系统(型号:ChemiDocTMXDR+,美国Bio-Rad公司),超高效液相色谱仪(UPLC)(型号:Acquity H-class,美国Waters公司),流式细胞仪(型号:FACSVerse,美国BD公司),实时无标记细胞功能分析仪(型号:xCELLigence RTCA DP,美国艾森生物公司)。
1.2方法
1.2.1BsAb EGFR/CD3表达质粒构建 首先在生工生物工程有限公司合成表达anti-EGFR重链和轻链的基因序列,构建成正常的anti-EGFR抗体(图1A),同时合成与FC融合的anti-CD3的单链抗体anti-CD3-scFV的基因序列,构建成anti-CD3-scFV抗体(图1B),其中scFV是将CD3抗体的重链可变区和轻链可变区用linker(4个G4S)连接起来。基因合成后将重链基因连入到pXC17.4载体中,轻链基因连入pXC18.4载体中。而构建BsAb质粒需要knob链和hole链2条链参与,其中knob链是将anti-EGFR重链的第354位氨基酸S突变成C(S354C),以及第366位氨基酸T突变成W(T366W),获得携带anti-EGFR-HC-knob基因的质粒;而hole链则是将anti-CD3-scFV进行如下氨基酸突变:Y349C,T366S,L368A,Y407V[11-12],从而获得携带anti-CD3-scFV-HC-hole基因的质粒,二者同时与携带anti-EGFR-LC基因的质粒共转染,最终构成knobs-into-holes的抗体模式(图1C)。
1.2.2ExpiFectamine 293法转染Expi 293F悬浮细胞 将携带重链和轻链基因的重组质粒按等量的比例转染至Expi 293F悬浮细胞中,具体步骤如下:首先用Opti-MEM培养基稀释45 μg DNA至2.25 mL、稀释ExpiFectamine 293 Reagent至2.25 mL,室温静置5 min,二者混合后静置20 min。将DNA-Reagent复合物加入密度为7.5×107mL-1的细胞中(共38.25 mL),16~18 h后加入225 μL Enhancer 1及2.25 mL Enhancer 2,约72 h后收集细胞上清。
1.2.3抗体纯化及分析 将细胞上清过滤后采用Protein A亲和层析的方法进行初纯:HiTrap mabselect SuRe 1 mL柱子用PBS平衡5个柱体积,20 mmol/L柠檬酸-柠檬酸钠缓冲液(pH=3.5)洗脱,收集第1个抗体峰,收集到的样品再用十分之一体积的1 mol/L的Tris-Hcl缓冲液(pH=9.0)进行中和。超滤管浓缩,再用superdex 200 increase 10/300分子筛进行精细纯化,流动相为PBS,流速为0.75 mL/min,收集主峰位置的样品,得到目的抗体。将3种抗体浓度均定量至1 mg/mL左右,各取15 μL样品分别加入非还原性loading buffer和还原性loading buffer(含巯基乙醇),95 ℃加热5 min,进行SDS-PAGE凝胶电泳分析。采用UPLC系统进行分析,分析柱为Acqutiy UPLC Protein BEH SEC Column,流动相为PBS,流速为0.4 mL/min。
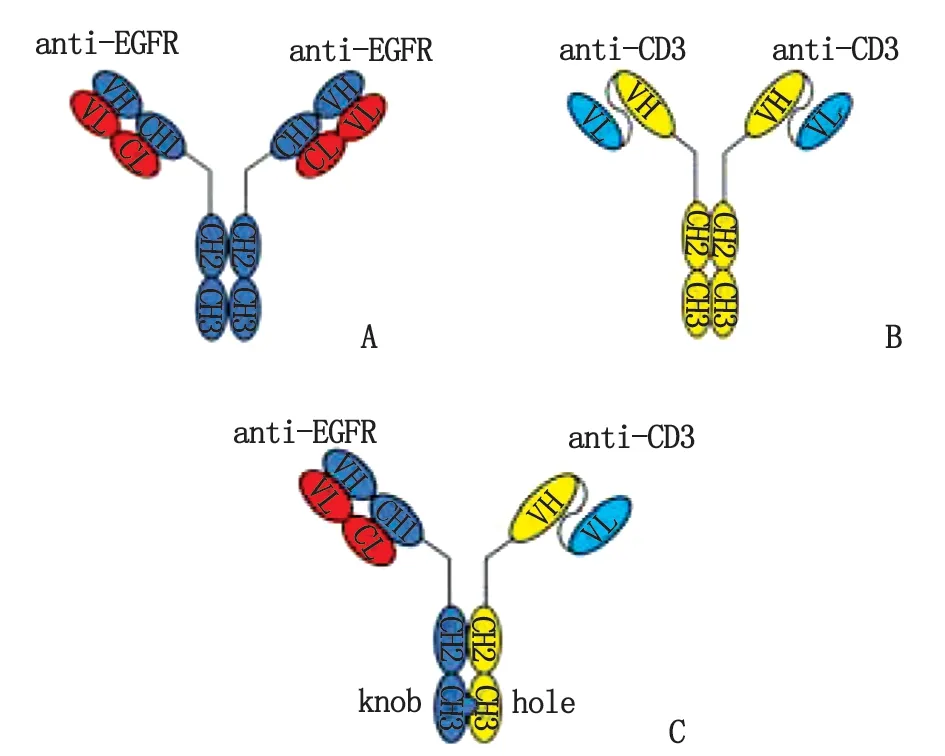
A:anti-EGFR;B:anti-CD3-scFV;C:anti-EGFR/CD3.图1 不同抗体的结构示意图Fig 1 The schematic diagram of the different antibodies
1.2.4BsAb体外结合能力评价 将3种抗体分别与Jurkat细胞系(T淋巴瘤细胞系,CD3+),U87Ⅷ(脑胶质瘤细胞系,EGFR+),HCT-116细胞系(结肠癌细胞系,EGFR+)进行体外结合实验。收集细胞至流式管中,2 000 r/min离心3 min,弃上清;向各流式管中加入2 mL含1%胎牛血清的PBS溶液重悬细胞,以2 000 r/min的速度离心3 min,弃上清;轻轻将管底细胞悬起,向各管加入需要检查的抗体,4 ℃孵育20 min后,加入2 mL含1%胎牛血清的PBS,2 000 r/min离心3 min,弃上清;再加入标记PE的二抗,4 ℃孵育20 min后,加入2 mL含1%胎牛血清的PBS,2 000 r/min离心3 min,弃上清;向各管加入300 μL含1%胎牛血清的PBS,上流式细胞仪检测。
1.2.5T细胞活化 分离3个正常人血液中的外周血单个核细胞(peripheral blood mononuclear cell, PBMC),每份进行3个重复实验,分盘后(每孔1 mL)分别加入20 μm的anti-EGFR、20 μm的anti-CD3-scFV、40 μm的anti-EGFR/CD3抗体,于37 ℃的CO2孵箱中培养24 h,同时用PE标记的CD3抗体和APC标记的CD69抗体染色进行流式细胞检测。
1.2.6体外杀伤实验 采用xCELLigence RTCA DP实时无标记细胞功能分析仪进行检测,实时监测细胞状态,通过细胞指数(cell index)读值反应活细胞的数量,数值越高,活细胞数量越多。已有用此法进行抗体依赖的细胞毒活性等细胞活性方面的检测[13]。具体步骤如下:huPBMC分别分离自3个健康人,加入Human T-Activator CD3/CD28 Dynabeads(磁珠∶细胞=1∶1)刺激活化T细胞,然后接种40 000个HCT-116细胞至仪器专用的细胞培养盘上(每份T细胞进行3孔重复),在第25 小时加入磁珠活化后的T细胞(其中效应细胞∶肿瘤细胞=5∶1)以及抗体(每孔抗体用量分别是:40 μm anti-EGFR/CD3,20 μm anti-EGFR,20 μm anti-CD3-scFV,20 μm anti-EGFR+20 μm anti-CD3-scFV),37 ℃继续培养,每15 min收集1次信号。按以下公式计算细胞毒性T淋巴细胞(cytotoxic lymphocyte, CTL)的杀伤率:
CTL的杀伤率(%)=(对照组读值-实验组读值)/对照组读值×100%
1.3统计学处理 采用GraphPad Prism 5进行统计学分析,采用单因素ANOVA进行显著性检验,2组间均值比较采用独立样本t检验。P<0.05为差别具有统计学意义。
2 结 果
2.1纯化与分析结果 经Protein A纯化后,只收集到1个单一的洗脱峰,中和后浓缩进行分子筛纯化,在上样后12 min左右收集主峰,得到了目的抗体。SDS-PAGE结果显示,BsAb的条带位置(泳道1)居于正常抗体(泳道2)和单链抗体(泳道3)中间(图2A),说明BsAb构成的是异源二聚体;anti-EGFR/CD3二聚体比anti-EGFR正常抗体少1个轻链,因此还原性SDS-PAGE中轻链位置(25 kD左右)泳道2比泳道1条带更粗(图2B),浓度更高,同时anti-CD3-scFV轻链位置没有条带,进一步说明获得的抗体是异源二聚体。
UPLC系统分子筛分析鉴定结果如图3,anti-CD3-scFV,anti-EGFR及anti-EGFR/CD3的保留时间分别为3.169,2.906及3.013 min,其中anti-EGFR/CD3的保留时间刚好居于2个抗体之间,且纯度都>99%,从另一方面证明本实验获得高纯度的异源BsAb。
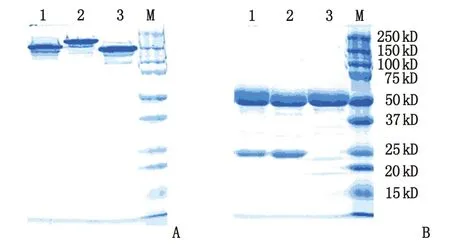
A:非还原性;B:还原性. 1:anti-EGFR/CD3;2:anti-EGFR;3:anti-CD3-scFV;M:蛋白marker.图2 3个抗体的SDS-PAGE考马斯亮蓝染色结果Fig 2 The results of the SDS-PAGE of the three antibodies
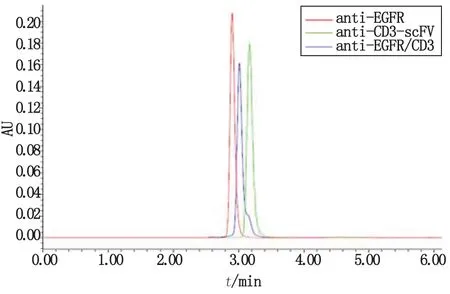
图3 3个抗体的UPLC分子筛分析Fig 3 The SEC results of UPLC
2.2体外结合能力评价 anti-EGFR/CD3能够与EGFR+的U87 Ⅷ细胞系和HCT-116细胞系结合,结合能力与anti-EGFR单克隆抗体相当(图4A)。anti-EGFR/CD3也能够与CD3阳性的Jurkat细胞结合,但相对于单独的anti-CD3-scFV结合能力更弱一些(图4B)。结果表明BsAb能同时识别EGFR和CD3两种抗原。
2.3T细胞活化实验 CD69在细胞活化的过程中起了非常重要的作用,是T细胞活化的一个重要标志物,因此可以通过观察T细胞表面是否表达CD69来判断T细胞是否活化。将分离得到的PBMC分别用抗体刺激,24 h后进行流式细胞检测,结果如图5所示。与对照比较,加入anti-EGFR/CD3后CD69+的T细胞比例(P<0.000 1)以及anti-CD3-scFV刺激后的比例(P<0.000 1)均明显高于不加抗体对照,表明anti-CD3-scFV和anti-EGFR/CD3都能较好地刺激T细胞活化。

A:EGFR+; B:CD3+细胞.图4 体外结合能力比较Fig 4 Comparison of the binding assay in vitro
2.4T细胞体外杀伤能力评价 实时无标记细胞功能分析仪能实时监控活细胞的数量,在不加T细胞和抗体(Mock)或只加抗体不加T细胞的情况下,肿瘤细胞生长曲线呈上升趋势,活细胞数量不断增加,直到平台期才停止(图6A);而在第25小时加入T细胞后,无论有没有加抗体,曲线均往下降,出现了不同程度的细胞死亡,其中BsAb anti-EGFR/CD3下降最为明显。以第25小时作为零点,分别取加入抗体后12和24 h的数据进行统计学分析(图6B),anti-EGFR/CD3在12 h后的杀伤率均明显高于不加抗体的T细胞对照组和其他抗体(均为P<0.000 1)。同样,观察杀伤24 h后的情况,依然是anti-EGFR/CD3杀伤效果最好。
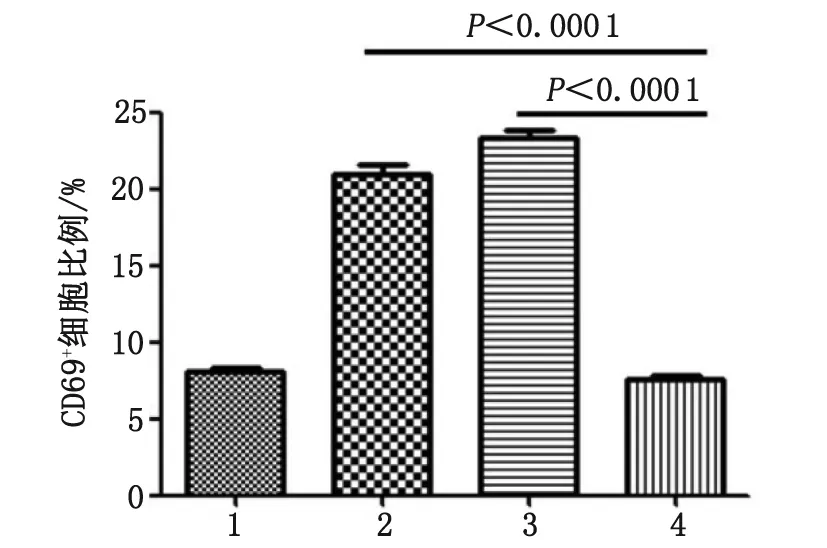
1:anti-EGFR; 2:anti-CD3-scFV; 3:anti-EGFR/CD3; 4:T cell only.图5 抗体对T细胞的活化作用结果Fig 5 Activating effect on T cells of the antibodies

A:无标记细胞功能分析仪细胞实时监测图; B:T细胞杀伤率比较. 1:T cell only;2:anti-EGFR/CD3; 3:anti-CD3-scFV+anti-EGFR; 4:anti-CD3-scFV;5:anti-EGFR. ☆☆☆:P<0.000 1.图6 对肿瘤细胞体外杀伤效果Fig 6 Killing effect on tumor cells in vitro
3 讨 论
当今,免疫治疗技术越发成熟,已经广泛应用于临床,渐渐成为继传统化疗、放疗之后内科治疗肿瘤的又一有力武器。而针对EGFR介导的信号转导途径在肿瘤细胞的增殖、损伤修复、侵袭及新生血管形成等方面起重要作用,许多实体肿瘤中均存在EGFR的高表达或异常表达[14]。因此,以EGFR作为治疗靶点的方案也越来越多,其中以ABX-EGF、IMC-C225(Cetuximab)、MAB528、MAB225,Matuzumab为代表的单抗类药物为肿瘤的治疗提供了新的希望[15-17]。但是,单纯的抗体治疗可能并不能很好地发挥治疗作用,还需要免疫细胞的配合。肿瘤免疫微环境的异质性会影响肿瘤的治疗反应,免疫微环境作为肿瘤微环境有机整体的重要组成部分,其所起的作用越来越受到重视[18]。肿瘤浸润T细胞是免疫微环境的一个重要指标,肿瘤体内杀伤效果不佳,其中一个重要的原因可能就是肿瘤组织内的效应T细胞数量太低或活性太差。因此,治疗过程中需提供适合免疫细胞的肿瘤微环境。本研究利用已完成临床Ⅰ期安全性研究但止步于临床Ⅱ期有效性研究的2个失败的抗体药物Matuzumab和HuM291,通过knobs-into-holes技术获得anti-EGFR/CD3双特异性抗体。在杀伤肿瘤的过程中,加入双特异性抗体的杀伤效果明显高于其他对照组,而单独的抗体或单纯将2种抗体混合到一起,杀伤效果不如BsAb,推测可能是因为BsAb能够同时结合T细胞和肿瘤细胞,起到桥连的作用,能够特异性地将效应细胞与肿瘤细胞的距离拉近,在抗体靶向肿瘤的过程中,能够结合效应细胞,将其带到肿瘤细胞周围并累积,从而起到募集效应细胞的作用。同时CD3抗体能进一步激活效应细胞,提供一个很好的免疫微环境(肿瘤浸润T细胞等)。另外,正常的免疫细胞需要抗原呈递,并形成MHC-抗原复合物结合T细胞受体才能发挥杀伤作用,BsAb能使T细胞直接跳过这一过程,直接与肿瘤细胞接触,杀伤肿瘤细胞,从而达到预期的目的。
本研究采用的是knobs-into-holes的模型,获得的抗体比一般的化学偶联方式更稳定,成本更低。虽然在体外结合能力和杀伤能力方面都有一定的效果,但由于缺乏动物模型,未能评价体内治疗效果。因此,笔者接下来的工作可以尝试构建合适的动物模型,将此BsAb用于小鼠体内实验,观察治疗效果。虽然抗EGFR抗体用于肿瘤治疗已取得了一些可喜的进展,但其效果并不令人满意,且具有各种各样的不良反应。因此,本研究所用的EGFR抗体存在一定局限性。另外,BsAb与CD3的结合能力比anti-CD3-scFV弱,可能是由于异源BsAb中的EGFR抗体部分存在一定的空间位阻,而anti-CD3-scFV是同源二聚体,位阻更小,具有更好的结合能力,从而导致BsAb结合CD3的能力比anti-CD3-scFV更弱。综合来看,anti-EGFR/CD3的结合能力和杀伤效果还有待进一步提高,而筛选效果更好的EGFR和CD3抗体以及尝试不同的肿瘤细胞靶点是接下来研究的方向之一,使获得的双特异性抗体既可很好地将效应细胞募集到肿瘤组织,又可更好地激活效应细胞,提高效应细胞的杀伤效果,从而大大改善治疗效果,为肿瘤的免疫治疗奠定一定的基础。
[1] Franke S R, Baeuerle P A. Targeting T cells to tumor cells using bispecific antibodies[J].CurrOpinChemBiol, 2013,17(3):385-392.
[2] Alan W. Molecules in focus EGF receptor[J].IntJBiochemCellBiol, 1999,31(6): 637-643.
[3] Van Wauwe J P, De Mey J R, Goossens J G. OKT3: a monoclonal anti-human T lymphocyte antibody with potent mitogenic properties[J].JImmunol, 1980,124 (6) :2708-2713.
[4] Ellwanger K, Reusch U, Fucek I,etal. Highly specific and effective targeting of egfrviii-positive tumors with tandab antibodies[J].FrontOncol, 2017,7:100.
[5] Tsai P, Thayer W O, Liu L,etal. CD19×CD3 DART protein mediates human B-cell depletioninvivoin humanized BLT mice[J].MolTherOncolytics, 2016,3:15024.
[6] Wu J, Fu J, Zhang M,etal. Blinatumomab: a bispecific T cell engager (BiTE) antibody against CD19/CD3 for refractory acute lymphoid leukemia[J].JHematolOncol, 2015,8:104.
[7] Rossi D L, Rossi E A, Cardillo T M,etal. A new class of bispecific antibodies to redirect T cells for cancer immunotherapy[J].mAbs, 2014,6(2):381-391.
[8] Klein C, Sustmann C, Thomas M,etal. Progress in overcoming the chain association issue in bispecific heterodimeric IgG antibodies[J].mAbs, 2012,4(6):653-663.
[9] Ridgway J B, Presta L G, Carter P. Knobs-into-holes’engineering of antibody CH3 domains for heavy chain heterodimerization[J].ProteinEng, 1996,9:617-621.
[10] Xu Y, Lee J, Tran C,etal. Production of bispecific antibodies in "knobs-into-holes" using a cell-free expression system[J].mAbs, 2015,7(1):231-242.
[11] Merchant A M, Zhu Z, Yuan J Q,etal. An efficient route to human bispecific IgG[J].NatBiotechnol, 1998,16:677-681.
[12] Spiess C, Merchant M, Huang A,etal. Bispecific antibodies with natural architecture produced by co-culture of bacteria expressing two distinct half-antibodies [J].NatBiotechnol, 2013,31:753-758.
[13] Abdul-Wahid A, Huang E H, Lu H,etal. A focused immune response targeting the homotypic binding domain of the carcinoembryonic antigen blocks the establishment of tumor fociinvivo[J].IntJCancer, 2012,131(12):2839-2851.
[14] Baselga J. Why the epidermal growth factor receptor? The rational forcancer therapy[J].Oncologist, 2002,7(4):2-8.
[15] Herbst R S, Langer C J. Epidermal growth factor receptors as a target for cancer treatment: the emerging role of IMC-C225 in the treatment of lung and head and neck cancer [J].SeminOncol, 2002,29 (1):27-36.
[16] Rusch V, Mendslsohn J, Dmitrovsky E. The epidermal growth factor receptor and its ligind as therapeutic targets in human tumors[J].CytokineGrowthFactorRev, 1996,7(2):133-141.
[17] Schmiedel J, Blaukat A, Li S,etal. Matuzumab binding to EGFR prevents the conformational rearrangement required for dimerization [J].CancerCell, 2008,13(4):365-373.
[18] Junttila M R, de Sauvage F J. Influence of tumour micro-environment heterogeneity on therapeutic response [J].Nature, 2013,501:346-354.

