SFPQ在肝细胞癌组织中的表达及其对BEL-7402细胞增殖、迁移和侵袭能力的影响
庄雄标, 陈淑珍, 黎丰华, 刘献棠, 吴印爱, 王志伟
原发性肝癌(primary liver cancer,PLC)是我国常见的恶性肿瘤,其中85%~90%为肝细胞癌(hepatocellular carcinoma,HCC)[1-2]。虽然目前HCC的治疗方法较多,但5年复发率仍高达75%~100%[3]。研究HCC发生发展的分子机制,寻找新的可用于预测HCC转移复发和靶向治疗的标志物,具有重要意义。
脯氨酸、谷氨酰胺剪接因子(splicing factor proline and glutamine rich, SFPQ),又名多聚嘧啶区结合蛋白(polypyrimidine tract-binding protein,PTB)相关剪接因子(PTB-associated splicing factor,PSF),是果蝇行为/人类剪切(drosophila behavior human splicing,DBHS)蛋白家族的一员,它与剪接调控蛋白PTB一起,参与前体mRNA的剪接过程,并因此得名[4]。然而,SFPQ蛋白的功能不尽于此。研究发现,绝大部分SFPQ蛋白定位于细胞核浆,不与PTB结合,在转录调控、DNA链的解旋和配对中发挥重要作用[5]。同时,SFPQ蛋白参与构成一种目前功能未知的结构Paraspeckles[6-7]。此外,SFPQ还参与了肿瘤细胞生长和转移的调控[8-9]。在增殖期细胞,SFPQ的表达较静止期细胞提高两倍[8]。在前列腺癌组织中,SFPQ蛋白的表达较癌旁组织下调,其低表达与前列腺癌的进展显著相关[10]。而在结直肠癌中,虽然SFPQ参与结直肠癌的生长和转移进程,但与癌旁组织相比,其在癌组织中的表达并无显著改变[11]。
本研究拟通过免疫组织化学染色检测SFPQ蛋白在HCC患者癌与癌旁组织中的表达,并利用Oncolnc数据库分析SFPQ在HCC患者预后判断中的价值。同时通过小干扰RNA技术体外敲低SFPQ在肝癌细胞株BEL-7402中的表达,探讨SFPQ对肝癌细胞增殖、迁移侵袭、EMT等生物学特性的影响及其在HCC发生发展中可能的作用。
1 材料与方法
1.1材料
1.1.1组织标本 组织标本来自2013—2016年笔者医院普通外科行HCC根治性切除术的30名患者,所有患者术前均未接受抗肿瘤治疗。癌组织为距病灶边缘<1 cm的组织,术后经病理学检查证实为HCC;癌旁组织为肿瘤边缘>2 cm的组织。
1.1.2试剂 SFPQ兔多克隆抗体(货号:15585-1-AP,美国 Proteintech 公司);柠檬酸抗原修复液(货号:ZLI-9065,北京中杉金桥公司)、免疫组织化学一步法检测系统(货号:PV-6000,北京中杉金桥公司)、二氨基联苯胺(DAB)显色剂(货号:ZLI-9018,北京中杉金桥公司);RNAiso试剂(货号:9180)、逆转录试剂盒(RR036A)和荧光定量PCR试剂盒(RR420A)(日本Takara公司);Lipofectamine 2000转染试剂(货号:11668-019,美国Invitrogen公司);DMEM培养基(货号:12100046,美国Gibco公司)、胎牛血清(货号:10270160,美国Gibco公司);CCK8细胞增殖检测试剂盒(货号:BB4202,南京贝博公司);Matrigel基质胶(货号:356234,美国Cornirng公司)、Transwell培养板(货号:3415,美国Cornirng公司);结晶紫粉末(C6158,美国 Sigma 公司);E-cadherin,N-cadherin,Vimentin,Snail和GAPDH 兔多克隆抗体(货号:A3044,A3045,A5544,A2666,AC001,美国Abclonal公司);HRP标记山羊抗兔二抗(货号:D110058,上海生工公司)。
1.1.3仪器 LightCycler 480 II System(5015278001型,瑞士Roche公司);Western-blot蛋白检测系统(1645050型,美国Bio-rad公司)。
1.2方法
1.2.1免疫组织化学法检测SFPQ蛋白在肝细胞癌组织中的表达 石蜡标本制作成4 μm厚度切片,常规烤片,二甲苯脱蜡,梯度酒精水化,微波修复10 min,3%过氧化氢阻断内源性过氧化氢酶15 min,4 ℃过夜孵育一抗(1∶200),次日经PBS充分洗涤,孵育二抗30 min,DAB镜下显色,苏木精复染细胞核,氨水返蓝后常规封片。
免疫组织化学结果判断标准:按着色强度将无着色、轻度着色、中度着色及深度着色记为0,1,2和3分;按阳性肝癌细胞占总肝癌细胞比例,将0%,1%~25%,26%~50%,51%~75%%及≥76%记为0,1,2,3及4分;两者的乘积代表组织SFPQ蛋白的表达水平,总分为0~12分[12]。
1.2.2OncoLnc数据库进行在线生存分析 利用OncoLnc数据库(http://www.oncolnc.org/)中的HCC数据集,按照推荐设置(Top33%:Bottom33%)进行不同SFPQ表达水平患者间的生存分析[13]。
1.2.3细胞培养 肝癌细胞BEL-7402使用含10% 胎牛血清DMEM高糖培养基,置于含体积分数为0.05%的CO2、37 ℃饱和湿度环境中进行培养。siRNA转染BEL-7402细胞委托上海吉玛公司设计并合成siRNA序列,分别为:
siRNA-1 sense:GCAAAGGATTCGGATTTAT
antisense:GCAGGATTCGGATTAATAT
siRNA-2 sense:CCTTTCTGTTCGTAATCTT
antisense:CCTCTGTTCGTAATTTCTT
阴性对照 sense:CCAGCAGCAAGAAAGGCAT
antisense:CCAACGAAAGAGGACGCAT
转染前1天将对数生长期的BEL7402细胞按照每孔4×105接种至6孔板,常规培养至融合度达60%~70%,按照Lipofectamine 2000说明书进行siRNA细胞转染,实验设置分为:空白组(Blank),阴性对照组(negative control,NC),siRNA-1组(KD1)及siRNA-2组(KD2)。
1.2.4荧光定量PCR法验证SFPQ低表达细胞模型 细胞转染48 h后,按照RNAiso试剂说明书提取细胞总RNA,以所提取的总RNA为模板按照逆转录试剂盒说明书进行逆转录反应,采用 SYBR Green I 法进行荧光定量PCR反应,反应条件为预变性95 ℃,30 s→变性95 ℃,5 s→退火60 ℃,30 s,变性和退火共45个循环,溶解曲线和降温条件按照说明书进行设置。引物由上海生工公司设计并合成,SFPQ序列为:
forward:5′-TGGCTGAAATTGCCAAAGCC-3′
reverse:5′-GGCGCAAAAGATTTGCCTGA-3′
以GAPDH为内参,序列为:
forward:5′- CTCTGCTCCTCCTGTTCGAC-3′
reverse:5′-GCGCCCAATACGACCAAATC-3′
1.2.5CCK8法检测SFPQ表达敲低后BEL-7402细胞增殖能力的变化 细胞转染24 h后,按每孔1×103接种于96孔板,分别在0,24,48,72,96 h加入10 μL CCK8试剂,37 ℃孵育2 h,选择450 nm波长测定吸光度,绘制生长曲线。
1.2.6Transwell法检测SFPQ表达敲低后BEL-7402细胞迁移和侵袭能力的变化
1.2.6.1细胞迁移实验 细胞转染48 h后,收集并以无血清培养基重悬细胞,按照每孔5×104接种于Transwell 上室,下室加入含10%胎牛血清的培养基,常规培养24 h后,4%多聚甲醛固定细胞20 min,结晶紫染色着色25 min,取出小室,用棉签轻柔拭去小室内侧膜细胞,显微镜下随机选择5个视野进行细胞计数并拍照记录。
1.2.6.2细胞侵袭实验 提前以50 μL 10% Matrigel基质胶包被小室,余方法同上。
1.2.7Western-blot检测SFPQ表达敲低后BEL-7402细胞EMT相关蛋白表达量的变化 细胞转染72 h后,RIPA法提取细胞总蛋白,BCA法测定蛋白浓度,蛋白经变性后,取30 μg进行10% SDS-PAGE 蛋白电泳,常规转膜,5%脱脂牛奶封闭非特异性抗原,加入SFPQ(1∶500),E-Cadherin(1∶1 000),N-Cadherin(1∶1 000),Vimentin(1∶1 000),Snail(1∶1 000)和 GAPDH(1∶2 000)等抗体工作液,置于4 ℃冰箱孵育过夜。次日,PBST洗涤3遍,分别加入辣根过氧化物酶(HRP)标记山羊抗兔二抗(1∶10 000)室温孵育1 h。PBST洗涤3遍后,ECL化学发光法显像并拍照记录。
1.3统计学处理 采用GraphPad Prism 5.0软件进行统计学处理。采用Student’st检验比较癌组织和癌旁组织SFPQ蛋白的染色评分;多组数据比较采用单因素方差分析,组间比较采用Dunnet-t检验;检验水准为P<0.05,采用双侧性检验。
2 结 果
2.1HCC组织 SFPQ蛋白的表达特点 SFPQ蛋白表达主要定位于肝细胞细胞核,表现为细胞核呈棕褐色染色(图1)。根据组织化学染色评分方法,癌组织评分(5.37±0.64)明显高于癌旁组织[(3.27±0.43),P<0.01,图2],说明SFPQ蛋白高表达于HCC组织。
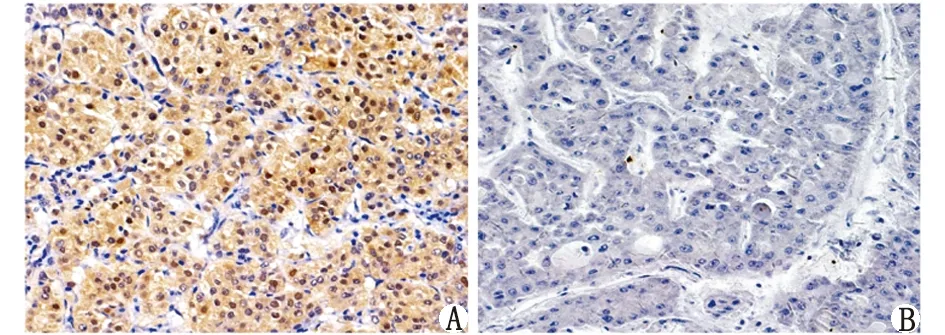
SFPQ:脯氨酸、谷氨酰胺剪接因子. A:评分12分;B:评分0分.图1 SFPQ蛋白在肝细胞癌组织中的表达特点( ×400)Fig 1 Expression of SFPQ protein in HCC tissues( ×400)
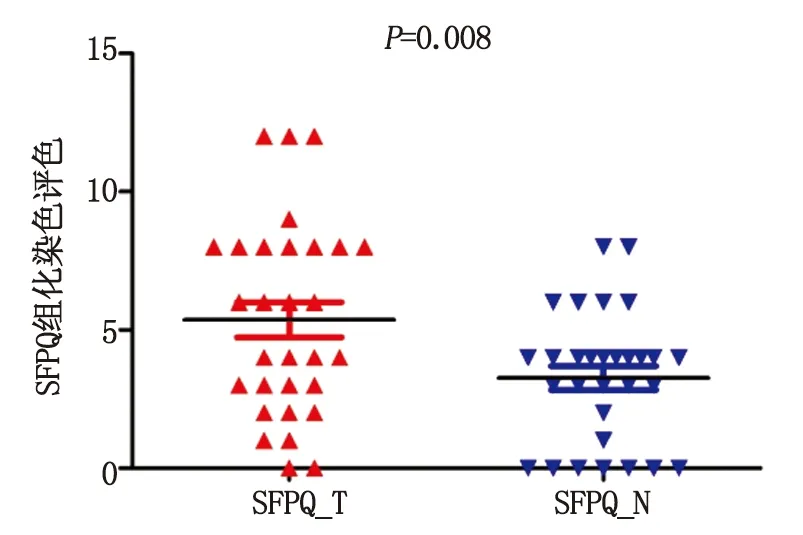
SFPQ:脯氨酸、谷氨酰胺剪接因子.图2 30例肝细胞癌组织和癌旁组织SFPQ蛋白免疫组织化学染色评分Fig 2 IHC score of 30 paires of HCC tissues and adjacent tissues
2.2SFPQ的表达量和HCC患者预后的关系 OncoLnc数据库HCC数据集包含360名患者的总生存数据,在线生存分析表明,SFPQ表达水平与患者预后有显著相关性,SFPQ高表达组(Top33%,n=118)的生存期较低表达组(Bottom33%,n=118)显著缩短(图2,P<0.001),提示SFPQ可能是HCC患者的预后不良因素。

SFPQ:脯氨酸、谷氨酰胺剪接因子.图3 SFPQ表达量和肝细胞癌患者总生存时间的关系Fig 3 Relationship between SFPQ expression and overall survival of HCC patiens
2.3SFPQ-siRNA对BEL-7402细胞中SFPQ表达水平的影响 荧光定量PCR结果显示,与Blank组比较,KD1和KD2组SFPQ mRNA表达水平均呈明显下调(图3A,P<0.05),Western-blot 进一步证实SFPQ蛋白的表达水平也明显下调(图3B),说明两对siRNA序列均有理想的基因敲低作用,SFPQ低表达细胞模型构建成功。
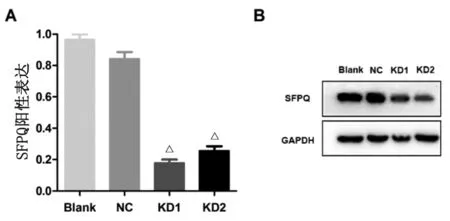
Blank:空白组; NC:阴性对照组; KD1:siRNA1组; KD2:siRNA2组. A:mRNA水平; B:蛋白水平. △:与Blank组比较,P<0.01.图4 siRNA对BEL-7402 细胞中SFPQ表达量的敲低效果Fig 4 Expression of SFPQ in BEL-7402 was knocked down by siRNA
2.4敲低SFPQ表达对BEL-7402细胞增殖能力的影响 生长曲线表明,KD1和KD2组细胞的生长速度均较Blank组明显减慢(P<0.05,图5),提示敲低SFPQ表达抑制BEL-7402细胞的增殖能力。
2.5敲低SFPQ表达对BEL-7402细胞迁移和侵袭能力的影响 细胞迁移实验结果显示,KD1和KD2组穿膜细胞数均较Blank组显著减少(P<0.05),其中KD1组穿膜细胞数为(110.6±10.9),KD2组为(104.0±10.6),NC组为(227.4±26.6),Blank组为(239.2±45.2);侵袭实

Blank:空白组; NC:阴性对照组; KD1:siRNA1组; KD2:siRNA2组. 与Blank组比较,△:P<0.01.图5 敲低SFPQ表达后BEL-7402细胞的生长曲线Fig 5 Growth curve of BEL-7402 cells after knockdown of SFPQ
验结果显示,KD1和KD2组与Blank组相比较,2组发生侵袭的细胞数也明显减少(P<0.05,图6),其中KD1组细胞穿膜细胞数为(99.4±16.3),KD2组为(86.6±9.1),NC组为(235.2±20.0),Blank组为(235.8±16.1),说明敲低SFPQ表达可以同时抑制Bel-7402细胞的迁移和侵袭能力。
2.6敲低SFPQ表达对BEL-7402细胞EMT进程的影响 Western-blot 结果显示,KD1和KD2组上皮细胞标志物E-cadherin表达较Blank组明显升高,而间质细胞标志物N-cadherin和Vimentin及抑制上皮特性的转录因子Snail的表达均较Blank组明显降低(图7),表明敲低SFPQ表达可以逆转Bel-7402细胞的EMT进程。

Blank:空白组; NC:阴性对照组; KD1:siRNA1组; KD2:siRNA2组.图6 敲低SFPQ后BEL-7402细胞迁移和侵袭数量的变化Fig 6 Migrated and invaded BEL-7402 cells after knockdown of SFPQ
3 讨 论
本研究通过免疫组织化学染色法证实,SFPQ蛋白在HCC患者癌组织的表达显著高于其对应的癌旁组织。此外,利用Oncolnc数据库对不同SFPQ mRNA表达水平的患者进行生存分析,发现高表达SFPQ mRNA的患者术后总生存时间更短。体外细胞功能实验发现,敲低SFPQ表达后,肿瘤细胞的增殖、迁移侵袭能力均显著下调,EMT进程受到阻滞,说明SFPQ在HCC中参与了肝癌细胞生长与转移的调控。
OncoLnc数据库包含了TCGA(The Cancer Genome Atlas)数据库的21种癌症、8 647例患者的生存资料和mRNA、miRNA测序数据及MiTranscriptome beta数据库的lncRNA测序数据。通过对基因的表达水平进行分组,可以直接得到不同基因表达水平的患者Kaplan-Meier生存分析结果[13]。数据库共有360名HCC患者的生存资料,按照推荐的设置进行生存分析,每组样本量仍达118例,因此所得的生存分析结果可靠性强,提示SFPQ可能是HCC患者的预后不良因素。
SFPQ众多的结构域赋予了它多种多样的功能,而目前关于SFPQ在肿瘤中表达及功能的研究还很有限。研究发现,SFPQ在前列腺癌中较癌旁组织低表达,且低表达SFPQ与前列腺癌进展显著相关,但预后分析结果显示,不同表达水平的患者术后无瘤生存时间和总生存时间均无显著差异[10]。在结直肠癌组织中,SFPQ的表达较非癌组织无显著改变[11]。而本研究结果显示,SFPQ蛋白在HCC组织中较非癌组织明显上调,并且高表达SFPQ的患者术后预后不良的可能性更高。这与在前列腺癌和结直肠癌中的研究结果截然不同,提示在HCC中,SFPQ可能通过其特有的分子机制影响着HCC的发生发展。
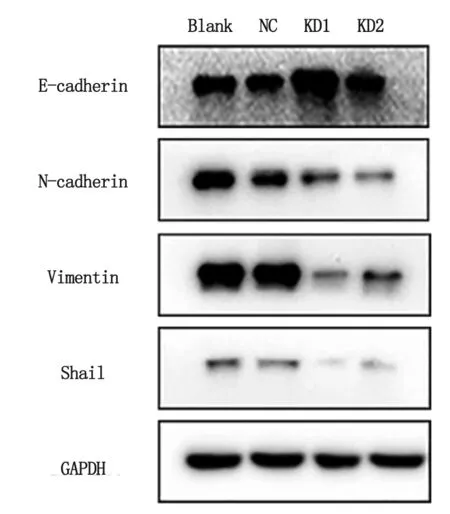
Blank:空白组; NC:阴性对照组; KD1:siRNA1组; KD2:siRNA2组.图7 敲低SFPQ表达后BEL-7402细胞EMT相关蛋白表达量的变化Fig 7 Expression of EMT related proteins in BEL-7402 cells after knockdown of SFPQ
SFPQ蛋白氨基酸序列中存在两个RNA结合结构域(RNA-binding domain, RBD),SFPQ蛋白与RNA结合后,对PTBP2蛋白的调控作用可能受到影响[14-15]。Ji等在结直肠癌中发现,已在多种肿瘤中均被证实与肿瘤进展相关的长链非编码RNA MALAT1可与SFPQ相结合,导致癌基因PTBP2从SFPQ/PTBP2复合物中游离出来,从而促进结直肠癌的进展[11]。此外,还有研究发现,SFPQ可与长链非编码RNA GAPLINC结合,在一定程度上削弱GAPLINC对结直肠癌细胞侵袭的促进作用[16]。EMT是指上皮细胞失去其上皮表型,转变为具有较强迁移和侵袭能力的间质表型细胞的生物学过程[17-19],是肿瘤发生转移复发的关键步骤。EMT在分子水平的重要标志性事件是相关转录因子(如snail1/2,ZEB1/2等)上调,上皮表型E-cadherin表达下调,间质表型N-cadherin和Vimentin表达上调[18]。本研究发现,利用siRNA敲低SFPQ的表达后,HCC细胞株的增殖、迁移侵袭能力均有所下降,EMT进程也受到阻滞,说明不同于结直肠癌,SFPQ在HCC中可能主要作为癌基因发挥作用,其中存在着未知的分子机制,有待进一步探究。
总之,本研究发现,SFPQ在HCC中呈高表达,并且高表达的SFPQ参与调控了HCC的增殖、迁移侵袭以及EMT进程,SFPQ有望成为肝癌患者预后的预测指标。但本研究也存在众多的不足之处,如在免疫组织化学染色阶段纳入的样本量不足,无法分析SFPQ蛋白的表达与患者临床病理参数间的关系;此外,SFPQ通过何种分子机制调控HCC的进展,也需要深入研究。
[1] Chen W,Zheng R,Zeng H,etal. The incidence and mortality of major cancers in China, 2012[J].ChinJCancer,2016,35(1):73.
[2] Lafaro K J,Demirjian A N,Pawlik T M. Epidemiology of hepatocellular carcinoma[J].SurgOncolClinNAm,2015,24(1):1-17.
[3] Tung-Ping P R,Fan S T,Wong J. Risk factors, prevention, and management of postoperative recurrence after resection of hepatocellular carcinoma[J].AnnSurg,2000,232(1):10-24.
[4] Patton J G,Porro E B,Galceran J,etal. Cloning and characterization of PSF, a novel pre-mRNA splicing factor[J].GenesDev,1993,7(3):393-406.
[5] Meissner M,Dechat T,Gerner C,etal. Differential nuclear localization and nuclear matrix association of the splicing factors PSF and PTB[J].JCellBiochem,2000,76(4):559-566.
[6] Fox A H,Lamond A I. Paraspeckles[J].ColdSpringHarbPerspectBiol,2010,2(7):687.
[7] Fox A H,Lam Y W,Leung A K,etal. Paraspeckles: a novel nuclear domain[J].CurrBiol,2002,12(1):13-25.
[8] Shav-Tal Y,Zipori D. PSF and p54(nrb)/NonO--multi-functional nuclear proteins[J].FEBSLett,2002,531(2):109-114.
[9] Yarosh C A,Iacona J R,Lutz C S,etal. PSF: nuclear busy-body or nuclear facilitator[J]?WileyInterdiscipRevRNA,2015,6(4):351-367.
[10] Jiang F N,He H C,Zhang Y Q,etal. An integrative proteomics and interaction network-based classifier for prostate cancer diagnosis[J].PLoSOne,2013,8(5):e63941.
[11] Ji Q,Zhang L,Liu X,etal. Long non-coding RNA MALAT1 promotes tumour growth and metastasis in colorectal cancer through binding to SFPQ and releasing oncogene PTBP2 from SFPQ/PTBP2 complex[J].BrJCancer,2014,111(4):736-748.
[12] Nilsson R,Jain M,Madhusudhan N,etal. Metabolic enzyme expression highlights a key role for MTHFD2 and the mitochondrial folate pathway in cancer[J].NatCommun,2014,5:3128.
[13] Anaya J. OncoLnc: linking TCGA survival data to mRNAs, miRNAs, and lncRNAs[J].PeerJComputerScience,2016,2:67.
[14] Wang G,Cui Y,Zhang G,etal. Regulation of proto-oncogene transcription, cell proliferation, and tumorigenesis in mice by PSF protein and a VL30 noncoding RNA[J].ProcNatlAcadSciUSA,2009,106(39):16794-16798.
[15] Li L,Feng T,Lian Y,etal. Role of human noncoding RNAs in the control of tumorigenesis[J].ProcNatlAcadSciUSA,2009,106(31):12956-12961.
[16] Yang P,Chen T,Xu Z,etal. Long noncoding RNA GAPLINC promotes invasion in colorectal cancer by targeting SNAI2 through binding with PSF and NONO[J].Oncotarget,2016,7(27):42183-42194.
[17] Thiery J P,Acloque H,Huang R Y J,etal. Epithelial-mesenchymal transitions in development and disease[J].Cell,2009,139(5):871-890.
[18] Yilmaz M,Christofori G. Mechanisms of motility in metastasizing cells[J].MolecularCancerResearch,2010,8(5):629-642.
[19] Lamouille S,Xu J,Derynck R. Molecular mechanisms of epithelial-mesenchymal transition[J].NatureReviewsMolecularCellBiologyv,2014,15(3):178-196.

