术前外周血NLR,dNLR及LMR在胶质母细胞瘤患者预后评估中的价值分析
黄金兰, 郑诗豪, 欧启水
胶质瘤是最常见的中枢神经系统肿瘤,占颅内恶性肿瘤的80%以上[1-2]。其中,胶质母细胞瘤(glioblastoma, GBM)是恶性程度最高的胶质瘤。近年来,虽然积极的手术切除联合化疗和放疗在临床中已经得到了广泛应用,但由于GBM极度恶性且呈浸润性生长、易复发,其疗效仍不尽人意。GBM患者的5年生存率不到10%,中位生存时间仅为12~18月。因此,寻找有效的诊断和预后评估标志物,对临床制定个体化的治疗方案、评估GBM患者的预后、延长患者生存时间和改善患者生存质量具有重要意义。
最新研究结果证实,炎症在肿瘤的发生发展过程中发挥着关键作用[3]。外周血中炎症反应主要体现在白细胞数、中性粒细胞数、淋巴细胞数、单核细胞数、炎症因子等发生改变。研究者在此基础上计算得出一些炎症相关指标,包括中性粒细胞/淋巴细胞比值(neutrophil lymphocyte ratio, NLR),间接中性粒细胞/淋巴细胞比值(derived neutrophil lymphocyte ratio, dNLR),淋巴细胞/单核细胞比值(lymphocyte monocyte ratio, LMR)等[4]。文献报道,术前外周血中NLR,dNLR和LMR是影响胃癌、食管癌、肾细胞癌等多种恶性肿瘤预后的独立因素[5-6]。笔者拟评估术前外周血NLR,dNLR和LMR对GBM患者术后总生存率和预后的影响,报道如下。
1 材料与方法
1.1病例资料 收集2012年1月-2017年1月在福建医科大学附属第一医院和福建省立医院神经外科收治的GBM病例进行分析。纳入标准:(1)均行开颅手术,术后病理证实为GBM,且病理资料完整;(2)术前未进行肿瘤特异性的治疗,如放疗和化疗;(3)患者未合并其他肿瘤、其他感染性疾病、血液系统疾病、严重的心脏疾病、严重的肝、肾功能紊乱、高血压和糖尿病等;(4)术前1周内有进行血常规检查,且数据完整。98例GBM患者被纳入本研究。
1.2方法 详细记录患者的年龄、性别、肿瘤位置、肿瘤大小等临床病理参数,收集所有患者在手术前1周内的血常规报告单,包括白细胞计数、中性粒细胞计数、淋巴细胞计数和单核细胞计数绝对值,并计算得出NLR(NLR=中性粒细胞计数绝对值/淋巴细胞计数绝对值)、dNLR(dNLR=(白细胞计数绝对值-中性粒细胞计数绝对值)/淋巴细胞计数绝对值)和LMR(LMR=淋巴细胞计数绝对值/单核细胞计数绝对值)。术后对患者进行随访,3年内每3月随访1次,第4年后每半年随访1次。生存终点为肿瘤相关死亡,随访截至2017年1月1日。
1.3统计学处理 数据采用SPSS 22.0软件进行分析。NLR,dNLR和LMR之间的相关性采用Spearman相关性分析,NLR,dNLR和LMR预测GBM患者生存的最佳分界点则通过受试者工作特征曲线(receiver operating characteristic curve, ROC)计算获得。NLR,dNLR和LMR与患者临床病理参数之间的相关性采用列联表资料的χ2检验进行统计分析。在生存分析中,Kaplan-Meier生存分析用于绘制生存曲线,单因素和多因素Cox回归分析影响GBM患者预后的因素。P<0.05为差别具有统计学意义。
2 结 果
2.1一般资料 本研究共纳入98例GBM患者,其中男性58例,女性40例,年龄中位数53.5岁(5~82岁)。对这98例GBM患者的术前血常规进行分析,白细胞计数、中性粒细胞计数、淋巴细胞计数和单核细胞计数的中位数分别为7.90(3.00~21.90),5.20(1.25~19.10),1.71(0.64~3.69)和0.44(0.14~2.13)×109L-1,NLR,dNLR和LMR的中位数分别为3.12,2.23和3.87。所有患者随访时间3~60月,截止2017年1月1日,98例GBM患者的中位生存时间为12月。
2.2NLR,dNLR与LMR之间的相关性 NLR与dNLR呈高度正相关(P<0.001),r=0.981;NLR与LMR呈明显负相关(相关系数r=-0.630,P<0.001),dNLR与LMR也呈负相关(r=-0.543,P<0.001)(图1)。
2.3ROC曲线分析获得最佳分界点 NLR,dNLR和LMR预测GBM患者生存的ROC曲线如图2所示,NLR,dNLR和LMR曲线下面积(area under curve,AUC)分别为0.741,0.725和0.696,根据约登指数,选取敏感性和特异性之和最大的点作为最佳分界点,由此计算得出NLR,dNLR和LMR最佳的分界点分别为2.42,1.53和3.85(表1)。
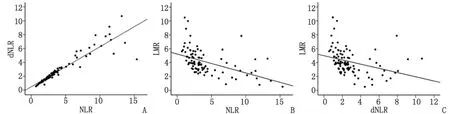
NLR:中性粒细胞/淋巴细胞比值; dNLR: 间接中性粒细胞/淋巴细胞比值; LMR:淋巴细胞/单核细胞比值. A:NLR与dNLR的相关性; B:NLR与LMR的相关性;C:dNLR与LMR的相关性.图1 NLR,dNLR与LMR之间的相关性Fig 1 Correlations between NLR, dNLR and LMR
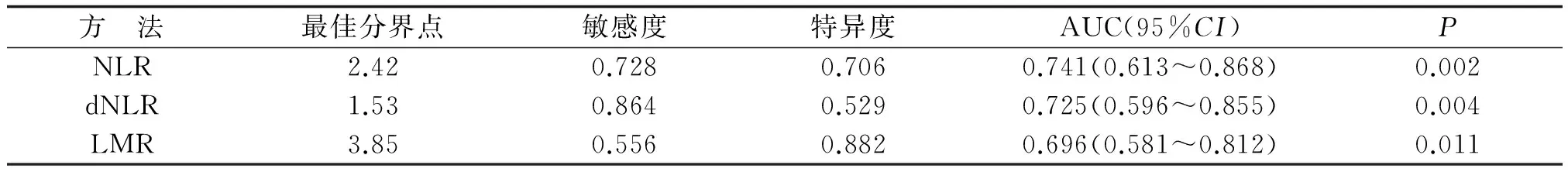
方 法最佳分界点敏感度特异度AUC(95%CI)PNLR2.420.7280.7060.741(0.613~0.868)0.002dNLR1.530.8640.5290.725(0.596~0.855)0.004LMR3.850.5560.8820.696(0.581~0.812)0.011
NLR:中性粒细胞/淋巴细胞比值; dNLR: 间接中性粒细胞/淋巴细胞比值; LMR:淋巴细胞/单核细胞比值; AUC:曲线下面积;CI:可信区间.
2.4术前NLR,dNLR和LMR与临床各病理因素的相关性 NLR以2.42为界,分为NLR≤2.42组和NLR>2.42组;dNLR以1.53为界,分为dNLR≤1.53组和dNLR>1.53组;LMR则以3.85为界,分为LMR<3.85组和LMR≥3.85组。从表2可以看出,NLR,dNLR和LMR与GBM患者的生存时间长短明显相关(P<0.001),而在年龄、性别、肿瘤大小和肿瘤位置上的差别无统计学意义。
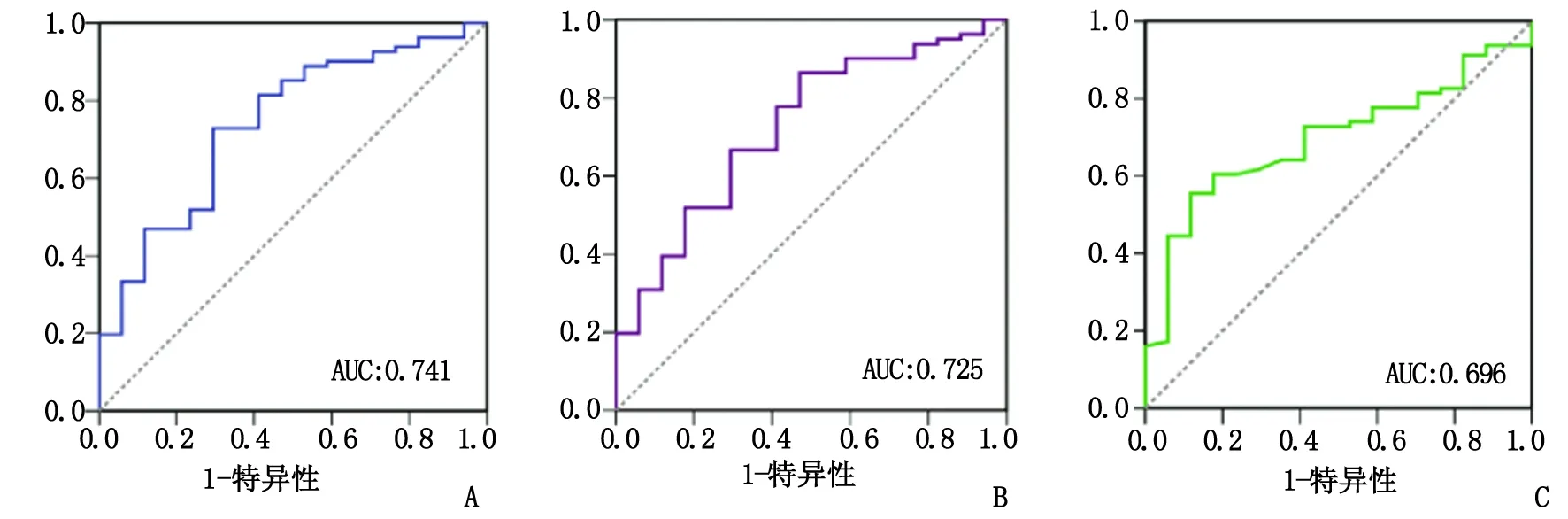
NLR:中性粒细胞/淋巴细胞比值; dNLR: 间接中性粒细胞/淋巴细胞比值; LMR:淋巴细胞/单核细胞比值. A:NLR; B:dNLR; C:LMR.图2 ROC曲线分析NLR,dNLR与LMR预测GBM患者生存Fig 2 ROC curves for NLR, dNLR and LMR

项 目NLRNLR≤2.42NLR>2.42dNLRdNLR≤1.53dNLR>1.53LMRLMR<3.85LMR≥3.85n346420784850性别 男性213714443226 女性13276341624年龄/岁 ≤60224314513431 >6012216271617V肿瘤中位数/cm351.4151.4954.3850.0048.0054.38肿瘤位置 右侧173311392426 左侧14268322020 中线351744t中位生存期/月151117121014.5
NLR:中性粒细胞/淋巴细胞比值;dNLR:间接中性粒细胞/淋巴细胞比值;LMR:淋巴细胞/单核细胞比值.
2.5术前NLR,dNLR和LMR与GBM患者预后的关系 Kaplan-Meier生存分析结果显示,NLR≤2.42组的患者生存时间(中位生存期15月)明显长于NLR>2.42组(中位生存期11月)(P<0.05);dNLR≤1.53的GBM患者,其生存时间(中位生存期17月)要长于dNLR>1.53的患者(中位生存期12月)(P<0.05);LMR<3.85的患者生存时间(中位生存期10月)则要明显短于LMR≥3.85组(中位生存期14.5月)(P<0.05)(图3,表3)。对可能影响GBM患者生存的因素,笔者分别进行了单因素和多因素Cox回归分析(表3)。单因素Cox回归分析结果显示,NLR,dNLR和LMR均为影响患者预后的因素(P<0.001)。NLR或dNLR越高,GBM患者预后越差,LMR值越高,GBM患者预后越好。将上述可能影响GBM患者预后的因素进行多因素Cox回归分析,结果显示,NLR和LMR是影响GBM患者预后的独立因素(P<0.05),且NLR(相对危险度HR=1.672)对GBM患者术后生存时间的预测效果要优于LMR(HR=0.768)。
3 讨 论
GBM是恶性程度最高的星形细胞瘤,其恶性程度高,生长快,病程短,自出现症状至就诊多在3月以内。目前,组织病理学检查是诊断GBM的金标准,CT和MRI则是GBM诊断、疗效监测和预后评估的重要辅助检查手段。然而组织病理学检查为有创检查,无法避免脑组织损伤,而CT和MRI检查价格较昂贵,限制了其在人群中广泛应用[7]。血循环标志物具有无创、标本易获得且花费少的优点,但遗憾的是,由于血脑屏障,GBM不同于其他类型的肿瘤。目前,临床上尚无有效的血循环标志物用于GBM的诊断、疗效监测和预后评估[8]。因此,寻找无创、价格低廉且敏感性和特异性均较高的循环标志物对提高GBM患者生存质量具有重要的意义。

NLR:中性粒细胞/淋巴细胞比值;dNLR:间接中性粒细胞/淋巴细胞比值;LMR:淋巴细胞/单核细胞比值. A:NLR; B:dNLR; C:LMR.图3 Kaplan-Meier生存分析比较不同NLR,dNLR和LMR组之间的生存时间Fig 3 Kaplan-Meier plot of overall survival from 98 GBM patients stratified by NLR,dNLR and LMR respectively

变 量单因素分析PHR95%CI多因素分析PHR95%CI性别0.1490.7160.455~1.127---年龄0.5291.0050.990~1.019---肿瘤大小0.5420.9990.995~1.002---肿瘤位置0.4130.8550.588~1.244---NLR<0.0011.6621.487~1.859<0.0011.6721.265~2.209dNLR<0.0011.7231.513~1.9630.6110.9500.649~1.391LMR<0.0010.6010.498~0.7260.0060.7680.636~0.927
HR: 相对危险度;CI: 可信区间;NLR:中性粒细胞/淋巴细胞比值; dNLR: 间接中性粒细胞/淋巴细胞比值;LMR:淋巴细胞/单核细胞比值.
研究发现,GBM的发生发展与慢性炎症密切相关[9]。在肿瘤微环境中,浸润的炎症相关免疫细胞数量和类型发生改变,可引起DNA氧化损伤和修复异常,造成基因层面或表观遗传学层面的改变,最终可促进胶质瘤的生长、血管生成和侵袭转移。基于此,本研究以炎症标志物指标NLR,dNLR和LMR作为研究对象,通过ROC曲线、Kaplan-Meier生存分析和Cox回归分析,发现NLR,dNLR和LMR均为影响GBM患者预后的因素。
在之前的研究中,NLR被报道可作为评估食管癌、胃癌、结直肠癌等肿瘤预后的因子[4,10-11]。研究者发现,高级别胶质瘤患者术前NLR要明显高于低级别胶质瘤,并且高NLR可作为GBM患者的独立预后因素[12-15]。NLR是机体免疫状态的一个重要指标,中性粒细胞含量升高或淋巴细胞数减少均可引起NLR升高。中性粒细胞和淋巴细胞是机体免疫系统和肿瘤微环境的重要组成成分[16]。中性粒细胞浸润可增加GBM肿瘤细胞的增殖和迁移能力[17],而淋巴细胞减少则会引起机体细胞免疫功能下降,减弱其对肿瘤细胞的杀伤效果[18]。因此,高NLR往往提示GBM患者预后不良。
本研究还发现,dNLR也是影响GBM患者预后的因素。dNLR被报道可预测胃癌患者的总生存率,高dNLR的患者,其预后要比低dNLR患者差[4]。本研究中,单因素Cox回归分析显示,dNLR为影响GBM预后的因素,dNLR越高,GBM患者的预后越差。但由于dNLR与NLR高度相关,相关系数高达0.981,在多因素Cox回归模型中,NLR对生存的预测效果要优于dNLR,因此与NLR相比,dNLR无法作为预测GBM患者生存的独立预后因素。
此外,本研究发现,LMR可作为影响GBM患者预后的独立因素。最新研究发现,LMR与食管癌的pT分期、胃癌的TNM分期以及肾细胞癌的Fuhrman分级相关,并且可作为影响尿路上皮癌、肾细胞癌和软组织肉瘤预后的独立因素[6]。本研究发现,LMR与NLR和dNLR呈负相关,并且LMR<3.85提示GBM患者预后不良,其生存时间明显短于LMR≥3.85的患者。单因素和多因素Cox回归模型最终表明,LMR也为影响GBM患者的独立预后因素,LMR值越高,GBM患者的预后越好。LMR的下降可由淋巴细胞数减少或单核细胞数增多引起。研究发现,在胶质瘤患者体内,血循环单核细胞主要发挥免疫抑制功能[19]。在组织中,M2型肿瘤相关巨噬细胞可促进肿瘤的生长、转移、神经-血管生成和基质重塑,也可抑制细胞凋亡,甚至抑制机体的抗肿瘤免疫反应[20]。故LMR越低,GBM患者往往预后不良。本研究中,多因素Cox回归分析显示,LMR预测GBM患者生存的相对危险度要远低于NLR,说明NLR的预测效果要优于LMR。
术前NLR,dNLR和LMR由血常规检测中的基础数据计算获得。目前在各级医院中,血常规已为术前常规检查,标本易获得且检测价格低廉,其作为GBM患者预后评估指标具有很大的优势和良好的应用前景。术前高NLR和dNLR及低LMR体现了患者全身炎症反应处于高水平,最终患者预后不良。那么若临床能有效控制炎症反应,是否可改善GBM患者的生存?这也为临床治疗GBM提供了新思路。但由于本研究样本量有限(98例),且样本多局限于福建省,本研究尚不能对NLR,dNLR和LMR的预后评估作用下定论。后续,本研究将联合多省多家单位扩大样本量进一步研究。其次,其他炎症相关疾病如感染等也会引起NLR,dNLR和LMR发生改变,对NLR,dNLR和LMR的预后评估作用可能有一定的影响。
[1] Bush N A, Chang S M, Berger M S. Current and future strategies for treatment of glioma[J].EurosurgRev,2017,40(1):1-14.
[2] 陈 靖,石松生,张国良,等. ARHI基因mRNA和蛋白表达水平与胶质瘤恶性度相关性探讨[J]. 福建医科大学学报,2013,47(5):279-283.
[3] Baniyash M, Sade-Feldman M, Kanterman J. Chronic inflammation and cancer: suppressing the suppressors[J].CancerImmunolImmunother,2014,63(1):11-20.
[4] Deng Q, He B, Liu X,etal. Prognostic value of pre-operative inflammatory response biomarkers in gastric cancer patients and the construction of a predictive model[J].JTranslMed,2015,13:66.
[5] Hu H, Yao X, Xie X,etal. Prognostic value of preoperative NLR, dNLR, PLR and CRP in surgical renal cell carcinoma patients[J].WorldJUrol,2017,35(2):261-270.
[6] Gu L, Li H, Chen L,etal. Prognostic role of lymphocyte to monocyte ratio for patients with cancer: evidence from a systematic review and meta-analysis[J].Oncotarget,2016,7(22):31926-31942.
[7] Yue X, Lan F, Hu M,etal. Downregulation of serum microRNA-205 as a potential diagnostic and prognostic biomarker for human glioma[J].JNeurosurg,2016,124(1):122-128.
[8] Kros J M, Mustafa D M, Dekker L J,etal. Circulating glioma biomarkers[J].NeuroOncol,2015,17(3):343-360.
[9] Sowers J L, Johnson K M, Conrad C,etal. The role of inflammation in brain cancer[J].AdvExpMedBiol,2014,816:75-105.
[10] Liu J S, Huang Y, Yang X,etal. A nomogram to predict prognostic values of various inflammatory biomarkers in patients with esophageal squamous cell carcinoma[J].AmJCancerRes,2015,5(7):2180-2189.
[11] Li Y, Jia H, Yu W,etal. Nomograms for predicting prognostic value of inflammatory biomarkers in colorectal cancer patients after radical resection[J].IntJCancer,2016,139(1):220-231.
[12] Han S, Liu Y, Li Q,etal. Pre-treatment neutrophil-to-lymphocyte ratio is associated with neutrophil and T-cell infiltration and predicts clinical outcome in patients with glioblastoma[J].BMCCancer,2015,15:617.
[13] Zadora P, Dabrowski W, Czarko K,etal. Preoperative neutrophil-lymphocyte count ratio helps predict the grade of glial tumor-a pilot study[J].NeurolNeurochirPol,2015,49(1):41-44.
[14] Bambury R M, Teo M Y, Power D G,etal. The association of pre-treatment neutrophil to lymphocyte ratio with overall survival in patients with glioblastoma multiforme[J].JNeurooncol,2013,114(1):149-154.
[15] 张 伟. 术前中性粒细胞/淋巴细胞比值(NLR)和预后营养指数(PNI)对胶质瘤患者预后的影响[D]. 济南:山东大学医学院临床医学(肿瘤学), 2016.
[16] Nicolas-Avila J A, Adrover J M, Hidalgo A. Neutrophils in homeostasis, immunity, and cancer[J].Immunity,2017,46(1):15-28.
[17] Liang J, Piao Y, Holmes L,etal. Neutrophils promote the malignant glioma phenotype through S100A4[J].ClinCancerRes,2014,20(1):187-198.
[18] Dimeloe S, Burgener A V, Grahlert J,etal. T-cell metabolism governing activation, proliferation and differentiation; a modular view[J].Immunology,2017,150(1):35-44.
[19] Parney I F. Basic concepts in glioma immunology[J].AdvExpMedBiol,2012,746:42-52.
[20] Wei J, Gabrusiewicz K, Heimberger A. The controversial role of microglia in malignant gliomas[J].ClinDevImmunol,2013,2013:285246.

