姜黄素对百草枯中毒大鼠急性肾氧化损伤的干预作用
郑丹,韩文文,洪广亮,赵光举,李萌芳,蔡晓霞,吴斌,卢中秋
(1.温州医科大学附属台州医院 重症医学科,浙江 台州 317000;2.宁波市医疗中心李惠利医院急诊科,浙江 宁波 315000;3.温州医科大学附属第一医院 急诊医学中心,浙江 温州 325015)
·论著·
姜黄素对百草枯中毒大鼠急性肾氧化损伤的干预作用
郑丹1,韩文文2,洪广亮3,赵光举3,李萌芳3,蔡晓霞3,吴斌3,卢中秋3
(1.温州医科大学附属台州医院重症医学科,浙江台州317000;2.宁波市医疗中心李惠利医院急诊科,浙江宁波315000;3.温州医科大学附属第一医院急诊医学中心,浙江温州325015)
目的:探讨姜黄素对百草枯(PQ)中毒大鼠急性肾氧化损伤的干预和可能机制。方法:将60只SD大鼠随机分为正常对照组15只、姜黄素对照组(姜黄素50 mg/kg)15只、PQ染毒组(PQ 100 mg/kg)15只、姜黄素干预组(PQ染毒后15 min、24 h、48 h,腹腔注射姜黄素50 mg/kg)15只。大鼠经处理后第1、第3、第7天取肾组织,化学比色法检测肾组织匀浆液丙二醛(MDA)和谷胱甘肽(GSH)含量,超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力;ELISA法检测血红素氧合酶-l(HO-1)、诱导型一氧化氮合酶(iNOS)活力;RT-PCR法检测核转录相关因子2(Nrf2)mRNA表达,Western Blot法检测Nrf2蛋白表达。光学显微镜下观察肾组织的病理变化。结果:与正常对照组比较,PQ染毒组和姜黄素干预组各时间点MDA含量均升高,GSH、SOD、CAT活力均降低,iNOS活力升高,Nrf2 mRNA和蛋白表达均升高,第1、第3天HO-l活力升高,差异均有统计学意义(均P<0.05);与同时间点PQ染毒组比较,姜黄素干预组各时间点MDA含量明显降低,GSH、SOD、CAT明显升高,iNOS活力下降,Nrf2 mRNA和蛋白表达明显升高,第1、第3天HO-1活力升高(P<0.05);PQ染毒组肾小球球囊间隙增大,排列紊乱,随时间延长,肾小管上皮细胞出现玻璃样变性及空泡样变性,姜黄素干预组病理表现较PQ染毒组明显减轻。结论:姜黄素对PQ中毒大鼠急性肾氧化损伤有保护作用,其机制可能是通过诱导肾组织Nrf2表达,上调HO-1、SOD等抗氧化酶水平,提高肾组织抗氧化应激能力。
百草枯;肾损伤;核转录相关因子2;姜黄素;氧化应激
百草枯(paraqual,PQ)是一种广谱有机杂环类除草剂。PQ中毒后对人体毒性较强,急性中毒后可引起肺、肾、肝等各脏器功能损害的表现,并且以肺、肾损害最明显[1]。肾脏是PQ中毒的主要排泄器官,肾脏损伤加重PQ在体内的蓄积。深入研究PQ中毒大鼠急性肾损伤的机制及其干预措施,对降低病死率有积极的意义。姜黄素有抗氧化、清除氧自由基、抗炎等作用。本研究通过建立PQ中毒大鼠急性肾损伤模型,观察姜黄素干预后中毒大鼠肾组织核转录相关因子2(Nrf2)的表达,观察氧化及抗氧化指标的变化。探讨姜黄素对PQ中毒大鼠急性肾氧化损伤的影响和机制。
1 材料和方法
1.1实验动物 健康清洁级SD大鼠60只,雄性,体质量220~250 g,2~3月龄,由温州医科大学动物实验中心提供,实验动物使用许可证号(SCXK(浙)2010-0044)。该动物实验经过温州医科大学动物伦理委员会批准。
1.2实验试剂 20% PQ水溶液由南通先正达作物保护有限公司提供;姜黄素由美国Sigma公司提供;氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活力测定试剂盒、谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)含量测定试剂盒均由南京建成生物工程研究所提供;RNA提取试剂盒由美国Invitrogen公司提供;PCR试剂盒由北京天根生化科技有限公司提供;核蛋白提取试剂盒由美国Pierce公司提供;Nrf2抗体由英国Abcam公司提供;血红素氧合酶-l(heme oxygenase-l,HO-1)、诱导型一氧化氮合酶(induced nitric oxide synthase,iNOS)的ELISA试剂盒由上海西塘生物科技有限公司提供。
1.3分组与处理 将60只SD大鼠随机分为正常对
照组、姜黄素对照组、PQ染毒组、姜黄素干预组,每组15只。PQ染毒组:100 mg/kg PQ一次性灌胃染毒(20% PQ溶液用0.9%氯化钠溶液稀释为2%的PQ溶液);姜黄素干预组:在PQ染毒组处理后15 min、24 h、48 h 3个时间点分别腹腔注射姜黄素50 mg/kg;正常对照组及姜黄素对照组均给予等量0.9%氯化钠溶液灌胃,姜黄素对照组在15 min、24 h、48 h后给予姜黄素50 mg/kg腹腔注射,正常对照组给予等量0.9%氯化钠溶液腹腔注射。上述处理后第1、第3、第7天各组随机选取5只大鼠,10%水合氯醛麻醉处死,取肾脏组织,PBS冲洗,分装后立即放入液氮并及时置于-80 ℃冰箱冻存。
1.4指标检测
1.4.1肾组织中MDA、GSH含量和SOD、CAT活力测定:制备10%肾组织匀浆液,BCA法测蛋白浓度,用化学比色法测肾组织匀浆液中SOD、CAT活力和MDA、GSH含量。
1.4.2肾组织中HO-1和iNOS活力检测:制备10%肾组织匀浆液,BCA法测蛋白浓度,设标准管、空白管、待测样品管,在反应板的每孔内进行加样,3次洗板,最后在反应板每孔中加入100 μL终止液后混匀,用酶标仪在波长450 nm处检测吸光值。最后得出肾组织匀浆液HO-1、iNOS含量。
1.4.3肾组织中Nrf2 mRNA测定及蛋白表达的检测:提取肾组织总RNA,进行RT-PCR。PCR产物用1.5%琼脂糖凝胶检测,用Quanty one软件进行灰度值分析,以目的基因/β-actin蛋白灰度表示目的基因相对表达量。提取肾组织细胞核蛋白,BCA法测蛋白浓度,用Western Blot法检测Nrf2蛋白表达。用Quanty one软件进行灰度值分析,以Nrf2/β-actin蛋白灰度的比值进行统计学分析。
1.4.4肾组织病理观察:对4%多聚甲醛固定液中保存的肾组织进行脱水和包埋,切片,HE染色,光学显微镜下观察肾组织病理变化。
1.5统计学处理方法 采用SPSS19.0统计学软件进行数据分析。实验数据用表示,多组间数据比较采用单因素方差分析,两两比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果
测定 与正常对照组比,PQ染毒组和姜黄素干预组在各自处理后的第1、第3、第7天MDA明显升高,GSH含量、SOD、CAT活力明显下降(P<0.05);与同时间点的PQ染毒组比,姜黄素干预组MDA含量下降,GSH含量和SOD、CAT活力均升高(均P<0.05)。见表1。
2.1肾组织匀浆中MDA、GSH含量和SOD、CAT活力
表1 各时间点各组大鼠肾组织匀浆中MDA、GSH、SOD、CAT值的变化(n=5,±s)

表1 各时间点各组大鼠肾组织匀浆中MDA、GSH、SOD、CAT值的变化(n=5,±s)
与正常对照组比:aP<0.05;与PQ染毒组比:bP<0.05
组别 MDA(nmol/mg) GSH(µmol/g) SOD(U/mg) CAT(U/mg)正常对照组第1天 0.48±0.01ab2.89±0.08ab112.96±1.57ab16.68±0.43ab第3天 0.48±0.01ab2.46±0.02ab113.41±4.01ab16.30±0.07ab第7天 0.49±0.00ab2.19±0.09ab112.90±6.56ab16.18±0.25ab姜黄素对照组第1天 0.48±0.01ab2.91±0.06ab112.19±0.66ab16.69±0.52ab第3天 0.49±0.01ab2.45±0.02ab112.90±2.69ab16.30±0.06ab第7天 0.49±0.00ab2.19±0.05ab112.82±5.54ab16.18±0.25abPQ染毒组第1天 0.54±0.01ab1.62±0.11ab99.89±0.63ab14.17±0.11ab第3天 0.57±0.01ab1.35±0.02ab94.06±0.91ab11.97±0.36ab第7天 0.66±0.02ab1.43±0.01ab94.67±0.93ab12.94±0.32ab姜黄素干预组第1天 0.52±0.00ab1.78±0.01ab103.39±0.52ab14.94±0.12ab第3天 0.55±0.00ab1.45±0.02ab99.57±0.45ab13.70±0.14ab第7天 0.60±0.02ab1.54±0.01ab102.98±0.29ab14.75±0.23ab
2.2各组大鼠肾组织HO-1和iNOS活力检测 正常对照组中肾组织HO-1、iNOS表达均较低;与正常对照组比,PQ染毒组和姜黄素干预组的HO-1活力在各自处理后第1、第3天升高明显,iNOS活力在各自处理后第1、第3、第7天升高明显(P<0.05);与PQ染毒组比,同时间点的姜黄素干预组HO-1活力在给予姜黄素后的第1、第3天较之前升高明显,iNOS活力在给予姜黄素后第1、第3、第7天均明显下降(P <0.05)。见表2。
2.3各组大鼠肾组织中Nrf2 mRNA表达 正常对照组和姜黄素对照组的Nrf2 mRNA表达较少(P>0.05);与正常对照组比,PQ染毒组和姜黄素干预组的Nrf2 mRNA表达在第1、第3、第7天均有显著升高(P<0.05);与PQ染毒组比,同一时间点姜黄素干预组的Nrf2 mRNA表达明显升高(P<0.05)。见图1。
2.4各组大鼠肾组织Nrf2蛋白表达 正常对照组和姜黄素对照组Nrf2蛋白表达均较少(P>0.05);与正常对照组比,PQ染毒组和姜黄素干预组Nrf2蛋白在第1、第3、第7天均有明显升高(P<0.05);与PQ染毒组比,姜黄素干预组在第1、第3、第7天的Nrf2蛋白表达明显升高(P<0.05)。见图2。
表2 各时间点各组大鼠肾组织HO-1、iNOS活力变化(n=5,±s)
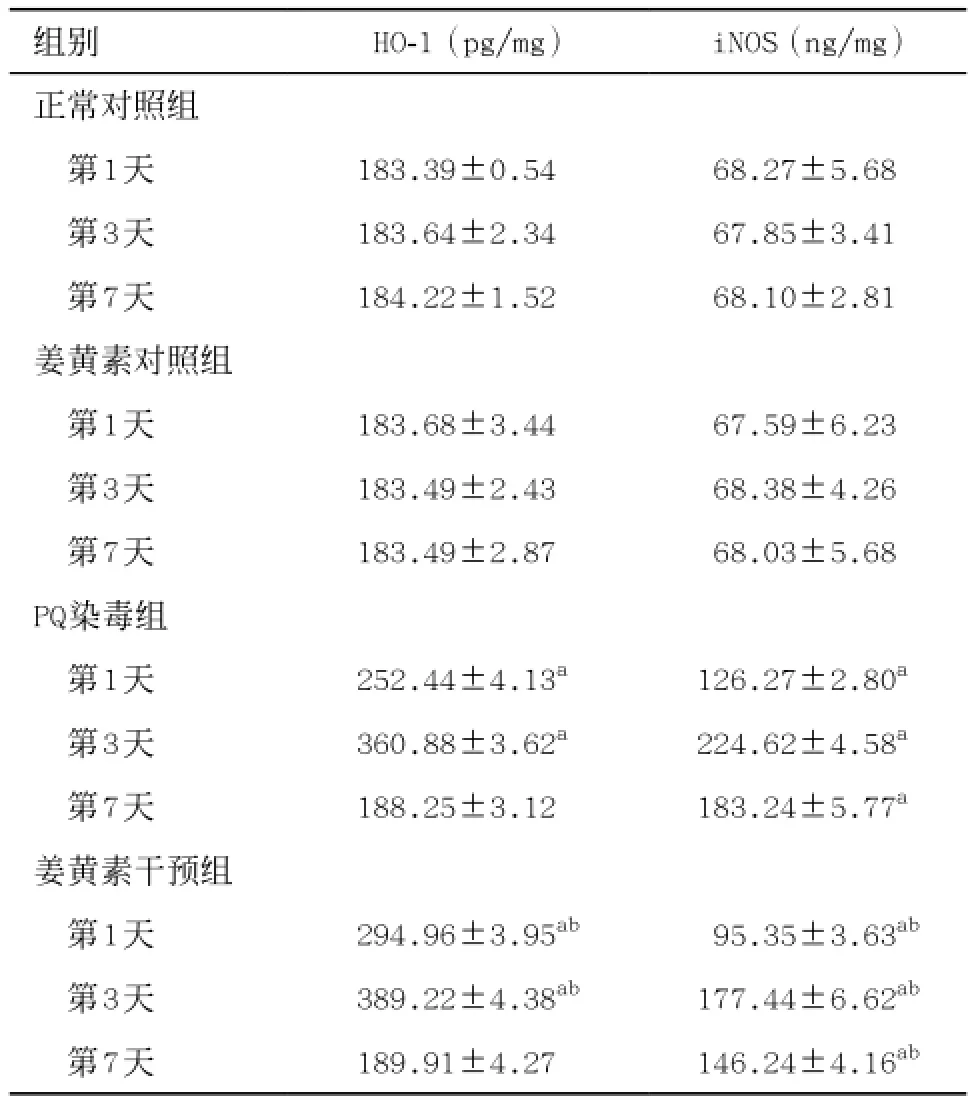
表2 各时间点各组大鼠肾组织HO-1、iNOS活力变化(n=5,±s)
与正常对照组比:aP<0.05;与PQ染毒组比:bP<0.05
组别 HO-1(pg/mg) iNOS(ng/mg)正常对照组第1天 183.39±0.54ab68.27±5.68ab第3天 183.64±2.34ab67.85±3.41ab第7天 184.22±1.52ab68.10±2.81ab姜黄素对照组第1天 183.68±3.44ab67.59±6.23ab第3天 183.49±2.43ab68.38±4.26ab第7天 183.49±2.87ab68.03±5.68abPQ染毒组第1天 252.44±4.13ab126.27±2.80ab第3天 360.88±3.62ab224.62±4.58ab第7天 188.25±3.12ab183.24±5.77ab姜黄素干预组第1天 294.96±3.95ab95.35±3.63ab第3天 389.22±4.38ab177.44±6.62ab第7天 189.91±4.27ab146.24±4.16ab

图1 各时间点各组大鼠肾组织Nrf2 mRNA表达变化

图2 各时间点各组大鼠肾组织Nrf2蛋白表达变化
2.5光学显微镜下大鼠肾组织的病理改变 正常对照组肾小管、肾小球结构完整,细胞排列整齐,肾小管管腔正常;姜黄素对照组肾小球、肾小管排列紧密,未见明显异常;PQ染毒组第1天肾小球球囊间隙明显扩大,细胞排列紊乱,第3天肾小管上皮细胞出现玻璃样变,伴有管型尿,第7天时玻璃样变性进一步加重,并出现空泡样变性,肾小管管腔上皮细胞脱落;姜黄素干预组与各时间点的PQ染毒组比,肾小管上皮细胞的玻璃样变性、空泡样变性明显减轻,细胞排列整齐、紧密。见图3。
3 讨论
PQ中毒进入体内后,快速地分布到各器官组织,经由还原型辅酶I I(NADPH)辅助的单电子还原为自由基,然后与氧反应形成超氧阴离子,后者能诱导产生更多的活性氧(reactive oxygen species,ROS),从而诱导脂质过氧化反应。MDA是脂质过氧化的产物之一,可反应脂质过氧化损伤的严重程度[2]。SOD和CAT都是体内重要的抗氧化酶,SOD催化02-生成O2和H2O2,而CAT可催化H2O2分解为H2O和O2。GSH是非蛋白的巯基化合物,可清除O-、H2O2等,是衡量机体抗氧化能力大小的重要因子[3]。本实验结果发现,PQ中毒大鼠肾组织中MDA含量明显升高,而SOD、CAT、GSH等抗氧化指标均有明显下降,提示氧化应激参与了PQ中毒大鼠急性肾损伤的发病过程,与以往研究[4-5]一致。赵波等[6]在实验中发现PQ中毒大鼠肾组织中PQ浓度在第14天时仍存在,而本实验中MDA含量在染毒后第1、第3、第7天呈持续性升高,说明PQ中毒后肾损伤的持续时间较久。
HO-1是抗氧化酶,其分解产物CO、胆红素、胆绿素也有抗氧化作用。iNOS在生理状态下肾内少量表达,而病理状态下,可以产生过量CO迅速与ROS反应生成过氧亚硝酸阴离子(ONOO-),造成肾脏细胞损伤[7]。HO-1通过抑制iNOS转录及直接与iNOS的血红素结合,减少iNOS生成,抑制ONOO-的合成。Nrf2被认为是细胞防御氧化应激损伤的关键调控因子,当受到氧化应激或亲电子试剂作用时,Nrf2 与Keapl解离,转移入细胞核,与抗氧化反应元件(anti-oxidative response element,ARE)结合后上调I I相解毒酶和抗氧化酶表达,增强细胞抗氧化能力[8]。有研究[9]发现,各种氧化应激后可激活Nrf2,上调HO-1、SOD、CAT等,发挥抗氧化损伤作用。在我们以往的研究中,赵光举等[10]在实验中发现PQ中毒后可诱导体内产生Nrf2发挥抗氧化应激作用,认为是细胞自身抗氧化保护的一种代偿反应。刘瑶等[11]在PQ中毒大鼠研究中发现生长激素释放肽通过上调Nrf2及其下游的抗氧化酶水平,减轻肺氧化损伤。本实验中提示PQ染毒组Nrf2 mRNA 和Nrf2蛋白表达较正常对照组明显升高,认为PQ中毒后自身可诱导Nrf2上调,发挥抗氧化应激作用,在染毒后第3天达高峰,第7天后下降,考虑体内自身诱导出的Nrf2量不足,呈一过性应激反应。在本实验中发现HO-1及iNOS在正常大鼠肾组织中低水平表达,在PQ中毒大鼠肾组织中HO-1明显升高,而iNOS也被大量诱生,认为在受到应激时体内抗氧化系统被激活,而在PQ染毒组第7天时,HO-1下降明显,考虑与Nrf2水平下降及HO-1被过度消耗有关。因此Nrf2作为抗氧化应激的调控因子,是PQ中毒急性肾氧化损伤的治疗靶点。

图3 各组小鼠肾组织病理学改变(×400)
姜黄素是从姜黄中分离出的一种低分子量多酚类化合物,具有抗氧化、抗炎、抗肿瘤、抗纤维化等作用,且不良反应小。近来有研究发现姜黄素对各种原因引起的急性或慢性肾功能损害均有保护作用[12]。李昱辰等[13]发现姜黄素通过抗氧化和清除氧自由基作用减轻顺铂引起的肾毒性。研究[14]发现,姜黄素能够促进细胞的Nrf2通路活化,并诱导下游抗氧化酶类表达,发挥对氧化应激的保护作用。Soetikno等[15]对大鼠进行5/6肾切除手术并给予姜黄素治疗中发现,姜黄素可上调Nrf2蛋白,增加细胞内HO-1、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等活力,降低MDA含量,表明姜黄素可通过Nrf-2通路调控I I相解毒酶类表达,减轻肾脏损伤。本实验中显示,给予姜黄素后能进一步上调Nrf2水平,提高HO-1、SOD、CAT活力,抑制iNOS表达,提示姜黄素可能通过Nrf2途径提高肾组织抗氧化水平,保护PQ中毒大鼠急性肾氧化损伤。
[1]贺晓艳, 邱俏檬, 卢中秋, 等.12例急性百草枯中毒患者的救治分析[J].中国急救复苏与灾害医学杂志, 2009, 4(4): 231-233.
[2]KIM HLEE S WBAEK K Met al.Continuous hypoxia attenuates paraquat-induced cytotoxicity in the human A549 lung carcinoma cell line[J].Exp Mol Med201143(9)494-500.
[3]REES M DKENNETT E CWHITELOCK J Met al.Oxidativedamage to extracellular matrix and its role in human pathologies[J].Free Radic Biol Med200844(12)1973-2001.
[4]WE TTIAN WLIU Fet al.Protective effects of exogenous β-hydroxybutyrate on paraquat toxicity inrat kidney [J].Biochem Biophys Res Commun2014447(4)666-671.
[5]DINIS-OLIVEIRA R JDUARTE J ASANCHEZ-NAVARRO Aet al.Paraquat poisoningsmechanisms of lung toxicityclinical featuresand treatment[J].Crit Rev Toxicol,200838(1)13-71.
[6]赵波菅向东张忠臣等.百草枯染毒大鼠组织中毒物含量与脏器损伤的关系[J].中华劳动卫生职业病杂志2010,28(3)220-223.
[7]D E OLIVEIRA-SALES E BNISHI E EBOIM M Aet al.Upregulation of AT1R and iNOS in the rostral ventrolateral medulla (RVLM) is essential for the sympathetic hyperactivity and hypertension in the 2K-1C Wistar rat model[J].Am J Hypertens201023(7)708-715.
[8]TOYOKUNI SAKATSUKA S.Pathological investigation of oxidative stress in the post-genomic era[J].Pathol Int,200757(8)461-473.
[9]WANG DWANG YWAN Xet al.Green tea polyphenol (-)-epigallocatechin-3-gallate triggered hepatotoxicity in miceresponses of major antioxidant enzymes and the Nrf2 rescue pathway[J].Toxicol Appl Pharmacol2015283(1):65-74.
[10]赵光举, 蔡晓霞, 佘兴蓉, 等.沙利度胺对百草枯诱导的小鼠肺氧化损伤的干预及机制[J].中华劳动卫生职业病杂志, 2014, 32(11): 806-812.
[11]刘瑶, 郭瑞娟, 王菲, 等.生长激素释放肽对百草枯中毒小鼠急性肺损伤的保护作用[J].中华劳动卫生职业病杂志, 2014, 32(3): 190-194.
[12]TRUJILLO JCHIRINO Y IMOLINA-JIJÓN Eet al.Renoprotective effect of the antioxidant curcuminReent findings[J].Redox Biol20131(1)448-456.
[13]李昱辰, 仲来福.姜黄素对顺铂所致大鼠肾毒性的防护作用[J].毒理学杂志, 2006, 20(2): 91-93.
[14] 韩文文, 吴冬, 刘虹, 等.姜黄素对急性百草枯中毒大鼠肝脏氧化损伤的干预[J].中华劳动卫生职业病杂志, 2014, 32(5): 352-356.
[15]SOETIKNO VSARI F RLAKSHMANAN A Pet al.Curcumin alleviates oxidative stressinflammationand renal fibrosis in remnant kidney through the Nrf2-keapl pathway[J].Mol Nutr Food Res201357(9)1649-1659.
(文本编辑:吴昔昔)
Protective effect of curcumin against acute renal oxidative injury of paraquat-induced in mice
ZHENG Dan1HAN Wenwen2HONG Guangliang3ZHAO Guangju3LI Mengfang3CAI Xiaoxia3WU Bin3LU Zhongqiu3.1.Intensive Care UnitTaizhou Hospital Affiliated to Wenzhou Medical UniversityTaizhou317000;2.Department of EmergencyNingbo Medical Treatment Center Lihuili HospitalNingbo315000; 3.Emergency Medical Centerthe First Affiliated Hospital of Wenzhou Medical UniversityWenzhou325015
ObjectiveTo investigate the effect of curcumin on oxidative stress of acute renal injury in rats induced by paraquat and the mechanism underlying its effect.MethodsSixty rats were randomly divided into 4 groupscontrol group (n=15)curcumin control group (curcumin 50 mg/kg) (n=15)PQ poisoned group (2% paraquat solution 100 mg/kg) (n=15)and curcumin intervention group (intraperitoneal injection of curcumin 50 mg/kg at 15 min24 hor 48 h after paraquat exposure) (n=15).On days l3 and 7 after the treatment and renal tissue was collected.The content of malonaldehyde (MDA) and glutathione (GSH)the activities of superoxide dismutase activity (SOD) and catalase (CAT) in the renal tissue were determined with chemical colorimetry.The activities of heme oxygenase-1 (HO-1) and inducible nitric oxide synthase (iNOS) in the renal tissue were determined with ELISA.The mRNA and protein levels of nuclear related factor 2 (Nrf2) were determined with RT-PCR and Western Blotrespectively.The pathological changes of renal tissue were examined under optical microscopy.ResultsBoth PQ group and curcumin intervention group with each time showed increase in MDA contentdecrease in GSH contentdecrease in SOD and CAT activitiesincrease in iNOS activitiesincrease in the protein and mRNA levels of Nrf2increase in HO-1 activities at day 13in comparison with the control group (P<0.05).In comparison with the PQ group on the same daythe curcumin intervention group showed de-crease in MDA contentincrease in the activities of GSHSODCATdecrease in iNOS activitiesand increase in the mRNA and protein levels of Nrf2 on days l3 and 7increase in HO-1 on days 13 (P<0.05).In the PQ groupthe clearance of glomerulus saccules was increasedarranged in disorderrenal tubular epithelial cell appeared glassy degeneration and vacuolar degeneration with time expandingbut compared with PQ groupthe pathological manifestations was relieved obviously with the same time in the curcumin intervention group.ConclusionCurcumin plays a protective role in paraquat poisoning with oxidative stress of acute renal injurywhich may depend on inducing the expression of Nrf2increasing the HO-1SOD and other antioxidant enzyme levels,and increasing the ability of resistance to oxidative stress in renal tissue.
paraquat; renal injury; nuclear related factor 2; curcumin; oxidative stress
S884.9
ADOI10.3969/j.issn.2095-9400.2016.06.001
2015-09-03
浙江省中医药重点学科计划项目(2012-XK-A28);浙江省“十二五”重点学科建设项目(2012-207);浙江省医学创新学科建设项目(11-CX26)。
郑丹(1982-),女,浙江临海人,主治医师。
卢中秋,主任医师,Email:lzq640815@163.com。

