GLP-1受体激动剂Exendin4对胰岛β细胞胰岛素和IAPP分泌模式的影响
黄婷婷,谷雪梅
(温州医科大学附属第一医院 内分泌科,浙江 温州 325015)
GLP-1受体激动剂Exendin4对胰岛β细胞胰岛素和IAPP分泌模式的影响
黄婷婷,谷雪梅
(温州医科大学附属第一医院内分泌科,浙江温州325015)
目的:探讨GLP-1受体激动剂(GLP-1RA)Exendin4作用下胰岛β细胞的胰岛素及胰淀粉样多肽(IAPP)的分泌模式。方法:观察小鼠胰岛瘤细胞系MIN6细胞在不同浓度Exendin4作用不同时间后的细胞形态的变化;利用MTT实验检测MIN6细胞在不同干预后的细胞活性的变化;采用葡萄糖刺激胰岛素分泌实验,检测MIN6细胞在不同干预后培养液上清中的胰岛素和IAPP分泌量的变化;采用荧光定量PCR(RT-PCR)检测各组MIN6细胞的胰岛素和IAPP mRNA表达水平的变化。结果:与正常对照组比较,Exendin4组的细胞数量增加,贴壁牢固,形态正常;细胞活性随Exendin4作用浓度以及作用时间的增加而显著增加,具有一定的浓度及时间依赖性;胰岛素和IAPP的分泌水平随Exendin4作用浓度以及作用时间的增加而显著增加,具有一定的浓度及时间依赖性,而IAPP/胰岛素的比值随作用浓度以及作用时间的增加而减小;胰岛素和IAPP mRNA水平均随Exendin4作用浓度以及作用时间的增加而上调,具有一定的浓度及时间依赖性,IAPP/胰岛素mRNA比值随作用浓度以及作用时间的增加而减小。结论:Exendin4作用于MIN6细胞可增加细胞数量和细胞活性,改善细胞状态,保护胰岛细胞功能;并且可引起胰岛素以及IAPP分泌水平增加,胰岛素和IAPP mRNA表达水平增加,而IAPP/胰岛素比值下降。
胰高糖素样多肽1;胰淀粉样多肽;Exendin4;胰岛β细胞
2型糖尿病(type 2 diabetes mellitus,T2DM)的主要特征是胰岛素抵抗(insulin resistance,IR)以及胰岛β细胞功能进行性衰竭,伴随着胰岛β细胞数量的减少,从而导致胰岛素效应相对或绝对不足,引起血糖的升高[1-3]。T2DM患者的胰岛病理特征也表现为胰淀粉样多肽(islet amyloid polypeptide,IAPP)的细胞外淀粉样积聚。尽管IAPP是相对惰性的,但T2DM的胰岛β细胞内IAPP形成的低聚物具有膜穿透毒性[4-6],它被视为可诱导β细胞功能紊乱和凋亡。Cadavez等[7]、Gao等[8]和Akter等[9]研究发现过表达的人IAPP可诱发内质网应激标志更强的响应。因此,细胞中激活的信号转导的续连被称为未折叠蛋白应答(unfolded protein response,UPR),其可引发炎症,并最终导致细胞死亡[5,10-11]。由此,IAPP成为我们关注的重要对象。
IAPP是与胰岛素由同一胰岛β细胞共同产生和分泌,因此那些促进内源性胰岛素分泌的治疗药物很可能会引起IAPP分泌的增加,而这样的变化是否会与胰岛素相互作用,是否足以影响其降糖的效应,或者影响糖尿病病程,并不是非常清楚。
胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)是一种重要的肠促胰岛素,它可以刺激胰岛素分泌,促进胰岛β细胞增殖以及提高胰岛β细胞生存率[12-14]。GLP-1受体激动剂(GLP-1 receptor agonists,GLP-1RA)具有类似GLP-1的作用,同时又因其与天然GLP-1的结构差异可增强它的作用时间。
目前鲜有研究报道GLP-1与IAPP分泌模式之间的关系。故本研究通过探讨GLP-1RA作用下胰岛细胞的胰岛素及IAPP的分泌模式,来研究GLP-1RA促胰岛素分泌的同时是否影响IAPP以及GLP-1RA的保护作用是否与IAPP分泌模式相关。
1 材料和方法
1.1细胞培养 小鼠胰岛瘤细胞系MIN6细胞购自武汉大学中国典型培养物保藏中心。MIN6细胞用含10% FBS、1%青链霉素的高糖DMEM培养液培养,置于37 ℃、5% CO2的培养箱中,2~3 d换1次液。当显微镜下观察细胞生长至约80%~90%融合度时,用胰蛋白酶溶液消化传代。将MIN6细胞接种于6孔板,待培养至70%融合状态时,换用含或不含Exendin4的培养液继续培养48 h后,在倒置相差显微镜下观察MIN6细胞形态。
1.2MTT实验 MIN6细胞在含不同浓度Exendin4的培养基中孵育不同时间后,加入MTT(5 mg/mL)继续孵育4 h,弃去上清液,每孔内加入DMSO终止反应,震荡10 min,使结晶物充分溶解,各孔用酶标仪测
量波长490 nm处的OD值,重复实验3次。细胞存活率计算:细胞存活率=(测定组OD值-空白组OD值)/(正常对照组OD值-空白组OD值)。正常对照组存活率为100%。
1.3葡萄糖刺激胰岛素释放(glucose-stimulated insulin secretion,GSIS)实验 MIN6细胞接种培养板,贴壁24 h后,经不同浓度Exendin4处理不同时间后,用Krebs-Ringer HEPES(KRHB)缓冲液(含有5 mmol/L碳酸氢钠,1 mmol/L氯化钙,2.8 mmol/L葡萄糖,10 mmol/L HEPES和10% FBS)清洗后,并在KRHB缓冲液里37 ℃孵育30 min;随后更换成含有25 mmol/L葡萄糖的KRHB缓冲液里37 ℃孵育1 h。分别收集培养后的缓冲液,采用ELISA法检测缓冲液中的胰岛素、IAPP含量。
1.4荧光定量PCR(RT-PCR) MIN6细胞在含不同浓度Exendin4培养基中孵育不同时间后,用Trizol法提取细胞总RNA,经反转录试剂盒反转录为cDNA,使用RT-PCR试剂盒检测MIN6细胞胰岛素和IAPP及内参β-actin的mRNA的表达水平。见表1。

表1 PCR引物

2 结果
2.1Exendin4对MIN6细胞形态的影响 正常对照组MIN6细胞贴壁比较牢,生长良好,形态正常;Exendin4作用于MIN6细胞后,细胞数量增加,贴壁更为牢固,形态正常。见图1。
2.2Exendin4对MIN6细胞活性的影响 不同浓度Exendin4作用于MIN6细胞24 h或48 h后,随Exendin4浓度增加细胞活性明显上升,并且呈现出一定的量效相关性及时间相关性。见图2。

图1 Exendin4对MIN6细胞形态的影响
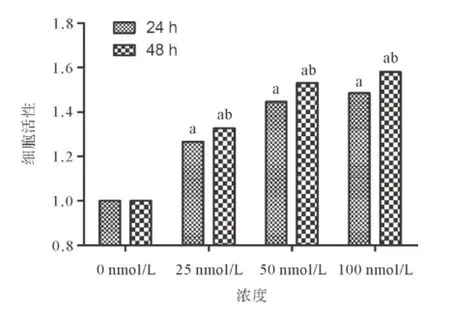
图2 Exendin4干预MIN6细胞24 h或48 h后对细胞活性的影响
2.3GSIS实验 不同浓度Exendin4(25、50、100 nmol/L)干预MIN6细胞24 h或48 h后,胰岛素和IAPP的分泌水平随Exendin4药物浓度的增加而增加,随作用时间增加而增加,具有一定浓度及时间依赖性。而且,胰岛素分泌水平增加幅度大于IAPP。因此IAPP/胰岛素比值随Exendin4药物浓度的增加而减小,随作用时间增加而减小。见图3。
2.4Exendin4对MIN6细胞胰岛素和IAPP mRNA表达水平的影响 不同浓度Exendin4(0、25、50、100 nmol/L)干预24 h、48 h,MIN6细胞胰岛素和IAPP mRNA的表达水平随Exendin4药物浓度的增加而增加,随作用时间增加而增加,具有一定浓度及时间依赖性。IAPP/胰岛素mRNA比值随Exendin4药物浓度的增加而减小,随作用时间增加而减小。见图4。
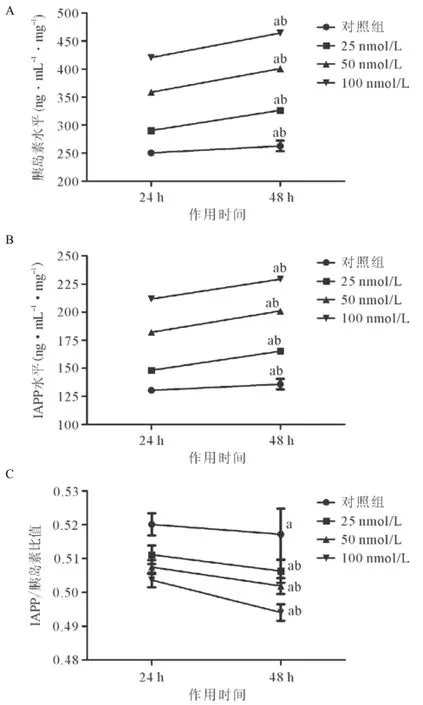
图3 Exendin4对MIN6细胞胰岛素和IAPP分泌模式的影响
3 讨论
IAPP聚集物即淀粉样纤维沉积已被认定为T2DM的一个典型病理特征。许多研究结果支持了胰岛淀粉样的形成在胰岛β细胞功能衰竭的发展并最终导致高血糖的T2DM中具有重要作用。作为纤维沉淀物的主要成分,IAPP成为我们关注的重要对象。大多数关于糖尿病与IAPP的研究都着重于增强胰岛素敏感性和降低高血糖以利于减少内源性IAPP的表达和淀粉样蛋白的形成[6,15-16]。而我们这项研究新颖地着重于GLP-1对于IAPP分泌模式的影响。
GLP-1是有名的肠促胰岛素,它可以刺激胰岛素分泌[17-18],然而,关于其是否具有影响IAPP分泌模式的功能尚不可知,同时也没有研究报道目前临床上用的胰岛素促泌剂是否影响IAPP的分泌模式。在我们这项研究中,我们发现IAPP的分泌水平以及mRNA的表达水平依赖于Exendin4的作用浓度与作用时间,IAPP/胰岛素的比值随Exendin4的作用浓度与作用时间增加而减小,此种分泌模式可能有助于减少IAPP形成淀粉样沉积并有效地降低血糖,改善IR,其远期效应可能延缓胰岛功能衰竭等进程。已知IAPP是与胰岛素一起从胰岛细胞分泌泡以一定比例相伴分泌的,所以IAPP/胰岛素比值的改变可能是由于胰岛素与IAPP分泌的分离。已知循环中GLP-1的水平可以直接刺激胰岛β细胞分泌胰岛素,此作用是通过PKC依赖的TRPM4和TRPM5的激活[19-20]。所以本实验结果反应的GLP-1对IAPP分泌及表达水平的影响可能也是GLP-1直接刺激IAPP的结果。有一项研究[20]发现短时间暴露于高浓度的IAPP会抑制格列本脲诱导的依赖ATP的K+(KATP)通道的闭合和减少钙离子的内流,这最终可能会导致INS-1细胞胰岛素分泌的减少。GLP-1与IAPP之间可能是一种相互调节的关系,具体的作用途径和位点有待于进一步的研究。
T2DM的发病机制主要有2个环节,即IR和胰岛β细胞功能受损,而后者是T2DM发病的中心环节。胰岛β细胞功能损伤包括胰岛素分泌异常和细胞数量减少。综上所述,我们的研究结果认为,Exendin4很可能是通过减小IAPP/胰岛素的比值从而保护胰岛细胞存活和其功能。Exendin4有助于延缓T2DM的进程。
本研究的不足之处在于我们的实验课题仅在细胞实验水平,没有进行体内实验研究。此外,我们仅研究Exendin4作用下胰岛细胞的胰岛素及IAPP的分泌模式,没有与其他胰岛素促泌剂相对比,后续我们将进一步开展相关研究。

图4 Exendin4对MIN6细胞胰岛素和IAPP mRNA表达水平的影响
[1]BUTLER A EJANSON JBONNER-WEIR Set al.Betacell deficit and increased beta-cell apoptosis in humans with type 2 diabetes[J].Diabetes200352(1)102-110.
[2]SAISHO Y.β-cell dysfunctionIts critical role in prevention and management of type 2 diabetes[J].World J Diabetes,20156(1)109-124.
[3]KANETO H.Pathophysiology of type 2 diabetes mellitus[J].Nihon Rinsho201573(12)2003-2007.
[4]GURLO TRYAZANTSEV SHUANG C Jet al.Evidence for proteotoxicity in beta cells in type 2 diabetestoxic islet amyloid polypeptide oligomers form intracellularly in the secretory pathway[J].J Pathol2010176(2)861-869.
[5]FERNANDEZ M S.Human IAPP amyloidogenic properties and pancreatic beta-cell death[J].Cell Calcium201456(5):416-427.
[6]JEONG H RAN S S.Causative factors for formation of toxic islet amyloid polypeptide oligomer in type 2 diabetes mellitus[J].Clin Interv Aging2015101873-1879.
[7]CADAVEZ LMONTANE JALCARRAZ-VIZAN Get al.Chaperones ameliorate beta cell dysfunction associated with human islet amyloid polypeptide overexpression[J].PloS one20149(7)e101797.
[8]GAO MWINTER R.The effects of lipid membranes,cowding and osmolytes on the aggregationand fibrillation propensity of human IAPP[J].J Diabetes Res20152015:849017.
[9]AKTER RCAO PNOOR Het al.Islet amyloid polypeptidestructurefunctionand pathophysiology[J].J Diabetes Res201620162798269.
[10]EIZIRIK D LMIANI MCARDOZO A K.Signalling dangerendoplasmic reticulum stress and the unfolded protein response in pancreatic islet inflammation[J].Diabetologia,201356(2)234-241.
[11]MONTANE JCADAVEZ LNOVIALS A.Stress and the inflammatory processa major cause of pancreatic cell death in type 2 diabetes[J].Diabetes Metab Syndr Obes20147:25-34.
[12]KRIEGER J PARNOLD MPETTERSEN K Get al.Knockdown of GLP-1 receptors in vagal afferents affects normal food intake and glycemia[J].Diabetes201665(1):34-43.
[13]WANG X FLIU J JXIA Jet al.Endogenous glucagonlike peptide-1 suppresses high-fat food intake by reducing synaptic drive onto mesolimbic dopamine neurons[J].Cell reports201512(5)726-733.
[14]RONVEAUX C CTOME DRAYBOULD H E.Glucagonlike peptide 1 interacts with ghrelin and leptin to regulate glucose metabolism and food intake through vagal afferent neuron signaling[J].J Nutr2015145(4)672-680.
[15]HULL R LSHEN Z PWATTS M Ret al.Long-term treatment with rosiglitazone and metformin reduces the extent ofbut does not preventislet amyloid deposition in mice expressing the gene for human islet amyloid polypeptide[J].Diabetes200554(7)2235-2244.
[16]MUKHERJEE AMORALES-SCHEIHING DBUTLER P Cet al.Type 2 diabetes as a protein misfolding disease[J].Trends Mol Med201521(7)439-449.
[17]BROICHHAGEN JPODEWIN TMEYER-BERG Het al.Optical control of insulin secretion using an incretin switch [J].Angew Chem Int Ed Engl201554(51)15565-15569.
[18]SHIGETO MRAMRACHEYA RTARASOV A Iet al.GLP-1 stimulates insulin secretion by PKC-dependent TRPM4 and TRPM5 activation[J].J Clin Invest2015,125(12)4714-4728.
[19]KOLIC JMACDONALD P E.cAMP-independent effects of GLP-1 on beta cellsJ].J Clin Invest2015125(12)4327-4330.
[20]XIAO JLI XZHAO Xet al.The effects and mechanism of islet amyloid polypeptide on insulin secretion in INS-1 cells stimulated by glibenclamide[J].Zhonghua nei ke za zhi201554(3)214-218.
(本文编辑:吴昔昔)
Effect of GLP-1 receptor agonist Exendin4 on secretion pattern of insulin and islet amyloid polypeptide in islet beta cells
HUANG TingtingGU Xuemei.Department of Endocrinologythe First Affiliated Hospital of Wenzhou Medical UniversityWenzhou325015
ObjectiveTo explore the effect of GLP-1 receptor agonist (GLP-1RA) Exendin4 on insulin and islet amyloid polypeptide (IAPP) secretion pattern.MethodsCell morphology of MIN6 cells was observed after treated with different concentrations of GLP-1 receptor agonist Exendin4 for different time periods.Cell viability of MIN6 cells was detected after different interventions respectively by MTT assay.Glucose-stimulated secretion levels of insulin and islet amyloid polypeptide were examined in culture supernatant of MIN6 cells and RTPCR was used for detecting the expression levels of insulin mRNA and IAPP mRNA after different interventions respectively.ResultsCompared with the control groupExendin4 group exhibited much stronger adherence to the culture dishwith normal morphology and increasing cell numbers.There was a significant increase of cell viability in MIN6 cells treated with Exendin4which displayed dose- and time-dependent pattern.Insulin and islet amyloid peptide secretion levels increased accordinglywhile the ratio of IAPP/insulin decreased.The mRNA expression levels of insulin and IAPP of MIN6 cells were increased with treatment of Exendin4which also displayed dose- and time-dependent patternwhile the ratio of IAPP/insulin mRNA correspondingly.Conclusion:Exendin4 increases the number and cell viability of MIN6 cells.Exposure to Exendin4 can increase insulin and IAPP secretion levelsand mRNA expression levels of insulin and IAPP as wellwhile the ratio of IAPP/insulin is deceased accordingly.
glucagon-like peptide-1; islet amyloid polypeptide; Exendin4; islet beta cell
R587
ADOI10.3969/j.issn.2095-9400.2016.06.003
2016-02-17
中华医学会项目(13020110396);国家自然科学基金青年基金资助项目(81000356)。
黄婷婷(1990-),女,浙江温州人,硕士生。
谷雪梅,副主任医师,副教授,硕士生导师,Email:snowgxm@126.com。

