Rho鸟苷交换因子12(ARHGEF12)基因在白血病细胞生长中的作用研究
高莉,解杨阳,王翔,汤燕静,汤静燕,陈静,沈树红
(上海交通大学医学院附属上海儿童医学中心 血液/肿瘤科,上海 200127)
Rho鸟苷交换因子12(ARHGEF12)基因在白血病细胞生长中的作用研究
高莉,解杨阳,王翔,汤燕静,汤静燕,陈静,沈树红
(上海交通大学医学院附属上海儿童医学中心血液/肿瘤科,上海200127)
目的:探讨Rho鸟苷交换因子12(ARHGEF12)基因对白血病细胞生长的作用及作用机制。方法:通过实时荧光定量PCR(RT-PCR)对选定的U937、KG1a、ML2、Kasumi-1、THP1白血病细胞株进行ARHGEF12基因表达的检测,并用shRNA分别在高表达及低表达的白血病细胞株中敲低ARHGEF12,通过流式细胞术分析细胞的生长及凋亡情况,最后进行蛋白激酶芯片分析以发现相关作用机制。结果:部分白血病细胞株高表达ARHGEF12基因,在高表达的细胞中敲低ARHGEF12基因会使细胞生长受抑制,这与敲低后细胞凋亡增加、增殖抑制相关,并且和p53、CDK2及p27 Kip1磷酸化相关。结论:ARHGEF12对其高表达的白血病细胞的生长是必须的,敲低ARHGEF12基因导致白血病细胞凋亡增加、增殖抑制。
ARHGEF12基因;白血病细胞;凋亡
Rho鸟苷交换因子12(ARHGEF12),也称白血病相关的Rho鸟苷交换因子(LARG),是在1例急性髓细胞白血病中发现的MLL基因的融合伙伴基因[1]。ARHGEF12特异性催化与Rho家族成员RhoA结合的GDP和GTP进行交换,形成RhoA-GTP,从而激活RhoA并参与下游信号通路而发挥生物学功能[2]。Rho GTP酶也广泛地参与正常造血过程,包括造血干/祖细胞的自我更新、归巢及与骨髓微环境的相互作用
和各系血细胞的发育过程等;其异常表达和活化也与血液系统疾病密切相关[3-6]。研究[7]显示,抑制RhoA及其下游的ROCK信号通路可抑制K562细胞生长。但到目前为止,ARHGEF12对白血病细胞的作用尚不清楚。本研究旨在通过对不同髓系白血病细胞株的研究,了解ARHGEF12对白血病细胞生长的影响并探讨其作用机制。
1 材料和方法
1.1主要试剂 人急性髓系白血病U937、KG1a、ML2、Kasumi-1、THP1细胞株,293T细胞购自ATCC细胞库或由其他实验室赠予,由本实验室传代冻存。
RPMI 1640、DMEM、TRIzol购自美国Invitrogen公司;IMDM培养液购自美国Gibco公司;胎牛血清(FBS)购自美国Life Technologies公司;ARHGEF12及ABL基因引物由上海桑尼生物科技有限公司合成;反转录试剂盒购自大连Takara公司;qRT-PCR试剂盒购自大连Takara公司;ARHGEF12多克隆抗体、β-actin抗体购自美国Santa Cruz公司;Annexin V/7AAD-A细胞凋亡检测试剂盒购自美国Becton Dickinson公司;嘌呤霉素(puromysin,PM)购自美国Thermo Fisher公司;脱靶shRNA质粒购自美国Sigma-Aldrich公司。
1.2细胞培养 U937、KG1a、ML2、Kasumi-1和THP1细胞用含10% FBS的IMDM培养液,293T细胞用含10% FBS的DMEM培养液,置于37 ℃、5% CO2、饱和湿度的培养箱内传代培养。
1.3RNA抽提 分别收集各细胞株[细胞计数为(5~10)×106/mL]的细胞,加入1 mL TRIzol,裂解后按说明书抽提RNA,置于-80 ℃保存。
1.4反转录合成cDNA 反应体系如下:5×Prime-Script RT Master Mix 2 μL;总RNA 500 ng;DEPC水补足至10 μL。反应条件:37 ℃,15 min;85 ℃,5 s;4 ℃,10 min。
1.5实时荧光定量PCR(RT-PCR) ARHGEF12前向引物序列:5’-AGCCGTCATGACAACAGTGC-3’;ARHGEF12反向引物序列:5’-CTAACCCACTCTGGCGCAAC-3’;所用仪器为ABI 7900H,反应条件为:95 ℃,30 s;95 ℃,5 s;60 ℃,30 s;40个循环。
1.6shRNA质粒构建 靶向ARHGEF12基因不同位点的3个pLKO.1-puro shRNA质粒及脱靶shRNA质粒(作为对照组)用黄色荧光蛋白Venus序列替换了嘌呤霉素抗性原件。
1.7病毒包装和转染 质粒DNA通过钙转法转入293T包装细胞,转染后48 h收集病毒上清。白血病细胞与病毒上清在纤维连接蛋白(retronectin,RN)包被的24孔板中孵育36 h后,用含10% FBS的RPMI 1640培养液重悬并继续培养。
1.8ARHGEF12蛋白表达的Western Blot测定 分别收集转染3个shRNA后72 h的细胞及对照(NT)组细胞,加入细胞裂解液,提取蛋白质,具体步骤参照文献[8]。采用SDS-PAGE蛋白电泳进行分离,然后转移至硝酸纤维素膜,用含5%脱脂牛奶的TBST封闭1 h,分别用ARHGEF12抗体(1:500)、β-actin抗体4 ℃过夜,TBST洗膜3次。二抗用含2%脱脂奶粉的TBST室温孵育1 h,TBST洗膜3次,然后显影曝光。
1.9 流式细胞术 分别收集转染shRNA后3 d及7 d的白血病细胞及NT组细胞,用预冷的PBS洗涤细胞2次,用流式细胞仪检测黄色荧光蛋白Venus阳性的细胞比例,取敲低组与NT组的比值。收集转染puroshRNA后48 h的白血病细胞并用嘌呤霉素(终浓度2.5 μg/mL)处理3 d,用预冷的PBS洗涤细胞2次,再用1×binding buffer缓冲液配制成1×106/mL的细胞悬液。各取100 μL加入Falcon试管中,先加入Annexin V染料5 μL,避光10 min。用PBS洗涤1次,再加入7AAD-A染料5 μL,避光15 min,上流式细胞仪测定结果。
1.10蛋白激酶芯片分析 收集转染puro-shRNA后48 h的Kasumi-1细胞,并用嘌呤霉素(终浓度2.5 μg/mL)处理3 d,经上海华盈生物医药有限公司进行蛋白激酶芯片分析(送样细胞数量1×107)。
2 结果
2.1ARHGEF12在不同髓系白血病细胞株中的表达通过RT-PCR检测ARHGEF12在ML2、Kasumi-1、U937、THP1和KG1a细胞中的表达水平,结果表明ARHGEF12
在Kasumi-1、U937和THP1细胞中表达量相对较高,而在KG1a细胞中表达量相对较低。见图1。
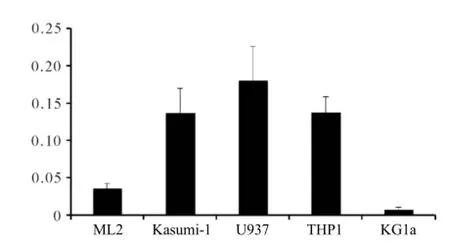
图1 ARHGEF12在不同髓系白血病细胞株中的表达
2.2ARHGEF12基因敲低效果 在Kasumi-1细胞中分别转染了3个shRNA,通过Western Blot检测ARHGEF12蛋白的表达,结果显示相较NT组有明显敲低效果,其中shRNA1效果最显著。见图2。

图2 ARHGEF12蛋白在shRNA敲低后的表达
2.3敲低ARHGEF12抑制白血病细胞生长 分别在KG1a(ARHGEF12低表达)和Kasumi-1(ARHGEF12高表达)细胞中敲低ARHGEF12,采用流式细胞术分别检测敲低后3 h及7 h活细胞数量,在Kasumi-1细胞中活细胞数明显减少,细胞生长被抑制。以上结果表明ARHGEF12在其高表达的细胞中对维持细胞生长是必需的。见图3。

图3 敲低ARHGEF12后对2种白血病细胞生长的影响
2.4敲低ARHGEF12增加白血病细胞的凋亡 分别在ARHGEF12高表达的Kasumi-1和U937细胞中敲低ARHGEF12,采用流式细胞术分析敲低后第3天的凋亡指标Annexin V,在Kasumi-1细胞中3个shRNA都能明显增加凋亡的细胞数,而在U937细胞中凋亡也有增加,但没有Kasumi-1细胞明显,Kasumi-1细胞用shRNA2敲低ARHGEF12后凋亡增加,见图4-5。
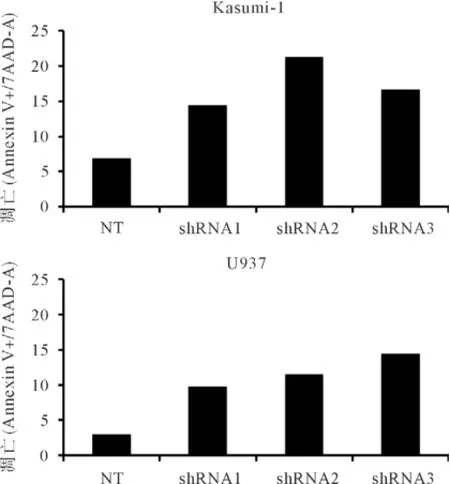
图4 敲低ARHGEF12后对2种白血病细胞凋亡的影响
2.5敲低ARHGEF12对下游信号通路的影响 在敲低ARHGEF12后第3天的Kasumi-1细胞中,从蛋白激酶芯片的结果显示p53的第315位丝氨酸、CDK2第160位苏氨酸及p27 Kip1第10位丝氨酸的磷酸化水平均较NT组上调。见表1。

图5 Kasumi-1细胞用shRNA2敲低后的流式代表图
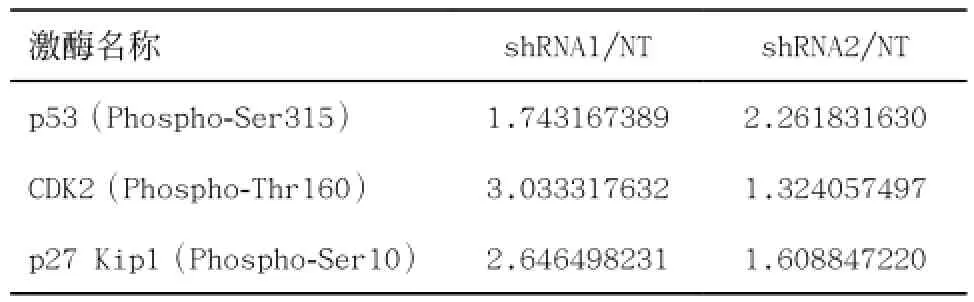
表1 Kasumi-1细胞中敲低ARHGEF12后关键激酶磷酸化水平的变化
3 讨论
本研究发现下调ARHGEF12能明显降低白血病细胞中活细胞的比例,结合凋亡增加的表型,提示ARHGEF12在白血病细胞中主要通过调控凋亡途径从而影响细胞的存活。蛋白激酶芯片的数据提示CDK2下游p53磷酸化上调,可能是对凋亡引起的DNA损伤的反应[9-10]。
文献[11-12]报道p27 Kip1可与cyclin E.CDK2复合物结合,从而控制细胞周期及细胞生长,而p27 Kip1第10位丝氨酸磷酸化可促使细胞周期阻滞在G1期。因此,敲低ARHGEF12后细胞生长抑制很可能与p27 Kip1第10位丝氨酸磷酸化上调引起的细胞周期阻滞有关,本研究未进行细胞周期相关检测,尚待进一步研究。
本研究选取的研究对象为白血病细胞株,发现ARHGEF12在不同髓系白血病细胞中的表达水平不尽相同,而在高表达的细胞中敲低该基因会导致细胞生长受抑制,这种抑制作用是敲低ARHGEF12后细胞凋亡增加及增殖抑制的共同结果,所以有必要在临床样本,尤其是急性髓系白血病病人样本中检测ARHGEF12的表达水平。对于ARHGEF12高表达的白血病患者,抑制ARHGEF12可作为一个潜在的治疗靶点。
[1]KOURLAS P JSTROUT M PBECKNELL Bet al.Identification of a gene at 11q23 encoding a guanine nucleotide exchange factorevidence for its fusion with MLL in acute myeloid leukemia[J].Proc Natl Acad Sci U S A200097 (5)2145-2150.
[2]REUTHER G WLAMBERT Q TBOODEN M Aet al.Leukemia-associated Rho guanine nucleotide exchange factora Dbl family protein found mutated in leukemiacauses transformation by activation of RhoA[J].J Biol Chem2001,276(29)27145-27151.
[3]CANCELAS J ALEE A WPRABHAKAR Ret al.Rac GTPases differentially integrate signals regulating hematopoietic stem cell localization[J].Nat Med200511(8)886-891.
[4]GU YFILIPPI M DCANCELAS J Aet al.Hematopoietic cell regulation by Rac1 and Rac2 guanosine triphosphatases [J].Science2003302(5644)445-449.
[5]YANG F CATKINSON SGU Yet al.Rac and Cdc42 GT
Pases control hematopoietic stem cell shapeadhesionmigrationand mobilization[J].Proc Natl Acad Sci U S A,200198 (10)5614-5618.
[6]YANG LWANG LGEIGER Het al.Rho GTPase Cdc42 coordinates hematopoietic stem cell quiescence and niche interaction in the bone marrow[J].Proc Natl Acad Sci U S A,2007104 (12)5091-5096.
[7]MOLLI P RPRADHAN M BADVANI S Het al.RhoA:a therapeutic target for chronic myeloid leukemia[J].Mol Cancer20121116.
[8]王德选, 叶晓华, 余灵芳, 等.WNK3激酶高表达对白介素-1β诱导HEK293细胞凋亡的保护作用[J].温州医科大学学报, 2016, 46(1): 1-6.
[9]LUCIANI M GHUTCHINS J RZhELEVA Det al.The C-terminal regulatory domain of p53 contains a functional docking site for cyclin A[J].J Mol Biol2000300(3)503-518.
[10]ALSAYEGH K NGADEPALLI V SIYER Set al.Knockdown of CDK2AP1 in primary human fibroblasts induces p53 dependent senescence[J].PLoS One201510(3):e0120782.
[11]LE X FCLARET F XLAMMAYOT Aet al.The role of cyclin-dependent kinase inhibitor p27Kip1 in anti-HER2 antibody-induced G1 cell cycle arrest and tumor growth inhibition[J].J Biol Chem2003278(26)23441-23450.
[12]FEI ZGAO YQIU Met al.Down-regulation of dihydrofolate reductase inhibits the growth of endothelial EA.hy926 cell through induction of G1 cell cycle arrest via up-regulating p53 and p21 (waf1/cip1) expression[J].J Clin Biochem Nutr201658(2)105-113.
(本文编辑:吴昔昔)
The role of Rho guanine nucleotide exchange factor 12 (ARHGEF12) in leukemia cell growth
GAO Li,XIE YangyangWANG XiangTANG YanjingTANG JingyanCHEN JingSHEN Shuhong.Department of Hematology and OncologyShanghai Children's Medical CenterSchool of MedicineShanghai Jiaotong University,Shanghai200127
ObjectiveTo assess the effect of ARHGEF12 on leukemia cell growth and the underlying mechanism.MethodsARHGEF12 expression was determined by quantitative RT-PCR in several leukemia cell lines.Knock-down of LARG was performed with shRNAs in leukemia cell lines and the flow cytometry analysis (FACS) was used to detect the growth and apoptosis of the leukemia cells after LARG silencing.Antibody assay screen of kinase phosphorylation was done to explore the potential mechanism.ResultsKnocking down ARHGEF12 in high expression cells would inhibit cell growthwhich resulted from increased apoptosis and decreased proliferation.Phosphorylation of p53CDK2 and p27 Kip1 were involved in this process.Conclusion:ARHGEF12 is essential for the growth of leukemia cellswith high expression of ARHGEF12downregulation of ARHGEF12 would cause increased cell apoptosis and inhibited cell proliferation as well.
ARHGEF12; leukemia cell; apoptosis
R733.7
ADOI10.3969/j.issn.2095-9400.2016.06.006
2016-02-18
国家自然科学基金资助项目(81270623)。
高莉(1988-),女,江苏苏州人,住院医师,硕士。
沈树红,主任医师,Email:sshfranks@126.com。

