登革病毒HLA-A*0201限制性T细胞表位诱导免疫反应的研究
段志良,李德周,徐娟娟,贾庆军,刘慧芳,陈柏坤,文金生
(1.温州医科大学附属第二医院 医学检验中心,浙江 温州 325027;2.宁波市第二医院 肝病科,浙江 宁波 315000;3.温州医科大学 虫媒病毒研究所,浙江 温州 325035)
登革病毒HLA-A*0201限制性T细胞表位诱导免疫反应的研究
段志良1,李德周2,徐娟娟3,贾庆军3,刘慧芳3,陈柏坤3,文金生3
(1.温州医科大学附属第二医院医学检验中心,浙江温州325027;2.宁波市第二医院肝病科,浙江宁波315000;3.温州医科大学虫媒病毒研究所,浙江温州325035)
目的:探讨登革病毒(DENV)HLA-A*0201限制性T细胞表位诱导DENV血清型间交叉反应性T细胞的效应。方法:基于已鉴定DENV-1中HLA-A*0201限制性CD8+T细胞表位(NS4b40-48TLYAVATTI)序列,合成在其他血清型中相似的候选表位,采用MHC-肽复合物稳定性实验检测候选表位与HLA-A*0201结合力。采用酶联免疫斑点(ELISPOT)实验研究已鉴定表位及候选表位免疫HLA-A*0201转基因小鼠产生的CD8+T细胞识别相同及相似表位能力;采用ELISPOT实验研究不同DENV血清型感染HLA-A*0201转基因小鼠是否产生能识别已鉴定表位及候选表位的T细胞反应。结果:DENV-3中NS4b39-47TLYAVATTV与HLA-A*0201具高结合力,但DENV-2 中NS4b39-47TLYAVATTF与HLA-A*0201结合力弱。DENV-1-NS4b40-48和DENV-3-NS4b39-47免疫的转基因小鼠脾、淋巴结和外周血中存在可识别DENV-1-NS4b40-48、DENV-2-NS4b39-47和DENV-3-NS4b39-47的交叉反应性CD8+T细胞。在DENV-1,-2,-3感染的转基因小鼠体内也存在类似的T细胞反应。结论:DENV-3中NS4b39-47TLYAVATTV为新的CD8+T细胞表位,该表位及已报道表位NS4b40-48TLYAVATTI均可诱导DENV血清型间交叉反应性CD8+T细胞反应,二者有助于我们研究DENV血清型间交叉反应性CD8+T细胞的功能以及用于评估DENV候选疫苗的T细胞免疫效应。
登革病毒;HLA-A*0201;交叉反应性;CD8+T细胞
登革病毒(dengue virus,DENV)包括4个血清型(DENV-1,-2,-3,-4),其翻译3个结构蛋白(C、PrM/M、E)和7个非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5)。全球有36亿人生活在DENV流行区,每年3.9亿人感染DENV[1]。在前期研究中,我们从DENV-1中鉴定出了1条HLA-A*0201限制性CD8+T细胞表位(NS4b40-48TLYAVATTI)[2],通过对比发现:该表位与DENV-4中相同位置肽序列完全一致,而与DENV-2和DENV-3中相同位置的肽序列之间存在一个氨基酸差异。在本研究中,我们将探讨这些肽所诱导的CD8+T细胞之间是否存在交叉反应。
1 材料和方法
1.1材料 前期鉴定的1条CD8+T细胞表位(DENV-1-NS4b40-48TLYAVATTI)和2条候选表位(DENV-2-NS4b39-47TLYAVATTF和DENV-3-NS4b39-47TLYAVATTV)由上海强耀多肽合成公司合成,肽纯度>95%。T2细胞株、白纹伊蚊细胞(C6/36细胞)株和非洲绿猴肾细胞(Vero细胞)株由美国ATCC提供。β2微球蛋白(β2M)由美国Sigma公司提供。HLA-A*0201转基因小鼠[C57BL/6-Tg(HLA-A2.1)1Enge/J小鼠],雌性,30只,6~8周龄,由美国杰克逊实验室提供并在温州医科大学虫媒病毒研究所饲养和繁殖。小鼠随机分成6组(每组5只)用于肽免疫和DENV感染,本实验已经过温州医科大学动物伦理委员会审批同意。FITC标记的抗HLA-A*0201的流式单抗由美国BD公司提供。DENV-1(Hawaii株,标准株)、DENV-2(NGC株,标准株)和DENV-3(H87株,标准株)由美国ATCC提供。小鼠IFN-γ酶联免疫斑点(ELISPOT)试剂盒由荷兰U-CyTech公司提供。
1.2方法
1.2.1MHC-肽复合物稳定性实验:采用流式细胞术检测候选表位与T2细胞株表面HLA-A*0201分子的结合力,参考文献[2]中的方法进行:①实验组T2细胞在含有β2M(3 μg/mL)、不同浓度候选表位(1、10、100 μg/mL)的无血清RPMI-1640培养基中置于37 ℃、5% CO2下培养1 h,接着在26 ℃培养12 h37 ℃培养3 h。背景对照(无肽组)T2细胞采用同样方法培养(含β2M,无肽)。②采用FITC标记的抗HLA-A*0201流式单抗于4 ℃染色T2细胞40 min。③流式细胞仪(BD FACSAria)测定T2细胞平均荧光强度(MFI),采用下列公式计算荧光指数(FI)。肽浓度100 μg/mL时,FI大于1的肽被认为是高结合力肽[2]。

1.2.2肽免疫HLA-A*0201转基因小鼠:每条肽均用于免疫HLA-A*0201转基因小鼠。首先,采用弗氏完全佐剂乳化的肽于小鼠背部皮下多点免疫(每只50 μg)。1周后,采用弗氏不完全佐剂乳化的肽加强免疫小鼠3次(每只50 μg,每次免疫间隔1周)。然后,于末次免疫1周后处死小鼠,收集外周血分离外周血单个核细胞(PBMC),取脾制备脾细胞悬液,取腘窝和锁骨下淋巴结制备淋巴结细胞悬液。最后,采用小鼠IFN-γ ELISPOT试剂检测PBMC、脾细胞、淋巴结细胞中识别相同或相似表位的CD8+T细胞的水平。
1.2.3DENV培养及HLA-A*0201转基因小鼠的感染:分别将DENV-1,-2和-3加入C6/36细胞于37 ℃孵育2 h,弃病毒液、加RPMI-1640维持液后于37 ℃细胞培养箱继续培养。当50%的细胞出现病变时,收集细胞及上清予10 000 r/min离心10 min,收集上清液。采用无菌的0.22 μm过滤器过滤上述上清液以进一步除去细胞碎片,滤过液中含有高纯度的病毒颗粒。利用病毒空斑形成实验在Vero细胞上测定滤过液中病毒效价,采用空斑形成单位(PFU)/mL表示。调整病毒液的PFU后冻存于-80 ℃备用。将DENV-1,-2和-3经小鼠尾静脉注射感染HLA-A*0201转基因小鼠(每只0.5 mL病毒液,含1×107PFU)。DENV感染的第4周,处死小鼠后制备脾细胞悬液。采用IFN-γ ELISPOT实验检测脾细胞中肽特异性分泌IFN-γ的T细胞水平。
1.2.4小鼠IFN-γ ELISPOT实验:参考文献[3]实验方法进行ELISPOT实验。将肽免疫的HLA-A*0201转基因小鼠及DENV感染的HLA-A*0201转基因小鼠的脾细胞(每孔1×105个细胞)、淋巴结细胞(每孔2×105个细胞)和PBMC(每孔5×104个细胞)分别加入预包被的小鼠IFN-γ ELISPOT 96孔板中,设置背景对照孔(无肽)和实验孔(加10 μg/mL相同肽或不同肽);将ELISPOT板置于37 ℃、5% CO2培养箱培养24 h;洗板后每孔加入生物素化的抗小鼠IFN-γ的单抗,于37 ℃孵育1 h;洗板后每孔加入耦联链霉亲合素的辣根过氧化酶(HRP),于37 ℃孵育1 h;洗板后每孔加ACE显色底物,于37 ℃避光反应20 min;将板彻底洗涤并干燥,采用ELISPOT读板仪计数每孔膜上斑点数。1个斑点代表1个斑点形成细胞(SFC),对应于1个肽特异性分泌IFN-γ的T细胞。肽特异性T细胞的频率表示为SFCs/1×105脾细胞或2×105淋巴结细胞或5×104PBMC。
1.3统计学处理方法 采用SPSS17.0软件进行统计学分析。数据采用来表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1肽与HLA-A*0201分子的结合力 如表1所示,Blast检索结果表明NS4b40-48TLYAVATTI在DENV-1和DENV-4中保守性分别为71%和100%。候选表位NS4b39-47TLYAVATTF和NS4b39-47TLYAVATTV在DENV-2和DENV-3中保守性分别为99%和100%。3条肽仅在末尾存在1个氨基酸差异。NS4b40-48TLYAVATTI与HLA-A*0201分子的结合力随肽浓度增加而逐渐增强,当肽浓度达到100 μg/mL时,其FI值大于1(为1.65)。NS4b39-47TLYAVATTV与HLA-A*0201分子结合力更强,其FI值在肽浓度为10 μg/mL和100 μg/mL时分别为1.62和4.85,均大于1。然而,对于NS4b39-47TLYAVATTF而言,尽管其FI值与肽浓度呈正比,但一直小于1。
MHC-肽复合物稳定性实验流式结果如图1所示,T2细胞在无肽、低浓度肽(1 μg/mL)、中浓度肽(10 μg/mL)、高浓度肽(100 μg/mL)的培养基中培养。然后采用FITC标记的抗HLA-A*0201的流式单抗染色细胞,流式细胞仪测细胞MFI值,计算FI值。T2细胞未与肽孵育时,细胞表面HLA-A*0201分子的肽结合凹槽空置,导致该分子容易从细胞表面丢失,细胞的MFI对应于红色峰图。随着肽的添加以及肽浓度的提高,结合肽的HLA-A*0201分子越来越多,流式峰图向右侧偏移。

表1 肽的信息

图1 肽与HLA-A*0201分子的结合力实验
2.2肽免疫HLA-A*0201转基因小鼠诱导T细胞反应
DENV-1-NS4b40-48、DENV-2-NS4b39-47和DENV-3-NS4b39-47分别免疫HLA-A*0201转基因小鼠,采用IFN-γ ELISPOT实验检测脾细胞、淋巴结细胞和PBMC中效应细胞识别相同及相似肽的效应。如图2所示,DENV-1-NS4b40-48免疫小鼠的脾细胞中存在3种肽特异性的T细胞,识别相同肽(DENV-1-NS4b40-48)的T细胞频率[(88±14)SFC/1×105脾细胞]高于识别DENV-2-NS4b39-47的T细胞频率[(68±8)SFC/1×105脾细胞],但低于识别DENV-3-NS4b39-47的T细胞的频率[(109±17)SFC/1×105脾细胞]。3种肽特异性T细胞的频率与无肽组[(2±1)SFC/1×105脾细胞]比较差异均有统计学意义(均P<0.01)。但DENV-2-NS4b39-47免疫小鼠脾细胞中3种肽特异性T细胞频率低,与无肽组比较差异无统计学意义。DENV-3-NS4b39-47免疫小鼠的脾细胞中也存在3种肽特异性的T细胞,识别相同肽(DENV-3-NS4b39-47)的T细胞频率[(28±7)SFC/1×105脾细胞]低于识别DENV-1-NS4b40-48的T细胞的频率[(38±5)SFC/1×105脾细胞],但高于识别DENV-2-NS4b39-47的T细胞频率[(22±5)SFC/1×105脾细胞]。3种肽特异性T细胞的频率与无肽组[(3±2)SFC/1×105脾细胞]比较差异均有统计学意义(均P<0.01)。
如图3所示,DENV-1-NS4b40-48免疫小鼠的淋巴结细胞中存在可识别3种肽的T细胞,识别DENV-1-NS4b40-48的T细胞频率[(123±21)SFC/2×105淋巴结细胞]大于识别DENV-2-NS4b39-47的T细胞频率[(91±12)SFC/2×105淋巴结细胞],但小于识别DENV-3-NS4b39-47的T细胞的频率[(149±25)SFC/ 2×105淋巴结细胞]。3种肽特异性T细胞的频率与无肽组[(4±2)SFC/2×105淋巴结细胞]比较差异均有统计学意义(均P<0.01)。DENV-2-NS4b39-47免疫小鼠的淋巴结细胞中3种肽特异性T细胞频率升高不明显,与无肽组比较差异无统计学意义。DENV-3-NS4b39-47免疫的小鼠的淋巴结细胞中同样存在可识别3种肽的T细胞,识别DENV-3-NS4b39-47的T细胞频率[(42±11)SFC/2×105淋巴结细胞]低于识别DENV-1-NS4b40-48的T细胞频率[(58±7)SFC/2×105淋巴结细胞],但高于识别DENV-2-NS4b39-47的T细胞频率[(33±8)SFC/2×105淋巴结细胞]。3种肽特异性T细胞的频率与无肽组[(5±3)SFC/2×105淋巴结细胞]比较差异均有统计学意义(均P<0.01)。
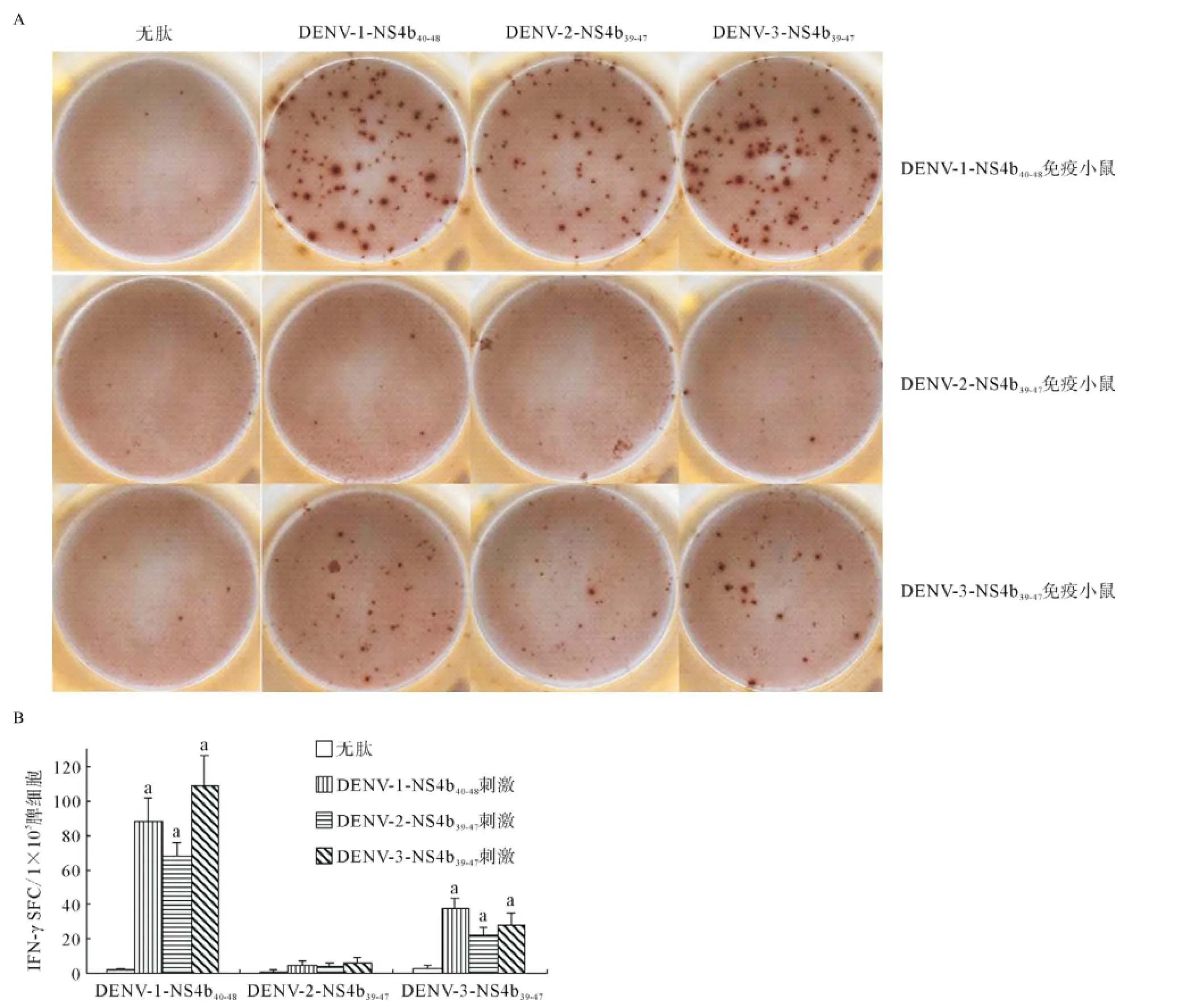
图2 肽免疫的HLA-A*0201转基因小鼠的脾细胞内肽特异性T细胞测定
如图4所示,DENV-1-NS4b40-48免疫小鼠的PBMC中存在可识别3种肽的T细胞,识别DENV-1-NS4b40-48的T细胞频率[(64±9)SFC/5×104PBMC]高于识别DENV-2-NS4b39-47的T细胞频率[(51±6)SFC/5×104PBMC],但低于识别DENV-3-NS4b39-47的T细胞频率[(85±13)SFC/5×104PBMC]。3种肽特异性T细胞的频率与背景对照[(1±1)SFC/5×104PBMC]比较差异均有统计学意义(均P<0.01)。DENV-2-NS4b39-47免疫的小鼠的PBMC中3种肽特异性T细胞频率低,与无肽组比较差异无统计学意义。DENV-3-NS4b39-47免疫小鼠的PBMC中存在可识别3种肽的T细胞,识别DENV-3-NS4b39-47的T细胞频率[(21±6)SFC/5× 104PBMC]低于识别DENV-1-NS4b40-48的T细胞的频率[(29±4)SFC/5×104PBMC],但高于识别DENV-2-NS4b39-47的T细胞频率[(18±4)SFC/5×104PBMC]。3种肽特异性T细胞的频率与无肽组[(2±1)SFC/5× 104PBMC]比较差异均有统计学意义(均P<0.01)。
2.3DENV感染的HLA-A*0201转基因小鼠体内肽特异性T细胞的水平 DENV-1,-2,-3分别感染HLA-A*0201转基因小鼠,然后采用IFN-γ ELISPOT实验检测脾细胞中识别相同及相似肽的T细胞的水平。如图5所示,DENV-1感染的小鼠的脾细胞中存在可以识别3种肽的T细胞,识别DENV-1-NS4b40-48的T细胞频率[(24±5)SFC/1×105脾细胞]低于识别DENV-2-NS4b39-47的T细胞频率[(34±3)SFC/1×105脾细胞],也低于识别DENV-3-NS4b39-47的T细胞的频率[(31±7)SFC/1×105脾细胞],三者与无肽组[(1±1)SFC/1×105脾细胞]比较差异均有统计学意义(均P<0.01)。DENV-3感染的小鼠的脾细胞中存在可以识别3种肽的T细胞,识别DENV-3-NS4b39-47的T细胞频率[(13±2)SFC/1×105脾细胞]高于识别DENV-1-NS4b40-48的T细胞的频率[(10±2)SFC/1×105脾细胞],也高于识别DENV-2-NS4b39-47的T细胞频率[(11±2)SFC/1×105脾细胞],三者与无肽组[(1±1)SFC/1×105脾细胞]比较差异均有统计学意义(均P<0.01)。但DENV-2感染小鼠诱导的肽特异性T细胞反应不明显,与无肽组比较差异无统计学意义。
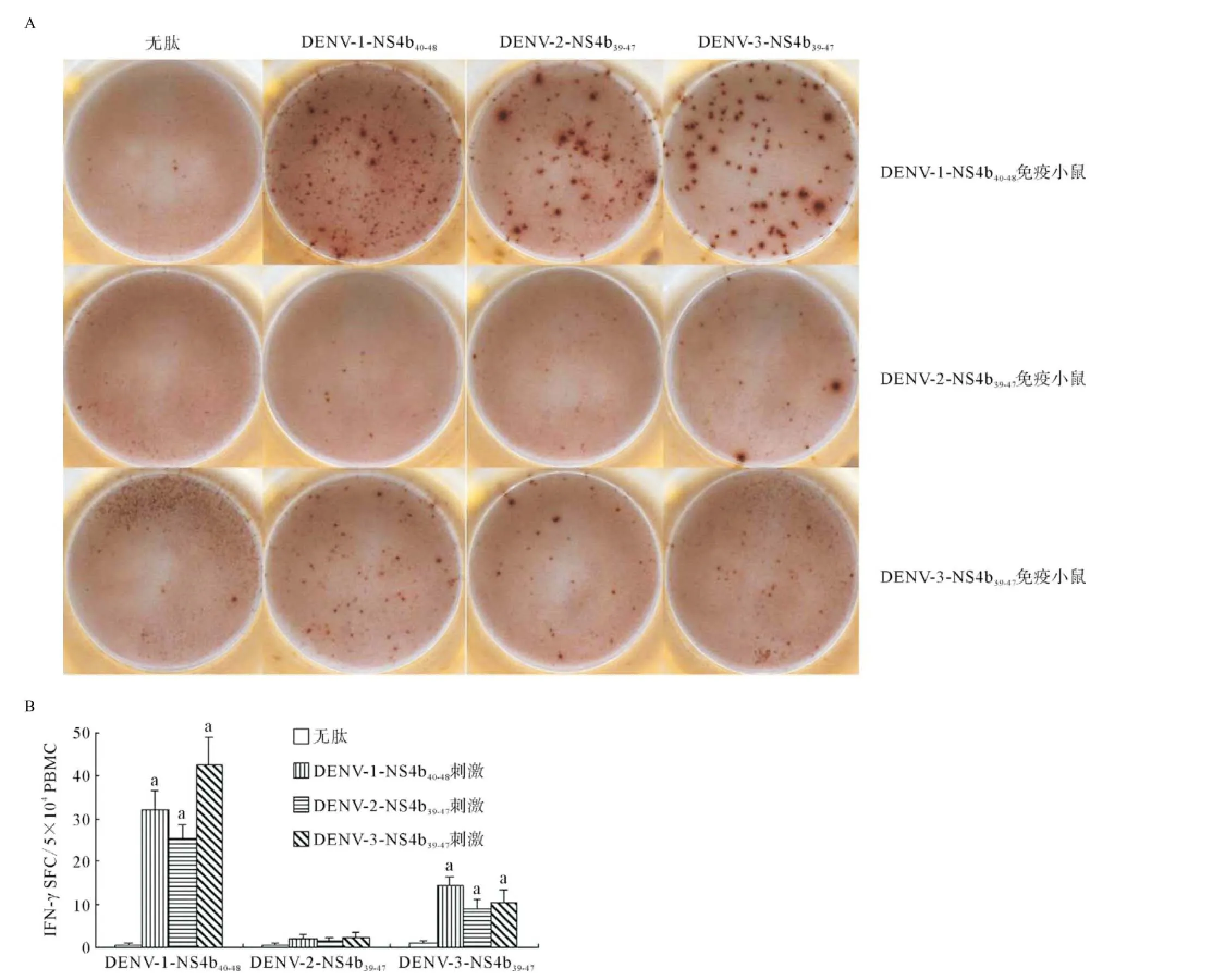
图4 肽免疫的HLA-A*0201转基因小鼠的PBMC内肽特异性T细胞测定
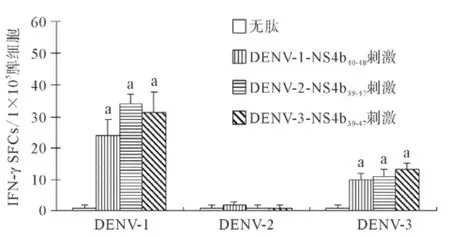
图5 DENV感染的HLA-A*0201转基因小鼠的脾细胞内肽特异性T细胞测定
3 讨论
感染过某种DENV血清型的个体在再次感染不同血清型时易发生登革出血热/登革休克综合征(DHF/ DSS)[4],科学家们认为原始抗原效应(original antigenic sin,OAS)[5]可能介导DHF/DSS发生。该假说认为:体内已存在DENV特异CD8+T细胞在识别相似CD8+T细胞表位时更容易被活化但并不能有效地清除病毒,反而介导病理损伤[6]。但是,研究人员对于CD8+T细胞发挥保护效应还是介导DHF/DSS发生尚有争议[7]。最近研究证明:DENV特异性CD8+T细胞通过分泌IFN-γ或直接杀伤病毒感染的靶细胞而限制DENV感染,发挥免疫保护效应[8-9],而且DENV特异性CD8+T细胞还可以预防DENV二次感染时抗体依赖性增强效应的发生[10]。事实上,由于DENV 4个血清型间氨基酸序列的同源性达到70%以上[11],不同DENV血清型甚至同一血清型中不同病毒株之间仅存在少量位点氨基酸差异(导致相同位置CD8+T细胞表位个别氨基酸位点不同)。因而,某种DENV血清型感染机体诱导产生的CD8+T细胞应该可以分为两群:一群为仅识别该DENV血清型的血清型特异性CD8+T细胞,另一群为可识别多个DENV血清型的交叉反应性CD8+T细胞。上述两群细胞在DENV感染时到底是介导免疫病理损伤还是发挥预防作用还有待深入探讨。CD8+T细胞反应是由CD8+T细胞表位诱导产生的,因此鉴定CD8+T细胞表位对于阐明上述DENV特异性CD8+T细胞的功能是不可或缺的。
CD8+T细胞表位是与人HLA-A或B或C等分子结合的一般含有8~10个氨基酸残基的肽段。HLA的基因具有多态性,其不同等位基因在人群中具有高低不同的百分率。HLA-A*0201、A*1101和A*2402作为HLA-A的广谱性等位基因,其在不同人种、不同肤色人群中均具有较高的人群覆盖性(均大于20%),三者总的人群覆盖率达到80%以上[12]。因此,基于上述等位基因限制的CD8+T细胞表位研究DENV特异性CD8+T细胞的功能具有代表性和普遍意义。
本研究中,我们合成了前期鉴定的HLA-A*0201限制性CD8+T细胞表位(DENV-1-NS4b40-48TLYAVATTI)及在DENV-2和-3中相似的候选表位NS4b39-47TLYAVATTF 和NS4b39-47TLYAVATTV。尽管三者相互之间只有1个氨基酸变异,但MHC-肽复合物稳定性实验结果表明DENV-1-NS4b40-48和DENV-3-NS4b39-47与HLA-A*0201具较高结合力,但DENV-2-NS4b39-47与HLA-A*0201结合力并不强。HLA-A*0201限制性表位的氨基酸序列一般满足以下特点:第2位氨基酸为L或I,第9位氨基酸为L或I或V[13]。显然,DENV-1-NS4b40-48和DENV-3-NS4b39-47均满足以上要求。但DENV-2-NS4b39-47TLY AVATTF中第9位氨基酸(F)不符合要求,其可能解释了为什么该肽与HLA-A*0201结合力较低。IFN-γ是DENV特异性CD8+T细胞分泌的一种可发挥清除DENV作用的细胞因子[14],我们接下来通过检测IFN-γ的分泌来评估上述肽释放可诱导CD8+T细胞反应。肽免疫HLA-A*0201转基因小鼠的实验表明DENV-1-NS4b40-48、DENV-3-NS4b39-47特异性T细胞不但可以识别相同肽,而且还可以识别另外2条相似肽。而且在DENV感染的HLA-A*0201转基因小鼠内我们也观察到了相同的现象:这一方面证明了上述结果,另一方面也表明DENV-1和DENV-3感染小鼠后在其体内翻译的病毒蛋白可被其自身的蛋白酶体加工释放出DENV-1-NS4b40-48和DENV-3-NS4b39-47,后者诱导了T细胞反应。然而,在肽免疫及DENV感染的小鼠体内,我们都没有检测到具有统计学意义的高水平的DENV-2-NS4b39-47特异性T细胞。
综上所述,本研究表明DENV-3-NS4b39-47TLYAV ATTV应该为HLA-A*0201限制性CD8+T细胞表位,DENV-1-NS4b40-48TLYAVATTI和DENV-3-NS4b39-47TLYAVA TTV均可以诱导DENV血清型间交叉反应性T细胞反应。二者将有助于研究DENV特异性T细胞的功能或评估小鼠中DENV候选疫苗的T细胞免疫效应。
[1]BHATT SGETHING P WBRADY O Jet al.The global distribution and burden of dengue[J].Nature2013496 (7446)504-507.
[2]WEN JDUAN ZJIANG L.Identification of a dengue virusspecific HLA-A*0201-restricted CD8(+) T cell epitope[J].J Med Virol201082(4)642-648.
[3]李德周, 段志良, 郭江龙, 等.丙型肝炎病毒CD8+T细胞-Th表位嵌合DNA疫苗的构建和研究[J].温州医科大学学报, 2015, 45(2): 79-84.
[4]GUZMAN M GALVAREZ MHALSTEAD S B.Secondary infection as a risk factor for dengue hemorrhagic fever/ dengue shock syndromean historical perspective and role of antibody-dependent enhancement of infection[J].Arch Virol2013158(7)1445-1459.
[5]MONGKOLSAPAYA JDEJNIRATTISAI WXU X Net al.Original antigenic sin and apoptosis in the pathogenesis of dengue hemorrhagic fever[J].Nat Med20039(7)921-927.
[6]GUY BALMOND J W.Towards a dengue vaccineprogress to date and remaining challenges[J].Comp Immunol Microbiol Infect Dis200831(2-3)239-252.
[7]EDELMAN RHOMBACH J.Guidelines for the clinical evaluation of dengue vaccines in endemic areasummary of a World Health Organization Technical Consultation [J].Vaccine200826(33)4113-4119.
[8]YAUCH L EZELLWEGER R MKOTTURI M Fet al.A protective role for dengue virus-specific CD8+ T cells[J].J Immunol2009182(8)4865-4873.
[9]WEISKOPF DANGELO M ADE AZEREDO E Let al.Comprehensive analysis of dengue virus-specific responses supports an HLA-linked protective role for CD8+ T cells[J].Proc Natl Acad Sci U S A2013110(22)E2046-2053.
[10]ZELLWEGER R MEDDY W ETANG W Wet al.CD8+T cells prevent antigen-induced antibody-dependent enhancement of dengue disease in mice[J].J Immunol2014,193 (8)4117-4124.
[11]IRIE KMOHAN P MSASAGURI Yet al.Sequence analysis of cloned dengue virus type 2 genome (New Guinea-C strain)[J].Gene198975(2):197-211.
[12]CHANG K MGRUENER N HSOUTHWOOD Set al.Identification of HLA-A3 and-B7-restricted CTL response to hepatitis C virus in patients with acute and chronic hepatitis C[J].J Immunol1999162(2)1156-1164.
[13]DUAN Z LLI QWANG Z Bet al.HLA-A*0201-restricted CD8+T-cell epitopes identified in dengue viruses[J].Virol J,20129259.
[14]DIAMOND M SHARRIS E.Interferon inhibits dengue virus infection by preventing translation of viral RNA through a PKR-independent mechanism[J].Virology2001,289(2)297-311.
(本文编辑:吴昔昔)
Study on the ability of dengue virus HLA-A*0201-restricted T-cell epitopes in inducing T cell response
DUAN Zhiliang1LI Dezhou2XU Juanjuan3JIA Qingjun3LIU Huifang3CHEN Bokun3WEN Jinsheng3.1.Department of Laboratorythe Second Affiliated Hospital of Wenzhou Medical UniversityWenzhou325027;2.Department of Liverthe Second Hospital of NingboNingbo315000; 3.Institute of ArbovirusesWenzhou Medical UniversityWenzhou325035
ObjectiveTo explore the ability of dengue virus (DENV)-specific HLA-A*0201-restricted T cell-epitope to induce DENV serotype cross-reactive T cell response.MethodsBased on the sequence of one previously identified DENV-1-specific HLA-A*0201-restricted CD8+T-cell epitope (NS4b40-48TLYAVATTI)the epitope variants in other DENV serotypes were synthesized and their binding affinity for HLA-A*0201 molecule was determined by using MHC-peptide complex stabilization assay.These peptides were used to immunize HLA-A*0201 transgenic miceand the ability of induced CD8+T cells to recognize the same epitope and epitope variant was evaluated by using enzyme-linked immunospot (ELISPOT) assay; Finallyindividual DENV serotype was used to infect HLA-A*0201 transgenic mice and ELISPOT assay was utilized to assess whether the induced CD8+T cells could recognize same epitope or epitope variant.ResultsThe epitope candidate in DENV-3 (NS4b39-47TLYAVATTV) had high affinity for HLA-A*0201 molecule while the epitope candidate in DENV-2 (NS4b39-47TLYAVATTF) bound to HLA-A*0201 molecule with a low affinity.Both DENV-1-NS4b40-48and DENV-3-NS4b39-47elicited DENV serotype cross-reactive CD8+T cells which were distributed in the spleen,lymph nodesperipheral blood of peptide-immunized transgenic mice and could recognize DENV-1-NS4b40-48,DENV-2-NS4b39-47and DENV-3-NS4b39-47simultaneously.Additionallythe same phenomenon was observed inDENV-1-2-3-infected HLA-A*0201 transgenic mice.ConclusionDENV-3-derived NS4b39-47TLYAVATTV is identified as novel CD8+T-cell epitope.Both this epitope and a previously identified epitope (NS4b40-48TLYAVATTI) triggered DENV serotype cross-reactive CD8+T cell responsewhich would help us clarify the function of DENV serotype cross-reactive CD8+T cells and evaluate the immunogenicity of DENV vaccine.
dengue virus; HLA-A*0201; cross-reactive; CD8+T cells
R373.2
ADOI10.3969/j.issn.2095-9400.2016.06.002
2015-09-03
浙江省自然科学基金资助项目(LQ14C010006,LY13H160035);浙江省科技计划项目(Y20140653);国家自然科学基金资助项目(81501363)。
段志良(1976-),女,湖南娄底人,主管技师。
文金生,教授,硕士生导师,Email:wjs78@wmu.edu.cn。

