热疗联合IL-2逆转人肺腺癌细胞A549/CDDP的作用及其可能机制
刘振洋,向 芳,江少锋,沈 华,殷先利
(湖南省肿瘤医院消化泌尿内科,湖南 长沙 410013)
热疗联合IL-2逆转人肺腺癌细胞A549/CDDP的作用及其可能机制
刘振洋,向芳,江少锋,沈华,殷先利
(湖南省肿瘤医院消化泌尿内科,湖南 长沙 410013)
目的观察热疗联合白介素-2(IL-2)对人肺腺癌细胞株A549/CDDP的耐药逆转作用,并探讨其可能作用机制。方法采用细胞培养技术,分别培养人肺腺癌细胞株A549及其耐药细胞株A549/CDDP。42 ℃热疗,联合或不联合200 u·mL-1的IL-2,同时在2 μg·mL-1的CDDP作用下,分别干预敏感细胞株和耐药细胞株2 h后,采用MTT法检测2种不同细胞对CDDP的敏感性,流式细胞仪间接免疫荧光法检测热疗、IL-2等不同条件作用下细胞中P-糖蛋白(P-gp)、多药耐药蛋白(MRP)、肺耐药蛋白(LRP)的表达差异,以及细胞内荧光药物CDDP的聚集量的变化。结果分别联用热疗、IL-2时,较单用CDDP,A549/CDDP细胞的抑制率得到提高,A549/CDDP细胞P-gp、MRP表达下降,细胞内荧光强度增强,差异均有统计学意义(P均<0.05)。热疗联合IL-2合用CDDP时,A549/CDDP细胞的抑制率进一步提高,A549/CDDP细胞P-gp、MRP表达明显下降,细胞内荧光强度显著增强,差异均有统计学意义(P均<0.05),但LRP的表达差异无统计学意义(P>0.05)。结论热疗、IL-2分别能部分逆转A549/CDDP细胞对CDDP的耐药性;热疗联合IL-2可进一步增强其耐药逆转效应。其逆转耐药机制,推测可能与抑制P-gp、MRP表达,增加细胞内药物CDDP的积聚有关。
肺肿瘤;热疗;白介素-2;P-糖蛋白;多药耐药蛋白
[Abstract]ObjectiveTo observe the reversal effect of thermotheapy combined with interleukin-2 (IL-2)on the drug resistance of human lung adenocarcinoma cell line A549/CDDP, and to explore its possible mechanism.MethodsHuman lung adenocarcinoma cell line A549 and its drug resistant cell line A549/CDDP were cultured by cell culture technique.After under the thermotherapy of 42 ℃, combined or not combined with 200 u·mL-1of IL-2, and 2μg·mL-1of CDDP, A549 and A549/CDDP were intervented for 2 hours.The MTT assay was used to detect the sensitivity of cell line A549 and the cell line A549/CDDP to CDDP, respectively.Flow cytometry detection were also employed to determine the P-glycoprotein (P-gp), multidrug resistance protein (MRP), lung resistance protein (LRP)differential expression and CDDP intracellular fluorescence concentration changes in A549 cell line and A549/CDDP cell line before and after the combined treatment, respectively.ResultsWith thermotherapy or IL-2, the inhibition rate of CDDP to A549/CDDP cell line was higher than with CDDP only used, the positive expression rate of p-gp and MRP of A549/CDDP cells decreased, and the intracellular accumulation of CDDP increased, the differences were statistically significant (P<0.05).Thermotherapy combined with IL-2 could further reverse the drug resistance of A549/CDDP cell line, the positive expression rate of P-gp and MRP significantly decreased, and the accumulation of intracellular CDDP increased more significantly (P<0.05).But there was no significant difference for the expression of LRP (P>0.05).ConclusionThermotherapy and IL-2 can partly reverse the drug resistance of human lung adenocarcinoma cell line A549/CDDP to CDDP, and thermotherapy combined with IL-2 can further enhance its reversal effect of drug resistance.The mechanism of reversing drug resistance , presumably, related to inhibition of p-gp, MRP expression, and to increased intracellular accumulation of CDDP.
[Key words]lung neoplasms; thermotherapy; interleukin-2; P-glycoprotein; multidrug resistance protein
化疗耐药是临床恶性肿瘤化疗的难题之一。研究肿瘤多药耐药发生和形成机制,探求逆转肿瘤细胞耐药的方法,克服肿瘤化疗耐药是临床急需解决的重要课题。我们采用体外细胞培养技术,分别培养对肺癌常用的化疗药顺铂(CDDP)敏感的人肺腺癌细胞系A549和对CDDP耐药的人肺腺癌细胞耐药株A549/CDDP。参照我们的前期研究,采用浓度2 μg·mL-1的CDDP,42 ℃热疗联合或不联合200 u·mL-1的白介素-2(interleukin-2,IL-2),作用于2种不同细胞2 h后,检测肿瘤细胞对化疗药物CDDP的敏感性,并检测不同处理条件下,肿瘤细胞中P-糖蛋白(P-glycoprotein,P-gp)、多药耐药蛋白(multidrug resistance protein,MRP)、肺耐药蛋白(lung resistance protein,LRP)等耐药相关蛋白的表达,以及细胞内药物CDDP的聚集量变化。初步探讨热疗联合IL-2对人肺腺癌细胞A549/CDDP耐药性的逆转作用及其作用机制。
1 材料与方法
1.1细胞系和细胞培养人肺腺癌细胞株A549、人肺腺癌细胞耐药株A549/CDDP均购自中南大学湘雅医学院细胞中心。细胞培养技术和过程参考文献[1],细胞在含体积分数10%新生小牛血清的RPMI-1640培养基进行培养,在培养基中加入适量终浓度分别为100 u·mL-1、100 μg·mL-1的青霉素和链霉素,并放置于条件为37 ℃、体积分数5% CO2培养箱中培养。细胞2~3 d换液1次,传代前用质量分数0.25%胰蛋白酶消化2~5 min,3~5 d进行传代。采用恒定药物浓度,周期性作用的方法维持培养A549/CDDP细胞。浓度设定为1 μg·mL-1的CDDP,作用时间48 h;每月加药1次,每次作用时间为48 h,从而形成在1 μg·mL-1CDDP作用下细胞能正常生长的A549/CDDP细胞。
1.2药物和试剂RPMI-1640培养基、磺化丙锭PI购自美国Invitrogen公司;胎牛血清购自美国Gibco公司;EDTA溶液、二甲基亚砜、MTT购自美国Sigma公司;鼠抗人p-gp、MRP、LRP单克隆抗体均购自美国Neomarkers公司;重组IL-2购自上海华新生物有限公司;CDDP注射液购自齐鲁制药有限公司。
1.3实验分组对照组:1)单纯热疗组:热疗温度42 ℃,时间2 h;2)单纯化疗组:CDDP浓度2 μg·mL-1;3)单纯IL-2组:IL-2浓度200 u·mL-1;4)热疗+IL-2组:2 μg·mL-1IL-2+热疗42 ℃×2 h;5)空白对照组:37 ℃下等体积培养基培养细胞,不加药物CDDP或IL-2。
实验组:1)热疗+CDDP组:热疗42 ℃×2 h+2 μg·mL-1CDDP;2)IL-2 + CDDP组:200 u·mL-1IL-2+ 2 μg·mL-1CDDP;3)热疗+IL-2+CDDP联合组:先在培养基中加入浓度同前药物,然后42 ℃加热2 h,最后在37 ℃培养箱中培养24 h。
1.4MTT法将处于对数生长期的细胞取出,消化液常规消化,制成单细胞悬液,细胞密度调整为1×104·mL-1,然后接种于96孔板中,继续培养。培养24 h,待细胞贴壁,按实验的分组设计,需要热疗条件者,放入42 ℃恒温水浴箱2 h;需要加药者,分别加入相应浓度的IL-2和(或)CDDP;每组设置6个复孔,每孔容积为200 μL。待细胞继续生长48 h后,每孔加入20 μL的5 mg·mL-1MTT液,孵育4 h,然后将旧培养基弃去,加入150 μL的DMSO,使用微量震荡器震荡10 min,完全溶解其中的沉淀结晶物。以DMSO调零,酶标仪调定在570 nm波长下,检测96孔板中每孔的吸光度(OD)值。每组重复3次,空白对照孔不加入细胞,只加培养基。计算细胞生长抑制率的公式如下:细胞生长抑制率=(1-实验组平均OD值/对照组平均OD值)×100%,药物作用的半数抑制浓度(IC50)采用直线回归法推算。
1.6荧光分光光度法测定细胞内CDDP积聚量检测肿瘤细胞内的药物CDDP可产生荧光,检测细胞内荧光强度,可以精确反映肿瘤细胞内CDDP浓度。取对数生长的A549细胞和A549/CDDP细胞,放入无血清RPMI-1640培养基,涤洗2次,使细胞悬浮于其中。调定细胞浓度至5×105·mL-1,按实验分组加入相应药物药,并作空白对照。在37 ℃恒温水浴中反复振荡,并分别孵育30 min、60 min、90 min后取样。用预冷生理盐水处理,放置-20 ℃冰箱中冻存。检测前取出融化,超声细胞破碎仪粉碎细胞,最后取上清检测其荧光强度(荧光分光光度法测定条件设定为激发波长470 nm,发射波长585 nm,狭缝15 nm)。每个样本平行检测3份,取其均值,与标准曲线进行比较,Lowry法测定相应的耐药相关蛋白浓度,最终计算出细胞内CDDP浓度。
1.7热疗联合药物的相互作用效应判断作用效应判断采用Burgi修正公式:Q=EA+B/(EA+EB-EA×EB),其中EA、EB分别代表各单处理组的细胞抑制率,EA+B代表联合处理组的细胞抑制率。通过计算,若Q>1.15,判定为协同作用;Q=0.85~1.15,判定为相加作用;Q<0.85,判定为拮抗作用。

2 结果
2.1A549/CDDP细胞对CDDP的敏感性经MTT法检测,CDDP处理A549细胞时,OD值为0.145±0.028,计算IC50为(0.26±0.04) μg·mL-1;CDDP处理A549/CDDP细胞时,OD值为1.632±0.163,IC50为(6.62±0.27)μg·mL-1。耐药指数为25.46。结果显示A549/CDDP细胞对原诱导药物CDDP不敏感,可以用于后续实验。
2.2热疗、IL-2对A549/CDDP细胞增殖的抑制42 ℃热疗2 h,A549/CDDP细胞的抑制率为(6.53±0.27)%; 200 u·mL-1的IL-2,作用于A549/CDDP细胞的抑制率为(5.94±0.35)%;而42 ℃热疗联合200 u·mL-1IL-2时,A549/CDDP细胞的抑制率为(8.22±0.19)%。上述3种处理对A549/CDDP细胞的抑制率与空白对照组差异均无统计学意义(P均>0.05),说明热疗、IL-2及热疗联合IL-2对A549/CDDP细胞无明显抑制作用。
2.3热疗、IL-2联合CDDP对A549/CDDP细胞增殖的抑制42 ℃热疗2 h,联合2 μg·mL-1的CDDP时,A549/CDDP细胞的抑制率为(54.53±1.46)%;200 u·mL-1IL-2联合CDDP时,A549/CDDP细胞的抑制率为(46.47±3.51)%;与单纯化疗组比较,两者抑制率均明显提高,差异均有统计学意义(P均<0.05)。热疗联合IL-2及CDDP时,对A549/CDDP细胞的抑制率进一步提高,高达(80.12±2.71)%,与单纯化疗组、热疗+CDDP组及IL-2+CDDP组比较差异均有统计学意义(P均<0.05)。热疗、IL-2、热疗联合IL-2分别合用CDDP时,A549/CDDP细胞的IC50分别为1.45±0.45、2.16±0.39、0.69±0.08,表明热疗、IL-2均具有一定的化疗增敏作用。应用Burgi修正公式对药物联合作用类型判断,提示热疗、IL-2联用CDDP时,均具有协同作用,Q值分别为4.54、4.07。热疗、IL-2均能增强CDDP对A549/CDDP的抑制作用,一定程度逆转A549/CDDP的耐药性,而热疗联合IL-2能更进一步逆转其对CDDP的耐药性。见表1。
表1热疗、IL-2联合CDDP时
对A549/CDDP细胞的抑制率比较
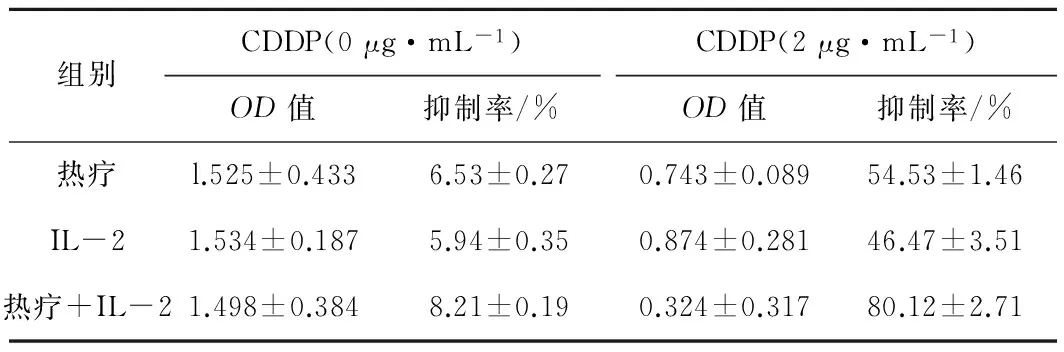
组别CDDP(0μg·mL-1)OD值抑制率/%CDDP(2μg·mL-1)OD值抑制率/%热疗l.525±0.4336.53±0.270.743±0.08954.53±1.46IL-21.534±0.1875.94±0.350.874±0.28146.47±3.51热疗+IL-21.498±0.3848.21±0.190.324±0.31780.12±2.71
2.4A549/CDDP细胞P-gp、MRP、LRP的表达和细胞浆内CDDP的浓度A549细胞的P-gp、MRP、LRP表达阳性率分别为(4.5±0.5)%、(10.2±0.7)%、(15.7±0.61)%,而A549/CDDP细胞表达阳性率分别为(89.4±3.7)%、(35.4±2.9)%、(30.5±2.7)%,可见A549/CDDP细胞P-gp、MRP、LRP表达阳性率较A549细胞增加(P<0.05)。经热疗、IL-2联合CDDP处理A549/CDDP细胞后,P-gp、MRP表达阳性率明显下降(P<0.05),但LRP表达无明显变化,而细胞浆内CDDP的浓度均明显增加。见表2。
表2A549/CDDP细胞P-gp、MRP、LRP的表达及细胞浆内CDDP浓度比较

组别P-gpMRPLRPCDDP荧光CDDP89.4±3.735.4±2.930.5±2.722.73±0.67IL-2+CDDP41.7±4.324.5±4.128.1±3.629.51±2.13热疗+CDDP32.8±2.526.0±2.331.8±2.430.48±1.54热疗+IL-2+CDDP10.2±2.212.5±3.127.9±5.645.67±3.43
3 讨论
肺癌化疗过程中很容易出现化疗耐药,包括原发性耐药和继发性耐药,导致化疗疗效不佳。肺癌细胞多药耐药,对化疗药物不敏感,是影响临床患者近期疗效和远期生存的重要原因之一。寻找理想的高效的逆转多药耐药的药物或新方法,成为目前肿瘤化疗研究的热点[2]。
热疗是通过提高全身或局部温度达到杀灭肿瘤细胞的治疗方法。临床主要作为治疗恶性肿瘤的辅助方法,以选择性杀伤肿瘤细胞,而不影响正常细胞为特点。其抗肿瘤疗效肯定,获得基础和临床研究的证实[3-5]。相关研究提示,热疗能增强化疗药物的细胞毒作用,提高抗肿瘤能力,其主要机制包括:1)加热破坏细胞膜的稳定性,可能抑制P-gp和MRP等耐药相关蛋白的活性,使膜通透性增加,促进化疗药物渗透和吸收[6];2)热疗激活肿瘤细胞凋亡通路,诱导细胞调亡[7]。本实验42 ℃热疗2 h联合2 μg·mL-1CDDP,作用于A549/CDDP细胞后,其抑制率达54.53%。明显高于CDDP对照组。提示热疗能增强A549/CDDP细胞对CDDP的敏感性,从而提高肿瘤细胞抑制率,在一定范围内逆转A549/CDDP细胞的耐药性。
细胞因子,如IL-2、α-IFN,是临床常用免疫治疗药物。IL-2不仅能通过免疫机制增强抗肿瘤作用,而且能逆转肿瘤细胞的多药耐药,恢复肿瘤耐药细胞对化疗药物的敏感性,从而增强化疗的细胞毒作用[8]。IL-2逆转化疗耐药的作用机制可能与抑制多药耐药基因的活性,下调肿瘤耐药相关蛋白的表达,以及激活调亡信号通路、调控癌基因等机制有关[8-9]。Stein等[10]研究提示IL-2干预多药耐药的肿瘤细胞,细胞内多药耐药基因表达和P-gp蛋白水平均下降,细胞内化疗药物ADM、VCR增加,提示IL-2能逆转化疗耐药。Hosten等[11]发现肌注IL-2后,小鼠肠道细胞的P-gp表达明显下降,肠道细胞吸收药物浓度增加。本研究结果显示,在CDDP基础上,IL-2与CDDP联合应用具有协同效应,提示IL-2具有化疗增敏作用。
IL-2能显著增强热疗对肿瘤细胞的抗瘤活性[12];而热疗能够上调IL-2受体,也能增加IL-2表达[13]。热疗联合IL-2,能否增强逆转化疗耐药的作用,值得尝试。本研究采用42 ℃热疗2 h,联合200 u·mL-1浓度IL-2,以2 μg·mL-1的CDDP处理A549/CDDP细胞,抑制率高达80.1%,明显高于单纯化疗,也较热疗或IL-2联合CDDP高。而CDDP的IC50由对照组的6.62 μg·mL-1降至0.69 μg·mL-1,可见热疗联合IL-2明显增强了CDDP抗肿瘤作用,有效逆转了A549/CDDP细胞对CDDP的耐药性。热疗、IL-2均能逆转A549/CDDP细胞的耐药性,而两者联合则能更进一步增强逆转效应。
肿瘤多药耐药发生的原因和机制复杂,还没有明确的结论。肿瘤耐药基因在不同组织中的表达差异性是其可能的分子机制之一。目前研究较多的肺癌耐药基因主要有MRP、LRP、拓扑异构酶等[14]。肺癌肿瘤细胞耐药的最重要机制是肺癌相关耐药蛋白,如P-gp、MRP、LRP等表达增加,促使细胞内药物蓄积减少[15]。P-gp是mdr1基因编码的一种ATP依赖性药物排出性膜泵,其与化疗药物结合后,又与ATP结合而获能,进而将化疗药物泵出肿瘤细胞外,从而导致化疗耐药[16]。MRP基因编码的蛋白同P-gp类似,也具有药物外排泵功能,同时也需ATP供能,可改变细胞内药物浓度的分布,从而导致耐药性的产生[17]。LRP基因编码的不需ATP供能的转运蛋白通过调节囊泡和核质的药物转运,将化疗药物储存于囊泡,并减少化疗药在细胞核与细胞质间的比例而导致耐药[18]。本研究结果显示,A549/CDDP细胞相关耐药蛋白P-gp、MRP、LRP表达均明显高于A549细胞,热疗、IL-2分别联合CDDP处理A549/CDDP细胞后,MRP、P-gp的表达下调,细胞内CDDP荧光增强,但LRP的表达无明显变化。热疗联合IL-2进一步下调MRP、P-gp的表达,显著增强细胞内CDDP荧光强度。因此,我们推测热疗、IL-2能逆转A549/CDDP细胞对CDDP的耐药性,可能与LRP表达无关,而与下调P-gp、MRP等膜转运蛋白的表达,增加细胞膜的通透性,从而增加细胞内化疗药物积聚有关。
[1]陈杰,白春学,钱桂生,黄桂君.A549/CDDP多药耐药细胞系的建立[J].中国癌症杂志,2003,13(2):186-187.
[2]Tang Y,McGoron AJ.Increasing the rate of heating:a potential therapeutic approach for achieving synergistic tumor killing in combined hyperthemia and Chemotherapy[J].Int J Hperthemia,2013,29(2):145-155.
[3]Ahmed K,Zaidi SF.Treating Cancer with heat:hyperthermia as promising strategy to enhance apoptosis[J].J Pak Med Assoc,2013,63(4):504-508.
[4]Wu SK,Chiang CF,Hsu YH,et al.Short-time focused ultrasound hyperthermia enhances liposomal doxorubicin delivery and antitumor erricacy for brain metastasis of breast cancer[J].Int J Nanomedicine,2014,19(9):4485-4494.
[5]Agostinelli E, Belli F, Dalla Vedova L, et al.Hyperthermia enhances cytotoxicity of amine oxidase and spermine on drug-resistant LoVo colon adenocarcinoma cells[J].Int J Oncol,2006,28(6):1543-1553.
[6]Franke K, Kettering M, Lange K,et al.The exposure of cancer cells to hyperthermia, iron oxide nanoparticles, and mitomycin C influences membrane multidrug resistance protein expression levels[J].Int J Nanomedicine,2013,8:351-363.
[7]Wrzal PK, Bettaieb A, Averill-Bates DA.Molecular mechanisms of apoptosis activation by heat shock in multidrug-resistant Chinese hamster cells[J].Radiat Res, 2008,170 (4): 498-511.
[8]Stein U, Walther W.Cytokine-mediated reversal of multidrug resistance [J].Cytotechnology, 1998,27(3):271-282.
[9]Grodzovski I, Lichtenstein M, Galski H, et al.IL-2-granzyme A chimeric protein overcomes multidrug resistance (MDR)through a caspase 3-independent apoptotic pathway[J].Int J Cancer,2011,128(8):1966-1980.
[10]Stein U,Walther W, Shoemaker RH.Modulation of ntdrl expression by cytokines in human colon carcinoma cells: an approach for reversal of multidrug resistance[J].Br J Cancer,1996,74(5):1384-1391.
[11]Hosten B, Abbara C, Cibert M, et al.Interleukin-2 treatment effect on imatinib pharmacokinetic, P-gp and BCRP expression in mice[J].Anticancer Drugs, 2010 ,21 (2):193-201.
[12]Bevanda M, Orsolic N, Basic I, et al.Prevention of peritoneal carcinomatosis in mice with combination hyperthermal intraperitoneal chemotherapy and IL-2 [J].Int J Hyperthermia,2009,25(2):132-140.
[13]Ouyang W, Gao F, Wang L, et al.Thermoseed hyperthermia treatment of mammary orthotopic transplantation tumors in rats and impact on immune function[J].Oncol Rep,2010,24(4):973-979.
[14]Shukla S, Wu CP, Ambudkar SV.Development of inhibitors of ATP-binding cassette drug transporters: preset status and challenges[J].Expert Opin Drug Metab Toxicol,2008,4(2):205-223.
[15]梁燕,张莹,贾英杰.非小细胞肺癌多药耐药机制研究进展[J].山东医药,2013,53(35):102-104.
[16]Alfarouk KO, Stock CM, Taylor S,et al.Resistance to cancer chemotherapy: failure in drug response from ADME to P-gp[J].Cancer Cell Int,2015,15:71.
[17]Cole SP, Deeley RC.Multidrug resistance mediated by the ATP-binding cassette transporter protein MRP[J].Bioessays,1998, 20 (11): 931-940.
[18]Damiani D, Tiribelli M, Raspadori D, et al.The role of MDR-related proteins in the prognosis of adult acute.myeloid leukaemia (AML)with normal karyotype[J].Hematol Oncol, 2007, 25 (1): 38-43.
Effect and Possible Mechanism of Thermotherapy Combined with IL-2 on Reversing the Drug Resistance of the Human Lung Adenocarcinoma Cell Line A549/CDDP
Liu Zhenyang, Xiang Fang, Jiang Shaofeng, Shen Hua, Yin Xianli
(DepartmentofDigestiveandUrinaryMedicine,HunanCancerHospital,Changsha410013,China)
湖南省卫生计生委科研基金资助项目(编号:C2014-36);湖南省中医药科研计划项目(编号:201682)
刘振洋(1970-),男,博士,主任医师,主要从事恶性肿瘤的临床与基础研究。E-mail:1323081926@qq.com
10.3969/j.issn.1673-5412.2016.04.006
R734.2;R730.58
A
1673-5412(2016)04-0299-05
2016-01-22)

