血管内皮生长因子在肝癌血管内皮细胞体外管腔形成中量效和时效局限性的实验研究
赵文静,钱红燕,李 靖,张素青,邵冰锋,张一心,陈建国,杨俐萍
(1.南通大学附属肿瘤医院肿瘤研究所中心实验室,江苏 南通 226361;2.南通大学附属肿瘤医院外科,江苏 南通 226361;3.启东肝癌防治研究所,江苏 南通 226200)
血管内皮生长因子在肝癌血管内皮细胞体外管腔形成中量效和时效局限性的实验研究
赵文静1,钱红燕1,李靖1,张素青2,邵冰锋2,张一心2,陈建国3,杨俐萍1
(1.南通大学附属肿瘤医院肿瘤研究所中心实验室,江苏 南通 226361;2.南通大学附属肿瘤医院外科,江苏 南通 226361;3.启东肝癌防治研究所,江苏 南通 226200)
目的利用体外管腔形成模型,研究血管内皮生长因子(VEGF)对肿瘤血管内皮细胞(TECs)调控的精准性,探讨以VEGF为靶点的抗肿瘤药物在临床应用中出现缺陷的潜在机制。方法采用CD31免疫磁珠分选人肝癌标本中的TECs,在含Matrigel基质胶的96孔板中,分别与不同浓度VEGF共培养,观察不同时间的TECs体外管腔形成能力,以正常人脐静脉血管内皮细胞(HUVECs)为对照。结果1)体外分离培养的TECs拟血管内皮细胞梭状形态,其96%的细胞表达内皮细胞特异性标记CD31;2)TECs在微小量(基础培养条件,2 ng·mL-1)VEGF165时,体外管腔形成较少或不成腔,而对照组HUVECs却能形成明显的管腔并分支成网;当附加10 ng·mL-1VEGF165时,在4 h观察到TECs如同HUVECs形成了管腔,在6 h出现明显的分支网;然而,当附加20 ng·mL-1VEGF165时,在6 h观察到TECs形成的管腔明显减少;统计分析显示,10 ng·mL-1VEGF165组TECs成管能力比2 ng·mL-1VEGF165组高出6倍(P<0.001),而20 ng·mL-1VEGF165组TECs成管能力显著下降至10 ng·mL-1VEGF165组的4.5倍(P<0.001);3)10 ng·mL-1VEGF165组在培养4、6、8 h均可见TECs管腔形成,但以6 h为显著;在20 h时,TECs的管腔消失,而对照组HUVECs却还有明显的管腔分支网。结论肝癌TECs体外管腔形成对VEGF165既有依赖性但又有量-效局限性,过高VEGF浓度能抑制性影响TECs(而不是HUVECs)管腔形成能力。在VEGF的刺激下,TECs体外管腔形成的时效性短于HUVECs。我们的实验结果提示,临床应用抗VEGF的抗肿瘤药物疗效不一可能与VEGF在TECs体外管腔形成的量效和时效的局限性有关。
肿瘤血管内皮细胞;肿瘤血管生成;体外管腔形成;血管内皮生长因子
[Abstract]ObjectiveBased on tube formation model in vitro, to investigate the effects of vascular endothelial growth factor (VEGF) with dose- and time- dependent on the tube formation of tumor-derived endothelial cells (TECs), and to analyze the potential mechanism by which poor outcome of VEGF-target anticancer drug in the clinical application.MethodsIsolation of tumor endothelial cells (TECs, CD31 positive cells) were treated by using CD31- magnetic beadsfrom surgery tumor tissues of the liver cancer patients. Isolated TECs were co-cultured with different concentrations of VEGF165 on the matrigel in the 96-well plates. The tube formation with different concentration of VEGF at several time points was evaluated, respectively. Human umbilical vein endothelial cells (HUVECs) were served as the normal control.Results1) TECs appeared spindle shape under the culture among which 96% of the cells were CD31 positive、CD31 a pan marker of endothelial cells; 2) TECs nearly did not occur tube formation under co-culture with the basic condition containing 2 ng·mL-1VEGF165, while HUVECs showed the capillary tubule-1ike formation as well as a lot of branches. When 10 ng·mL-1VEGF165 was added in the culture, at 4 h TECs alike HUVECs appeared the tube formation that was at 6 h increased by 6 folds comparing to the basic condition culture (P<0.001). Interestingly, when 20 ng·mL-1VEGF165 were added in the culture, at 6 h, TECs occurred a little tube formation that was decreased by 4.5 folds comparing to the co-culture with 10 ng·mL-1VEGF165 (P<0.001). 3) When TECs were co-culture with 10 ng·mL-1VEGF165, tube formation showed at 4 h, 6 h, 8 h at which time point the tube formation in fact appeared reduction, and even disappeared at 20 h, while the clear tubes and branches were still existing in HUVECs control.ConclusionOur data demonstrate that the dose- and time- dependent effectiveness of VEGF on the tube formation of TECs from human liver cancer is limited. The higher concentration of VEGF may inhibit tube formation in vitro of TECs but not HUVECs. The time length of the tube formation is much shorter by TECs than by HUVECs. We proposal a potential mechanism by which poor outcome of VEGF-target anticancer drug in the clinical application may related to VEGF features as mentioned above.
[Key words]tumor endothelial cells; tumor angiogenesis; tube formation in vitro; vascular endothelial growth factor
正常人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)肿瘤血管在肿瘤的生长和转移中起着至关重要的作用。当肿瘤直径大于2 mm时,新生血管出现,为大量增殖的肿瘤细胞提供氧气和营养物质,最终导致肿瘤组织的增大以及肿瘤细胞的转移。Folkman[1]首次提出通过阻断肿瘤血管的生成可以抑制肿瘤的生长及转移,引申出肿瘤“饥饿疗法“的概念。因此,研究肿瘤血管的生物学特性以及发生的机制对恶性肿瘤的生长、发展、侵袭、转移以及临床治疗具有重要的价值。
血管生成受促进与抑制因子2个方面调控。在促血管生成的因子中,最为关注的是血管内皮生长因子(vascular endothelial growth factor,VEGF)及血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)。VEGF与其血管细胞上的受体结合,引起细胞分裂、增殖及迁移,从而在肿瘤组织中出现新生血管生成,以满足肿瘤细胞生长对氧和营养物质的需要。因此VEGF及其受体在肿瘤血管生成过程中起着至关重要的作用[2]。VEGF是一个多成员的家族,包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E以及胎盘生长因子等,其中VEGF-A对血管内皮细胞具有特异性的作用。VEGF-A家族经剪接后有5种不同的单体,根据氨基酸的数目分别命名为VEGF121、VEGF145、VEGF165、VEGF189、VEGF206,其中VEGF165是分泌性蛋白质,能与内皮细胞上的VEGFR2结合。由于cDNA扩增丰度中以VEGF165最高,所以VEGF165是实验中应用最多的一种VEGF单体[3]。VEGF-A通过结合内皮细胞膜上的2个受体酪氨酸激酶,即VEGFR1和VEGFR2,主要是VEGFR2介导发挥作用[4]。受体VEGFR2激活时触发几个信号通路激活,包括磷酸肌醇3-激酶(PI3K)/AKt,以及丝裂原活化蛋白激酶(MAPK)的级联途径[5]。
值得一提的是,尽管VEGF及其受体作用的研究已很多,并且以VEGF及其受体为靶点的抗肿瘤药物贝伐单抗已在临床上广泛应用。然而,既往的实验性研究大多是正常情况下观察VEGF对在体血管通透性的改变以及离体血管内皮细胞的生长、凋亡等方面的作用[6],而对VEGF在肿瘤来源的血管内皮细胞生物学行为的影响以及后者对VEGF反应的特征,迄今为止尚未有报道。体外血管内皮细胞生物学特性的改变可以通过管腔形成模型、划痕迁移等来检测[6],利用这些模型深入研究VEGF对血管(尤其是肿瘤血管)的作用以及特征,无疑对更进一步地完善VEGF作用的研究有极大的价值。
组织形态和整体功能的研究表明,肿瘤血管与正常血管是不同的。从形态上看,肿瘤血管表现为异型分支、不完整内皮、缺乏功能平滑肌,从功能上,肿瘤血管通透性明显增高,这些特征被描述为肿瘤微血管构筑表型异质性[7]。因此,既往基于正常血管内皮细胞的研究结果所得出来的关于异常血管调节的结论显然是不精准的。利用分离纯化肿瘤组织中的血管内皮细胞来研究VEGF的作用,将对已“既定”的理论提供“校正”是很有必要的。同时,也为解释临床上应用血管靶向抗肿瘤药物出现疗效不一而找到可能的原因和机制。
目前对在体外VEGF对肿瘤血管内皮细胞(tumor-drived endothelial cells,TECs)的生物学行为的作用及其特性尚不完全明了。本研究采用从肝癌提取并纯化TECs,结合血管内皮细胞体外管腔形成模型,观察TECs管腔形成对VEGF依赖性的特征,进一步探索VEGF功能的本质,为阐明VEGF对肿瘤血管生成以及调控提供实验数据,为临床靶向血管抗肿瘤药物的应用提供理论基础。
1 资料与方法
1.1肿瘤标本及单细胞悬液的制备标本来自南通市肿瘤医院肝癌手术切除的新鲜组织,并经过患者签订知情同意书和医学伦理委员会获准。将切除的肝癌标本立即放入20 mL预冷PBS(含体积分数5%胎牛血清、质量分数1%青链霉素双抗)的试管中。漂洗组织块中的组织液和血细胞后移至培养皿中剪切成1~2 mm3碎块。移入10 mL 预热的质量分数0.5% Ⅰ、Ⅳ型胶原酶混合Hank’s溶液中终止消化后,用不机械研磨,用70 μm细胞滤器过滤细胞悬液,在单细胞悬液中加入DNase酶,以防止细胞黏成团,计数。
1.2免疫磁珠分选每60 μL(1×106个)细胞悬液加入40 μL CD31免疫磁珠混合液(德国Miltenyi Biotech公司),置于旋转混匀机,4 ℃孵育20 min;将LS Column装在磁珠铁架磁性区上,磁柱中加入3 mL的抽气PBS,冲洗湿润,排除磁柱中的空气,将待分选的细胞加入过柱,收集通过磁柱的CD31阴性细胞,用3 mL PBS洗涤柱子3次,将柱子移出磁铁并置于15 mL试管,用柱芯压出积存在柱子里的CD31阳性细胞,4 ℃,1 000 r·min-1,离心8 min,弃去上清,进行培养流程。
1.3原代培养将TECs放入基础培养条件中,即含体积分数5%胎牛血清,质量分数1%青霉素、链霉素,质量分数1%血管内皮细胞生长添加剂(其成分含2 ng·mL-1VEGF)的内皮细胞完全培养基(美国ScienCell公司),移至T25培养瓶,置于37 ℃、质量分数5% CO2孵箱中培养。
1.4流式细胞仪分析当培养细胞扩增至80%的融合度,质量分数0.025%胰酶消化,收集细胞放入试管中,用PBS清洗,应用荧光PE标记的CD31抗体(美国BD公司,克隆:WM59)对细胞进行染色,4 ℃孵育20 min,清洗(3 000 r·min-1、4 ℃离心4 min),弃去上清,PBS重悬并加入到流式管,BD FACSAriaⅡ流式细胞仪(美国BD公司)分析。
1.6体外管腔形成Matrigel胶(美国Corning公司)4 ℃过夜溶解,预先冷却96孔板和移液枪头,冰上操作,4 ℃环境下96孔板每孔加入50 μL胶,置于37 ℃孵育30 min。每孔加入4×104个细胞,37 ℃、体积分数5% CO2孵箱中培养,分别于4 h、6 h、8 h、20 h显微镜下观察成管现象。以Image Pro Plus 6.0软件分析管腔形成差别。

2 结果
2.1肝癌TECs体外培养及鉴定光学显微镜拍摄不同来源的血管内皮细胞即新鲜肝癌组织标本的血管内皮细胞和正常血管内皮细胞。HUVECs呈典型铺路石形态,肝癌组织提取的TECs呈长梭形、铺路石状及不规则等多种形态。流式细胞仪检测显示有96% TECs表达CD31,荧光显微镜分析显示几乎所有TECs呈红色荧光标记的CD31阳性细胞,与蓝色DAPI标记细胞核重合时,可见CD31表达定位于细胞膜,提示所分离出来的细胞有血管内皮细胞的表型,并且纯度很高。见图1。
2.2肝癌TECs体外管腔形成对VEGF的依赖性原代细胞经传代培养后与基质胶(支撑作用)共培养,在基础培养条件(含质量分数1%血管内皮细胞生长添加剂的内皮细胞培养基)下,分别观察4 h、6 h、8h、20 h时间点的毛细管腔样的结构。结果发现:TECs组在体外任何一个时间点的管腔形成都很少或几乎未见管腔;而有趣的是,在HUVECs组可见清晰的管腔形成并且排成网状,从摄像开始的4 h就出现管腔,6 h增加,管腔持续到20 h时仍能明显见到。提示足以刺激HUVECs体外成管的微小剂量VEGF(2 ng·mL-1)对TECs成管不敏感。进一步,当在基础培养条件下加入10 ng·mL-1VEGF165,发现TECs与HUVECs一样都有管腔形成,但管腔纤细。这些发现提示了TECs体外管腔形成对VEGF的量存在依赖性,10 ng·mL-1VEGF可以促进TECs体外成腔。
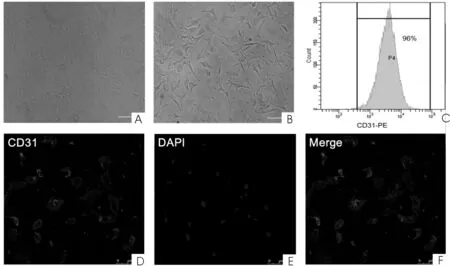
图1 体外培养原代肝癌TECs及其表型鉴定
光学显微镜(×100)观察培养细胞的形态,A:HUVECs;B:原代培养肝癌TECs;C:流式细胞仪定量分析内皮细胞标记CD31在TECs的表达;D、E、F:激光共聚焦显微镜(×400)分析TECs表面CD31的表达。红色(Dylight-649)代表CD31,蓝色(DAPI)示细胞核
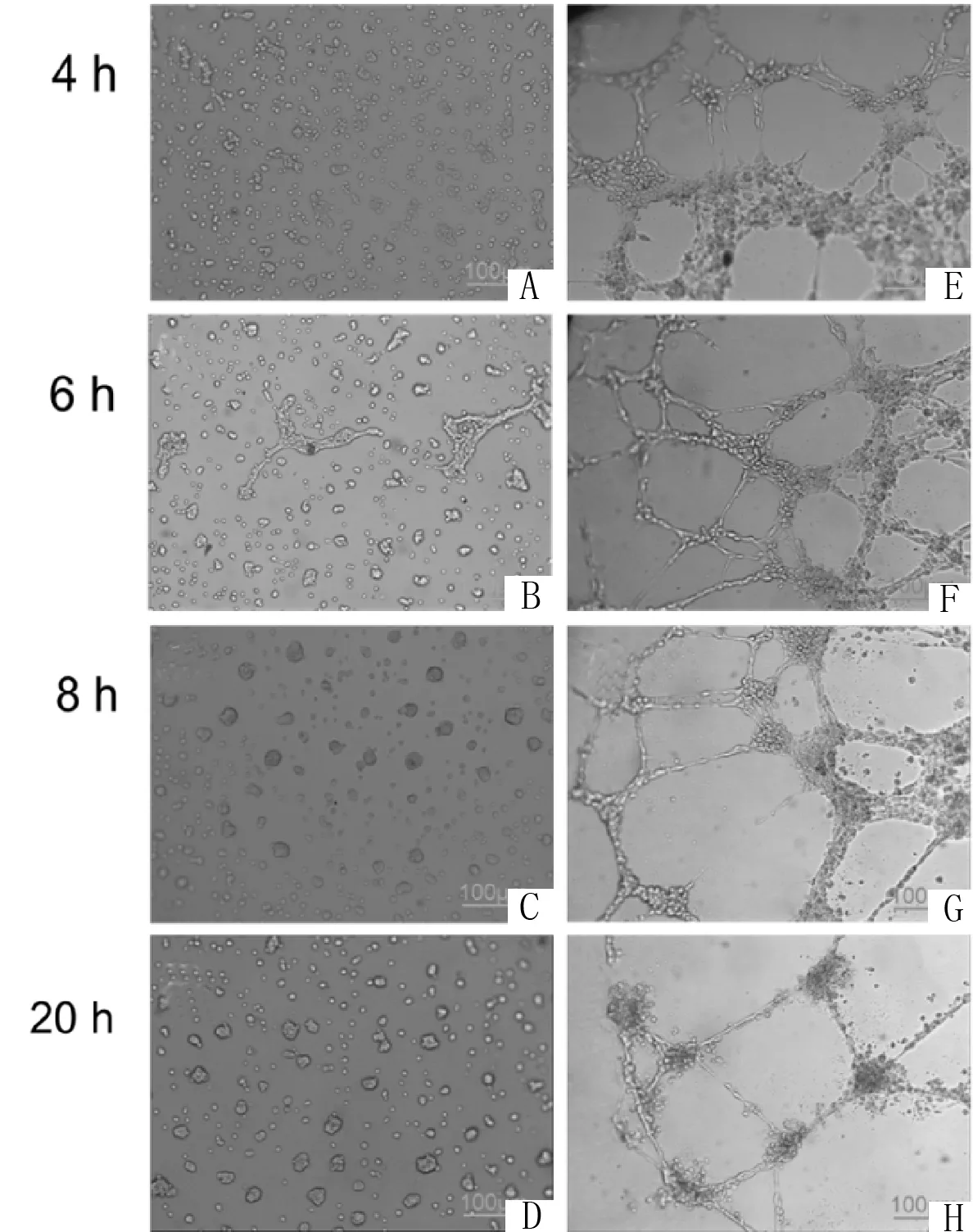
图2 TECs和HUVECs在基础培养条件下的管腔形成
在基础培养条件(含2 ng·mL-1VEGF165)下,分别在4 h、6 h、8 h、20 h用光学显微镜(×100)观察TECs(A~D)及HUVECs(E~H)的管腔形成,其中TECs为第7~9代
2.3VEGF刺激TECs体外管腔形成的时效性当在基础培养条件下加入10 ng·mL-1VEGF165,发现TECs如同HUVECs,在观察的时间4 h时就有管腔形成,6 h时管腔样结构增粗,呈完整网状,然而在8 h时部分管腔萎缩,20 h时管腔样结构完全消失,聚集成细胞团。而对照组HUVECs类似于在基本培养条件下的管腔形成,在4~8 h内,管腔样结构越来越清晰并形成网状,20 h时管腔结构仍然清晰可见。这些结果提示,即便在一定量的VEGF存在下,TECs与HUVECs体外管腔形成在时间上也有区别,TECs形成的管腔持续时间短,在6 h观察最佳,随后逐渐萎缩消退,说明TECs体外管腔形成对VEGF的依赖是有时效性的。
2.4VEGF刺激肝癌TEC管腔形成的量-效局限性在基础培养条件中加入10 ng·mL-1VEGF165,发现TECs组出现管腔形成,由此是否认为TECs的管腔与VEGF量存在量-效依赖关系,即随药物浓度的增加而管腔增多。将TECs分为3组不同浓度的VEGF培养,结果发现,在6 h时,基础培养条件(VEGF 2 ng·mL-1)管腔形成极少;10 ng·mL-1VEGF165组的TECs成管明显,并且管腔增多至对照组的6倍(P<0.001);20 ng·mL-1VEGF165组出现管腔明显减少,虽然该组比基础培养条件组的成管略为增多,但是比10 ng·mL-1VEGF165组减少4.5倍(P<0.001),提示,TECs成管形成不是随VEGF浓度增加而增多,而存在量-效局限性关系,即TECs对微小浓度VEGF无效应,相反对高浓度VEGF的效应也减弱,在最适浓度为10 ng·mL-1的VEGF刺激下,在最佳时间6 h观察到的管样结构最明显。

图3 TECs管腔形成对VEGF的依赖性及时效性
在基础培养条件(含2 ng·mL-1VEGF165)附加10 ng·mL-1VEGF165情况下,分别在4 h、6 h、8 h、20 h用光学显微镜(×100)观察TECs(A~D)及HUVECs(E~H)的管腔形成,其中TECs为第7~9代

图4 不同浓度VEGF对TECs管腔形成的影响
在基础培养条件(2 ng·mL-1VEGF165)(A)、基础培养条件+ 10 ng·mL-1VEGF165(B)、基础培养条件+20 ng·mL-1VEGF165(C)的原代TECs管腔形成以及各组比较的柱形统计图(D)。采用光学显微镜观察(×100),其中TECs为第7~9代,fold表示对照组的倍率
3 讨论
新生血管形成在恶性肿瘤生长发展以及转移中起重要作用。研究发现,肿瘤血管存在构筑表型异质性。此外还发现,肿瘤组织中肿瘤细胞自身形成管脉系统,被称为拟态血管,即不依赖于内皮细胞的增生而构建拟血管壁结构的管状网络形成模式[8]。由此可见,肿瘤血管与正常血管是有区别的,而既往对肿瘤血管生成过程和调控的理解是基于正常血管的实验数据,这显然是不精准的。面对这个缺陷,首先是要解决TECs的分离提取问题。CD31是一种介导内皮细胞间黏附分子,对维持血管内皮细胞间的连接及维持血管完整性具有重要作用[9],因此CD31被认为是血管内皮细胞的泛标记。我们采用CD31免疫磁珠分选技术,从血管丰富器官的肝脏癌组织中提取TECs并用流式细胞仪进一步纯化,通过形态学、表型以及功能进行鉴定确认。目前研究血管的生理和病理以及药物作用的体外血管生成,通常是用基质胶作半固体立体支撑,将观察的细胞与基质胶共培养,观察细胞从单个状态变成串珠样管状结构的体外管腔形成模型,主要分为二维血管和三维血管的培养方式,二维血管指细胞在胶体表面上形成的管样结构,三维血管指细胞侵入胶体基质形成的管样结构[10]。在观察我们分离出来的肝癌TECs的生物学特性时,将HUVECs作平行对照,结果提示两者确实有区别,例如在体外管腔形成的活性方面:在基础培养条件20 h内,HUVECs出现明显的管腔形成,并且分支成网,而肝癌TECs的成腔很少或不能成腔。
肿瘤新生血管生成过程受局部微环境的影响,肿瘤微环境是由肿瘤细胞、血管内皮细胞、成纤维细胞、免疫细胞和细胞外基质共同构成[11],其中细胞外基质,包括促进和抑制血管生成调节因子。血管生成促进因子和血管生成抑制因子依照"开关平衡假说",对血管生成调控使之増生维持在一定生理范围内[12]。当促血管因子增加和(或)抑制血管因子减少时,将导致血管新生。促进血管生成的因子主要为VEGF、成纤维细胞生长因子、转化生长因子、血小板源性生长因子、血管生成素,其中VEGF的促血管生成功能已得到公认[13]。抑制因子有血管抑素、内皮抑素、凝血酶蛋白-1等,其中内皮抑素是一个有明显抗肿瘤血管作用的内源性血管形成抑制因子[14-15]。
VEGF家族中发挥生物学效应的主要成分是VEGF165,是VEGF-A中最丰富的异构体,VEGF165高效特异作用于血管内皮细胞,能强烈促进分裂并具有趋化作用,能增强微血管通透性,使得血浆纤维蛋白外渗,为血管形成过程中多种细胞迁移提供一个纤维网络。可以直接刺激内皮细胞发生增殖并产生纤维蛋白溶酶原激活剂和胶原酶,主要通过内皮细胞上的特殊受体的作用,促进内皮细胞移动和血管生成[16]。然而,既往对VEGF的研究没有详细阐述VEGF对肿瘤血管作用的精准性。我们的实验结果表明,TECs在体外管腔形成中对VEGF存在依赖性但又是量-效局限性,另外还有时效性等非线性的特点。在微小剂量(2 ng·mL-1)存在的基础培养条件下,VEGF不足以促使TECs形成管腔,而附加10 ng·mL-1的VEGF165,在4 h时即可观察到TECs出现较完整的管腔结构,在6 h时管腔增粗,但从8 h起成管边缘毛糙,萎缩,至20 h则完全消失。这些现象说明,肿瘤血管体外成管对VEGF的依赖性,而且肿瘤血管生成需要高于正常剂量的VEGF存在。有趣的是,当细胞在基质胶培养时间延长,TECs的成管逐渐减少至消失,而HUVECs仍能见明显的管腔形成,提示VEGF在TECs体外成管的作用是有时效性的特点,这很可能是VEGF由于代谢使局部有效浓度降低,不足以刺激管腔形成。值得一提的是,虽然TECs对VEGF存在依赖性,但当增加VEGF浓度时,TECs管腔形成反而减弱,提示管腔形成效率并非随着VEGF浓度的增加而增强,而存在VEGF效应的最适浓度,对此我们提出“VEGF与管腔形成效应的量-效局限性”假说。这个现象存在的可能机制是,高浓度的外源VEGF影响了VEGF与VEGFR2结合的亲和力。有资料报道,加入外源性的50 ng·mL-1的VEGF-A能够显著抑制VEGFR2的表达,并且两者结合亲和力降低,致使VEGFR-2及其下游信号通路的活化受到抑制,导致了内皮细胞的分化、增殖、迁移和毛细血管管腔的形成受阻[17-18]。
综上所述,VEGF是TECs体外管腔形成必不可少的细胞因子,然而两者的关系并非呈简单的线性关系。当VEGF浓度偏低或偏高,基质胶培养中的TECs都不能形成明显的管腔和网状结构。在我们的实验中发现,在基础培养条件中附加10 ng·mL-1的VEGF165出现肝癌TECs成管的最佳状态,但是当增加1倍浓度时,管腔形成又受到抑制。对此,我们提出TECs的管腔形成是VEGF依赖性的,但又是量-效局限性的假说。此外,在最适浓度VEGF存在下体外TECs管腔形成的时效性远远短于HUVECs。归纳VEGF的这些特征,我们引申出一些VEGF应用的问题:临床上应用VEGF分子靶向抗血管生成的抗肿瘤药物常出现疗效不一是否与VEGF的最适浓度相关,也就是说,由正常血管研究出来的血管靶向药物可能存在剂量不足,不能够完全阻断VEGF的作用。同时我们也推测,体内肿瘤血管生成是在肿瘤微环境持续性地释放促血管生成因子作用下发生,其过程远比体外实验复杂得多,因此,我们需要把VEFG对体外TECs成管的特殊关系在动物实验中加以证实。
[1]Folkman J. Tumor angiogenesis: therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[2]邹容,赵萍萍, 陈熙,等. 血清VEGF-A及其受体VEGFR-2水平与鼻咽癌患者淋巴转移的关系[J].肿瘤基础与临床,2012,25(3):204-207.
[3]Guzmán-Hernández ML, Potter G, Egervári K, et al.Secretion of VEGF-165 has unique characteristics, including shedding from the plasma membrane[J].Mol Biol Cell,2014 ,25(7):1061-1072.
[4]Zhang Z, Neiva KG, Lingen MW, et al. VEGF-dependent tumor angiogenesis requires inverse and reciprocal regulation of VEGFR1 and VEGFR2[J].Cell Death Differ,2010,17(3):499-512.
[5]Xiao F, Qiu H, Zhou L, et al. WSS25 inhibits Dicer, downregulating microRNA-210, which targets Ephrin-A3, to suppress human microvascular endothelial cell (HMEC-1) tube formation[J].Glycobiology,2013,23(5):524-535.
[6]Gerber HP, Dixit V, Ferrara N. Vascular endothelial growth factor induces expression of the antiapoptotic proteins Bcl-2 and A1 in vascular endothelial cells[J]. J Biol Chem,1998,273(21):13313-13316.
[7]Ping YF, Zhang X, Bian XW. Cancer stem cells and their vascular niche: Do they benefit from each other?[J].Cancer Lett, 2015 May 12.[Epub ahead of print]
[8]Seftor RE, Hess AR, Seftor EA,et al. Tumor cell vasculogenic mimicry: from controversy to therapeutic promise[J].Am J Pathol,2012,181(4):1115-1125.
[9]Newman DK, Fu G, Adams T,et al. The adhesion molecule PECAM-1 enhances the TGF-β-mediated inhibition of T cell function[J].Sci Signal,2016,9(418):ra27.
[10]Arutyunyan I, Fatkhudinov T, Kananykhina E,et al. Role of VEGF-A in angiogenesis promoted by umbilical cord-derived mesenchymal stromal/stem cells: in vitro study[J].Stem Cell Res Ther,2016,7:46.
[11]Nyberg P, Salo T, Kalluri R. Tumor microenvironment and angiogenesis[J].Front Biosci,2008,13:6537-6553.
[12]Hanahan D, Christofori G, Naik P, et al.Transgenic mouse models of tumour angiogenesis: the angiogenic switch, its molecular controls, and prospects for preclinical therapeutic models[J]. Eur J Cancer,1996,32A(14):2386-2393.
[13]Xu L, Duda DG, di Tomaso E,et al. Direct evidence that bevacizumab, an anti-VEGF antibody, up-regulates SDF1alpha, CXCR4, CXCL6, and neuropilin 1 in tumors from patients with rectal cancer[J].Cancer Res,2009,69(20):7905-7910.
[14]赵文静,杨俐萍.肿瘤血管多样性的形成及其研究意义[J].肿瘤学杂志,2015,21(6):507-511.
[15]Javaherian K, Lee TY, Tjin Tham Sjin RM, et al. Two Endogenous Antiangiogenic Inhibitors, Endostatin and Angiostatin, Demonstrate Biphasic Curves in their Antitumor Profiles[J].Dose Response,2011,9(3):369-376.
[16]Sugihara T, Wadhwa R, Kaul SC, et al. A novel alternatively spliced form of murine vascular endothelial growth factor, VEGF 115[J].J Biol Chem,1998,273(5):3033-3038.
[17]E G, Cao Y, Bhattacharya S,et al. Endogenous vascular endothelial growth factor-A (VEGF-A) maintains endothelial cell homeostasis by regulating VEGF receptor-2 transcription[J]. J Biol Chem,2012,287(5):3029-3041.
[18]Stefanini MO, Wu FT, Mac Gabhann F, et al. The presence of VEGF receptors on the luminal surface of endothelial cells affects VEGF distribution and VEGF signaling[J].PLoS Comput Biol,2009,5(12):e1000622.
Effect of Vascular Endothelial Growth Factor with a Dose- and Time-effectiveness Limitation on Angiogenesis in Vitro of Tumor Endothelial Cells Derived from Human Liver Cancer
Zhao Wenjing1,Qian Hongyan1, Li Jing1, Zhang Suqing2, Shao Bingfeng2, Zhang Yixin2, Chen Jianguo3, Yang Liping1
(1.KeyLaboratoryofCancerResearchCenter,theAffiliatedTumorHospitalofNantongUniversity,Nantong226361,China;2.DepartmentofSurgery,theAffiliatedTumorHospitalofNantongUniversity,Nantong226361,China;3.QidongLiverCancerInstitute,Nantong226200,China)
国家自然科学基金面上项目(编号:81272378);南通市应用研究计划项目(编号:BK2014036); 南通市卫计委青年基金资助项目(编号:WQ2014048)
赵文静(1987-),女,硕士,主要从事肿瘤血管生成相关研究。E-mail: wenjingvivian@163.com
杨俐萍(1958-),博士,教授,主要从事肿瘤血管生成相关研究。E-mail: Liping.yang@ntu.edu.cn
10.3969/j.issn.1673-5412.2016.04.003
R735.7;R730.23
A
1673-5412(2016)04-0284-07
2016-03-23)

