miR-206抑制SDF-1/CXCR4信号活化诱导的乳腺癌细胞迁移和增殖
葛 新,曹 章,吕鹏威,李靖若,谷元廷
(郑州大学第一附属医院乳腺外科,河南 郑州 450052)
miR-206抑制SDF-1/CXCR4信号活化诱导的乳腺癌细胞迁移和增殖
葛新,曹章,吕鹏威,李靖若,谷元廷
(郑州大学第一附属医院乳腺外科,河南 郑州 450052)
目的研究miR-206在乳腺癌细胞中的作用及其机制。方法MDA-MB-231细胞分别转染miRNA-NC和miR-206 mimic后,荧光显微镜观察转染效率。同时,细胞添加不同剂量(20 ng·mL-1和40 ng·mL-1)基质细胞衍生因子1(SDF-1)处理,利用Transwell法检测细胞迁移,噻唑蓝(MTT)法检测细胞增殖,qRT-PCR法检测细胞中CXC趋化因子受体4(CXCR4)mRNA表达水平,Western blot检测细胞中CXCR4蛋白表达水平。结果miRNA-NC组和miR-206 mimic组细胞转染效率分别为(83.4±6.3)%和(87.6±8.3)%。与对照组比较,SDF-1显著促进细胞迁移和增殖(P<0.05)。miR-206 mimic转染明显抑制细胞迁移和增殖(P<0.05)。SDF-1处理促进细胞中CXCR4 mRNA和蛋白的表达水平(P<0.05)。miR-206 mimic转染则抑制CXCR4蛋白表达水平(P<0.05),但不影响CXCR4 mRNA表达(P>0.05)。结论miR-206通过抑制CXCR4表达拮抗SDF-1诱导乳腺癌细胞迁移和增殖作用。
miR-206;乳腺癌;基质细胞衍生因子-1;CXC趋化因子受体4;迁移;增殖
[Abstract]ObjectiveTo explore the role of miR-206 in the breast cancer cells as well as its mechanism.MethodsFollowing the transfection of miRNA-NC and miR-206 mimic into MDA-MB-231 cells,the transfection efficiency was observed with a fluorescent microscope.Meanwhile,these cells were conditioned with different doses(20 ng·mL-1and 40 ng·mL-1) of stromal-derived factor-1(SDF-1).Cell migration was evaluated by Transwell assay.Cell proliferation was determined by MTT assay.The mRNA expression of CXC chemokine receptor 4(CXCR4) was analyzed by qRT-PCR method.Protein expression of CXCR4 was analyzed by Western blot.ResultsThe transfection efficiency of the miRNA-NC group and the miR-206 mimic group was (83.4±6.3)% and (87.6±8.3)%.Compared with the control group,SDF-1 significantly promoted cancer cells migration and proliferation(P<0.05).Transfection of miR-206 mimic markedly inhibited cancer cells migration and proliferation(P<0.05).SDF-1 conditioning enhanced the mRNA and protein expression of CXCR4 in cancer cells(P<0.05).Transfection of miR-206 mimic constrained CXCR4 protein expression(P<0.05),but did not influence its mRNA expression(P>0.05).ConclusionmiR-206 counteracted the role of SDF-1 in inducing breast cancer cell migration and proliferation through regression of CXCR4 expression.
[Key words]miR-206; breast cancer; stromal-derived factor-1; CXC chemokine receptor 4; migration; proliferation
微小RNA(microRNAs,miRs)是一种进化上保守的、长度约为22个核苷酸的非编码RNA,能够通过序列互补的方式在转录后水平上调控基因的表达[1]。miR-206在多种恶性肿瘤中具有重要的肿瘤抑制作用,包括胃癌[2]、结直肠癌[3]和乳腺癌[4]等。miR-206能够直接靶向抑制肌动蛋白结合蛋白基因的表达、重塑微丝形态、抑制三阴性乳腺癌细胞迁移[5]。我们前期研究[6]也发现miR-206可以直接靶向抑制PFKFB3分子,影响乳腺癌细胞糖酵解过程以及细胞增殖和迁移。基质细胞衍生因子(stromal-derived factor-1,SDF-1),也称为CXC趋化因子配体12,其跨膜信号由一个G蛋白偶联受体CXC趋化因子受体4(CXC chemokine factor receptor 4,CXCR4)介导[7],能激活细胞内多个信号通路,进而调控细胞内钙通量、趋化、转录以及细胞存活[8]。国内有研究[9]发现三阴性乳腺癌组织中SDF-1和CXCR4的表达是患者预后的重要生物学指标。本研究拟通过研究miR-206对SDF-1作用下乳腺癌细胞行为的影响,旨在探索miR-206在乳腺癌临床治疗中的作用,为乳腺癌的生物治疗提供实验证据。
1 材料与方法
1.1实验材料MDA-MB-231细胞购自于美国模式培养物保藏所;胎牛血清、DMEM培养基、Trizol试剂盒、噻唑蓝(MTT)、二甲基亚砜、硝酸纤维素膜购自大连宝生物公司;重组人SDF-1购自上海沪震生物科技有限公司;miRNA-NC和miR-206 mimic购自上海吉玛制药技术有限公司;Lipofectamine2000、DNA Engine OpticonTM2荧光检测系统和DyNAmo SYBR Green qPCR 试剂盒购自美国Invitrogen公司;抗CXCR4单克隆抗体和酶标羊抗鼠二抗购自美国Sigma公司。
1.2实验方法
1.2.1细胞培养与分组处理将MDA-MB-231细胞孵育于体积分数10%胎牛血清的DMEM培养基中,置于37 ℃恒温、体积分数5% CO2的饱和湿度培养箱中培养。将细胞随机分为对照组、SDF-1A组、SDF-1B组、miRNA-NC组、miR-206 mimic组。SDF-1A组和SDF-1B组细胞分别用20 ng·mL-1和40 ng·mL-1SDF-1处理12 h,对照组细胞用等体积的PBS处理,miRNA-NC组和miR-206 mimic组细胞分别转染miRNA-NC和miR-206 mimic 24 h后,添加40 ng·mL-1SDF-1处理12 h。
1.2.2miR-206 mimic转染miRNA-NC和miR-206 mimic干粉离心后配制成终浓度为20 mol·L-1的工作液铺板,24 h内进行转染,按照Lipofectamine2000说明书进行转染,转染6 h后换液,继续培养24 h后荧光显微镜下观察转染效率。
1.2.3Transwell法检测细胞迁移MDA-MB-231细胞转染48 h后,用胰蛋白酶消化细胞,细胞计数3×105,转移至Transwell上层小室中,每孔铺200 μL细胞,加入200 μL无血清培养基。下层板孔中加入600 μL完全培养基,37 ℃、体积分数5% CO2培养箱中培养24 h,随后取出小室用体积分数90%乙醇固定,质量分数0.1%结晶紫溶液染色,置于显微镜下观察并拍照,随机选取4个低倍视野(×100)进行细胞计数,并计算平均值。
1.2.4MTT法检测细胞增殖收集对数生长期细胞,按每孔3×104个接种于96孔培养板。细胞达到80%融合时用于MTT实验。MTT实验检测分别在细胞培养24 h、48 h、72 h、96 h 后进行。按实验分组情况,每孔加入 20 μL MTT(5 mg·mL-1)后培养4 h。去掉上清,按照每孔150 μL加入二甲基亚砜。混匀后用酶标仪测定(测量波长为570 nm)。实验重复3次,取平均数作为实验结果。
1.2.5qRT-PCR检测利用Trizol试剂盒提取培养细胞系总RNA,按照步骤反转录合成cDNA。查找Genbank序列设计并合成CXCR4基因引物序列,上游引物:5’-GGT GGT CTA TGT TGG CGT CT,下游引物: 5’-TGG AGT GTG ACA GCT TGG AG-3’。采用DNA Engine OpticonTM2荧光检测系统和DyNAmo SYBR Green qPCR 试剂盒进行基因表达的测定。反应体系为25 μL,其中12.5 μL DyNAmo SYBR Green qPCR mix,0.5 μL 20 pmoL引物,2 μL cDNA模板(<10 ng·mL-1)。反应条件为:94 ℃预变性10 min,94 ℃ DNA变性20 s,引物在54 ℃退火30 s,72 ℃延伸30 s,36个循环,72 ℃后延伸10 min。熔解曲线的制作条件为65~95 ℃,每0.2 ℃停留1 s。目的基因和 β-actin基因的拷贝数分别根据产生的Ct值从各自的标准曲线获得。取3次重复的平均值,靶基因的相对表达量的计算由目的基因的拷贝数除以β-actin的拷贝数。


2 结果
2.1miR-206转染MDA-MB-231细胞情况miR-206 mimic及miRNA-NC转染MDA-MB-231细胞后,荧光显微镜下可观察到细胞内的荧光信号(图1),则视为转染成功。通过细胞计数可得,miRNA-NC组和miR-206 mimic组转染效率分别为(63.4±6.3)%和(67.6±8.3)%。

图1 荧光显微镜观察miRNA-NC和
2.2miR-206拮抗SDF-1诱导的乳腺癌细胞迁移情况与对照组细胞比较,20 ng·mL-1SDF-1(SDF-1A组)和40 ng·mL-1SDF-1(SDF-1B组)处理明显促进肿瘤细胞体外迁移(P<0.05);与SDF-1A组及SDF-1B组比较,miR-206 mimic+SDF-1处理显著降低细胞迁移(P<0.05),而miRNA-NC+SDF-1则无影响(P>0.05)。见图2、3。

图2 Transwell法检测MDA-MB-231细胞的体外迁移

图3 MDA-MB-231细胞体外迁移定量分析
与对照组比较,1)P<0.05;与SDF-1A组比较,2)P<0.05;与miRNA-NC比较,3)P<0.05
2.3miR-206拮抗SDF-1诱导的乳腺癌细胞增殖情况与对照组细胞比较,SDF-1A组和SDF-1B组细胞增殖速率显著升高(P<0.05);miR-206 mimic转染后,细胞增殖速率降低(P<0.05),而转染miRNA-NC则不能改变细胞增殖速率(P>0.05)。见图4。
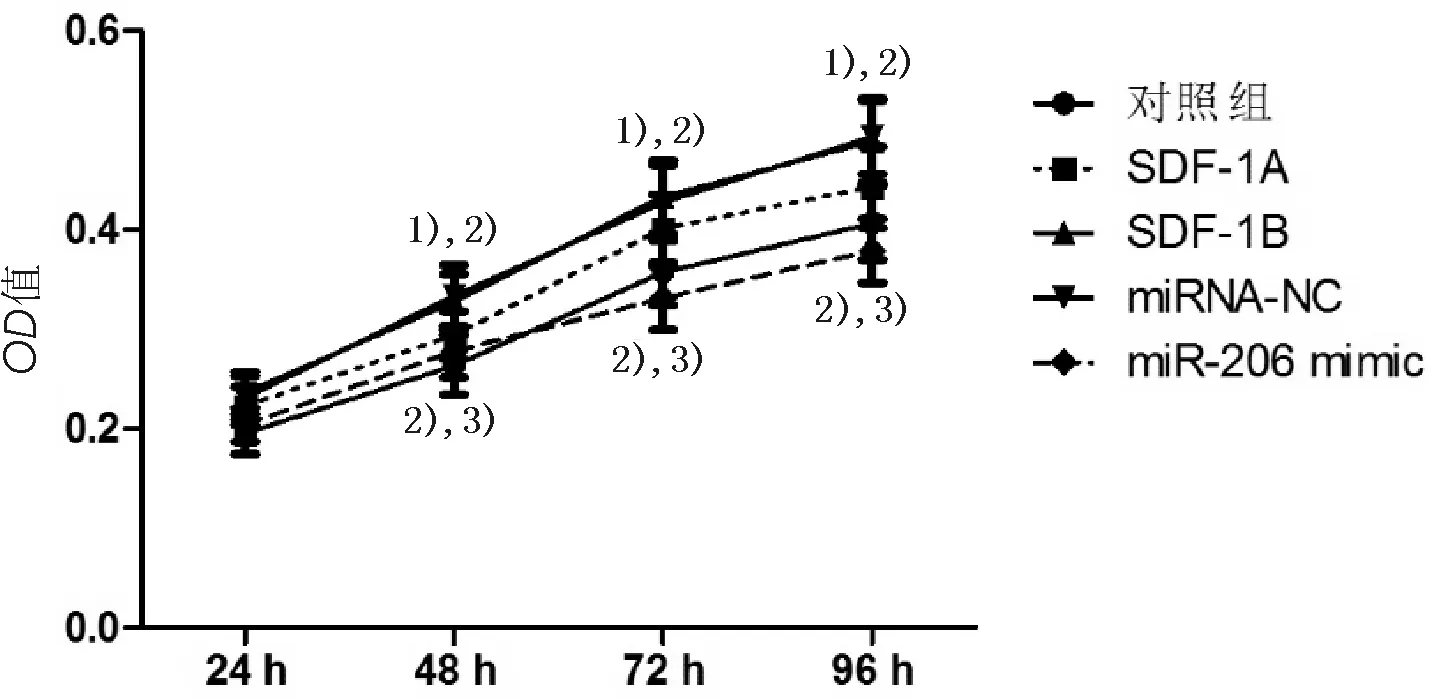
图4 MTT法检测MDA-MB-231细胞增殖
与对照组比较,1)P<0.05;与SDF-1A组比较,2)P<0.05;与miRNA-NC比较,3)P<0.05
2.4miR-206对乳腺癌细胞CXCR4 mRNA表达的影响qRT-PCR法检测各组细胞CXCR4 mRNA的表达,结果显示,SDF-1A组和SDF-1B组细胞CXCR4 mRNA明显高于未经处理的对照组细胞(P<0.05);转染miRNA-NC和miR-206 mimic对CXCR4 mRNA的表达无显著影响(P>0.05)。见图5。
2.5miR-206对乳腺癌细胞中CXCR4蛋白表达的影响Western blot检测细胞CXCR4蛋白的表达,结果显示,对照组细胞比较,SDF-1处理显著促进MDA-MB-231细胞中CXCR4蛋白的表达(P<0.05);但是,转染miR-206 mimic显著抑制细胞中CXCR4蛋白的表达(P<0.05),转染miRNA-NC则不能对CXCR4的表达产生显著影响(P>0.05)。见图6、7。

图5 qRT-PCR技术检测
与对照组比较,1)P<0.05;与SDF-1A组比较,2)P<0.05

图6 Western blot检测

图7 CXCR4蛋白条带定量分析
与对照组比较,1)P<0.05;与SDF-1A组比较,2)P<0.05;与miRNA-NC比较,3)P<0.05
3 讨论
研究[10]显示miRNA调控细胞内基因的表达,既可以作为乳腺癌促癌基因也可以作为抑癌基因。促癌miRNA在乳腺癌细胞中表达上调,并能够抑制下游许多与肿瘤抑制相关的基因的表达,例如原肌球蛋白1、程序性细胞凋亡因子4、同源性磷酸酶-张力蛋白、和金属蛋白酶组织抑制因子等[10]。相反,肿瘤抑制miRNA则可以靶向抑制促癌基因,当它们功能缺失时,则可能导致细胞癌变[10]。miR-206是一种抑癌基因,其表达下调与多种恶性肿瘤的发生相关,其中包括乳腺癌[11]、胃癌[12]等。因此,研究miR-206在乳腺癌细胞中的作用机制具有重要的临床意义。本研究利用miRNA-NC和miR-206 mimic体外转染MDA-MB-231乳腺癌细胞,荧光显微镜下观察,转染效率可分别达(63.4±6.3)%和(67.6±8.3)%,因此可用于下一步研究,探索miR-206对肿瘤细胞的表达调控。
趋化因子家族是结构上相关、具有4个保守半胱氨酸位点的趋化性细胞因子,能够与7次跨膜的G蛋白偶联受体结合[13]。SDF-1是最先发现的与发育相关的趋化因子,具有调控造血作用、心脏发生、血管形成和神经形成的功能[13]。近年来,研究[14]发现SDF-1在肿瘤疾病进展中具有重要作用,利用SDF-1处理小鼠乳腺癌细胞可显著促进细胞增殖和迁移。本研究首先利用2个不同剂量的SDF-1处理MDA-MB-231细胞,Transwell实验结果发现这2个剂量的SDF-1均可促进细胞迁移,且具有剂量依赖性,验证了趋化因子SDF-1对乳腺癌细胞的作用。然而,当细胞转染miR-206 mimic时,细胞迁移受到明显抑制,而转染miRNA-NC则不影响细胞迁移,说明了miR-206可以拮抗SDF-1诱导的迁移作用。本研究同时检测了SDF-1对细胞增殖的影响。MTT实验结果表明,2个剂量的SDF-1均可显著促进细胞增殖,其中高剂量组作用最明显。与转染miRNA-NC比较,转染miR-206 mimic后,细胞增殖速率显著降低,说明了miR-206具有拮抗SDF-1诱导癌细胞增殖的作用。
CXCR4是趋化因子SDF-1的经典受体。SDF-1与CXCR4相互作用可活化下游多条信号转导通路以及效应因子,从而介导细胞存活、增殖、趋化、迁移和粘附等细胞行为[15]。詹升华等[16]研究发现CXCR4表达于乳腺癌组织和乳腺癌细胞株中,SDF-1可有效促进乳腺癌细胞的体外增殖和迁移。通过查阅TargetScan数据库发现CXCR4是miR-206的潜在靶分子之一。因此本研究猜测miR-206可能通过直接调控CXCR4的表达来影响其配体SDF-1的作用。利用qRT-PCR法检测乳腺癌细胞中mRNA的表达,结果发现SDF-1处理可以显著促进细胞中CXCR4 mRNA的表达;转染miRNA-NC以及miR-206 mimic后,细胞中CXCR4 mRNA表达水平没有明显变化,说明miR-206不影响CXCR4的转录水平。随后研究进一步利用Western blot法检测细胞中CXCR4蛋白的表达。与mRNA水平类似,SDF-1可以提高乳腺癌细胞中CXCR4蛋白水平;然而转染miR-206 mimic后,CXCR4蛋白的表达水平受到显著抑制,转染miRNA-NC则无此作用,说明了miR-206对CXCR4表达的调控发生在转录后水平。
综上所述,本研究发现miR-206可通过抑制乳腺癌细胞中CXCR4的表达、拮抗SDF-1诱导的细胞增殖和迁移作用。本研究局限于体外实验,在之后研究中需要更多的体内实验和临床数据证明miR-206通过CXCR4发挥肿瘤抑制作用,从而为乳腺癌的靶向治疗提供实验证据。
[1]O’day E,Lal A.MicroRNAs and their target gene networks in breast cancer[J].Breast Cancer Res,2010,12(2):201.
[2]Yang Q,Zhang C,Huang B,et al.Downregulation of microRNA-206 is a potentprognostic marker for patients with gastric cancer[J].Eur J Gastroenterol Hepatol,2013,25(8):953-957.
[3]Parasramka MA,Dashwood WM,Wang R,et al.A role for low-abundance miRNAs in colon cancer:the miR-206/Kruppel-like factor 4(KLF4) axis[J].Clin Epigenetics,2012,4(1):16.
[4]Li Y,Hong F,Yu Z.Decreased expression of microRNA-206 in breast cancer and its association with disease characteristics and patient survival[J].J Int Med Res,2013,41(3):596-602.
[5]Wang J,Tsouko E,Jonsson P,et al.miR-206 inhibits cell migration through direct targeting of the actin-binding protein coronin 1C in triple-negative breast cancer[J].Mol Oncol,2014,8(8):1690-1702.
[6]Ge X,Lyu P,Cao Z,et al.Overexpression of miR-206 suppresses glycolysis,proliferation and migration in breast cancer cells via PFKFB3 targeting[J].Biochem Biophys Res Commun,2015,463(4):1115-1121.
[7]Bleul CC,Farzan M,Choe H,et al.The lymphocyte chemoattractant SDF-1 is a ligand for LESTR/fusin and blocks HIV-1 entry[J].Nature,1996,382(6594):829-833.
[8]Scala S.Molecular Pathways:Targeting the CXCR4-CXCL12 Axis--Untapped Potential in the Tumor Microenvironment[J].Clin Cancer Res,2015,21(19):4278-4285.
[9]孔令禹,付勤烨.SDF-1、CXCR4在三阴性乳腺癌组织中的表达及其与患者预后的相关性[J].山东医药,2014,54(38):22-25.
[10]Zhang K,Zhang Y,Liu C,et al.MicroRNAs in the diagnosis and prognosis of breast cancer and their therapeutic potential(review)[J].Int J Oncol,2014,45(3):950-958.
[11]Sasaki A,Tsunoda Y,Tsuji M,et al.Decreased miR-206 expression in BRCA1 wild-type triple-negative breast cancer cells after concomitant treatment with gemcitabine and a Poly(ADP-ribose) polymerase-1 inhibitor[J].Anticancer Res,2014,34(9):4893-4897.
[12]Zhang L,Xia L,Zhao L,et al.Activation of PAX3-MET pathways due to miR-206 loss promotes gastric cancer metastasis[J].Carcinogenesis,2015,36(3):390-399.
[13]Nagasawa T.CXC chemokine ligand 12(CXCL12) and its receptor CXCR4[J].J Mol Med(Berl),2014,92(5):433-439.
[14]Wani N,Nasser MW,Ahirwar DK,et al.C-X-C motif chemokine 12/C-X-C chemokine receptor type 7 signaling regulates breast cancer growth and metastasis by modulating the tumor microenvironment[J].Breast Cancer Res,2014,16(3):R54.
[15]Xu C,Zhao H,Chen H,et al.CXCR4 in breast cancer:oncogenic role and therapeutic targeting[J].Drug Des Devel Ther,2015,9:4953-4964.
[16]詹升华,邓敏,顾冬梅,等.CXCR4/SDF-1α信号对乳腺癌细胞的体外增殖和迁移的促进作用[J].山东医药,2011,51(32):13-15.
MiR-206 Suppresses Breast Cancer Cell Migration and Proliferation Induced by SDF-1/CXCR4 Signaling
Ge Xin,Cao Zhang,Lv Pengwei,Li Jingruo,Gu Yuanting
(DepartmentofBreastSurgery,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
葛新(1981-),女,博士,主治医师,主要从事乳腺疾病基础和临床研究。E-mail:gexin1981@126.com
谷元廷(1965-),男,博士,主任医师,主要从事乳腺疾病基础和临床研究。E-mail:zzyuantinggu@126.com
10.3969/j.issn.1673-5412.2016.04.005
R737.9;R730.23
A
1673-5412(2016)04-0294-05
2016-07-06)

