液相色谱-串联质谱联用法测定人血浆中头孢地尼的浓度及生物等效性研究
汪难喜,翟学佳,朱超然,陈 芬,张新林,吕永宁
(华中科技大学同济医学院附属协和医院药剂科,湖北 武汉 430022)
·论著·
液相色谱-串联质谱联用法测定人血浆中头孢地尼的浓度及生物等效性研究
汪难喜*,翟学佳,朱超然,陈芬,张新林,吕永宁#
(华中科技大学同济医学院附属协和医院药剂科,湖北 武汉430022)
目的:建立液相色谱-串联质谱联用法(liquid chromatography-tandem mass spectrum,LC-MS/MS)测定人血浆中头孢地尼的浓度,评价健康人餐后服用2种头孢地尼颗粒的生物等效性。方法:24例男性健康志愿者餐后随机交叉单剂量口服头孢地尼颗粒受试制剂或参比制剂,LC-MS/MS法测定头孢地尼体内血药浓度。采用药动学软件DAS对其药动学参数及等效性进行计算和评价。结果:头孢地尼在10.14~1 267.50 ng/ml质量浓度范围内线性良好(r>0.999),最低下限为10.14 ng/ml;日内、日间精密度RSD分别≤1.78%、3.75%。受试制剂和参比制剂的主要药动学参数包括: 药-时曲线下面积(AUC)0~t分别为(4 284.81±1 150.02) 和(4 479.97±1 333.70) μg·h/L,AUC0~∞分别为(4 425.56±1 173.44) 和(4 632.83±1 369.83) μg·h/L,半衰期分别为(1.81±0.25)和(1.83±0.26) h,达峰时间分别为(3.70±0.71)和(3.73±0.51) h,峰浓度分别为(814.67±250.92)和(870.80±281.99) ng/ml。结论:该方法分析快速、灵敏、准确,适用于人血浆中头孢地尼浓度的测定,可成功用于头孢地尼颗粒生物等效性的评价。
头孢地尼颗粒; 液相色谱-质谱/质谱联用; 生物等效性; 药动学
头孢地尼具有抗菌谱广、不良反应少的特点,临床上广泛用于上、下呼吸道感染和泌尿道感染的治疗[1-3]。其对各种细菌产生的β-内酰胺酶稳定,对革兰阳性菌中的葡萄球菌属、链球菌属等的抗菌活性比第1、2代口服头孢菌素更强[4-5]。近年来,国内外对头孢地尼血浆浓度的测量方法有高效液相色谱-紫外分光光度法和液相色谱-串联质谱联用法(liquid chromatography-tandem mass spectrum,LC-MS/MS)等[6-11],但都存在一定的局限性,如样本处理过程复杂[7]、采用比较昂贵的固相萃取法[8]或检测时间长[9-10]等。本研究建立了快速、灵敏、准确的LC-MS/MS法测定头孢地尼血浆浓度,并应用于受试和参比制剂头孢地尼颗粒在健康人体餐后的药动学和生物等效性研究,以期为临床用药提供参考。
1 材料
1.1仪器
Agilent 1200型高效液相色谱仪,含在线脱气机(G1322A)、高压四元泵(G1311A)、自动进样器(G1329A)、柱温箱(G1316A);API 4000 型四级杆串联质谱仪(美国ABI公司),配备电喷雾离子化源(ESI);色谱工作站: Analyst 1.6.1;AUW220D型天平(日本岛津公司)。
1.2药品与试剂
受试制剂:头孢地尼颗粒(批号:311130108,规格:50 mg/袋) 由石家庄华新药业有限责任公司提供;参比制剂:头孢地尼颗粒(批号:025310;规格:100 mg/袋)购自日本藤泽公司;头孢地尼标准对照品(批号:130502-201403,含量为98%)、头孢克洛标准对照品(批号: 130481-200503,含量为93.2%) 由中国食品药品检定研究院提供。
2 方法与结果
2.1色谱条件
分析柱:Waters AtlantisTMdC18柱 (2.1 mm×150 mm,5 μm),预柱:Phenomenex C18保护柱(4 mm×3.0 mm,5 μm);流动相 ∶甲醇-0.3%甲酸水溶液(V∶V=38 ∶62);洗脱方式:等度洗脱;流速: 0.3 ml/min;进样量: 10 μl;柱温:40 ℃;进样器温度:4 ℃。
质谱采用正离子电喷雾离子源,以多反应监测方式进行定量分析。离子喷射电压:5 500 V;温度:550 ℃;源内气体1压力:344.75 kPa;气体2压力:344.75 kPa;气帘气压力:172.37 kPa;碰撞气压力:41.37 kPa;扫描方式为质谱多反应监测;头孢地尼和内标头孢克洛在正离子模式下定量分析离子对分别为:396.2→227.1和368.1→174.2,解簇电压分别为60 和69 V,碰撞能量分别为19和18 V,离子扫描质谱图见图1。

图1 头孢地尼(A)与内标头孢克洛(B)的二级全扫描质谱图Fig 1 Representative product ion scan spectra of cefdinir (A) and cefaclor (B) in positive ionization mode
2.2对照品溶液的配制
2.2.1头孢地尼储备液:精密称定头孢地尼对照品9.75 mg,置于10 ml容量瓶中,用10 mmol/L的乙酸铵溶液溶解并定容,得到975 μg/ml头孢地尼的储备液,于4 ℃冰箱保存备用,使用时进一步稀释至浓度适当的工作液。
2.2.2头孢克洛(内标)储备液:精密称定头孢克洛对照品,加10 mmol/L的乙酸铵溶液溶解并稀释至刻度,制备成132 μg/ml的头孢克洛储备液,于4 ℃冰箱保存备用,使用时用10 mmol/L的乙酸铵溶液稀释成5 280 ng/ml的内标工作液。
2.3血浆样品的处理
精密吸取血浆200 μl,加入内标工作液20 μl(头孢克洛,5 280 ng/ml),加入10 mmol/L的乙酸铵溶液20 μl,涡旋30 s混匀,再加入500 μl甲醇沉淀蛋白,涡旋1 min,14 800 r/min转速下离心15 min,取上清液用等量10 mmol/L的乙酸铵溶液溶稀释,涡旋30 s混匀、14 800 r/min转速下离心5 min,取上清进行分析,并记录色谱图。
2.4专属性试验
分别取6批空白血浆、血浆加对照品、服药后的血浆样品,按照“2.3项”下操作,在“2.1项”的条件下,头孢地尼与内标的保留时间分别为2.6、2.8 min,见图2。血浆中内源性物质均不干扰样品峰,方法专属性良好。
2.5基质效应与提取回收率
取空白血浆样品200 μl,加入10 mmol/L的乙酸铵溶液20 μl,加入500 μl甲醇沉淀蛋白,涡旋1 min,14 800 r/min转速下离心15 min,取上清加入头孢地尼低、高质控溶液(浓度分别为:30、1 000 ng/ml)及内标溶液20 μl,涡旋30 s,取上清液用10 mmol/L的乙酸铵溶液等量稀释,混匀、离心,取上清液进样分析。所得的峰面积与以200 μl的10 mmol/L乙酸铵溶液代替空白血浆同法处理后的峰面积进行比较,以评价方法的基质效应。低、高2个浓度头孢地尼血浆样本中的基质效应为(67.20±5.82)%和(53.37±7.9)%,内标头孢克洛的基质效应为(69.95±11.25)%。经内标归一化后,低、高2个浓度基质效应因子RSD为6.88 %和5.27 % (n=6),均不超过15%。配制成头孢地尼浓度各为30、300、1 000 ng/ml低、中、高3个质量浓度的血浆样品各6份。按照“2.3项”下操作,进样测定,所得的峰面积与经过处理后血浆上清再加入同量的质控标准溶液比较,以评价方法的提取回收率。低、中、高3个质量浓度血浆样本中头孢地尼的提取回收率分别为(93.79±2.57)%,(77.38±4.91)% 和(81.46±4.82)%;RSD分别为2.17%、4.22%、3.22%。同法测得内标提取回收率为(80.86 ±1.63)%,RSD为3.24%。
2.6线性范围和定量限
取空白血浆200 μl,依次加入头孢地尼系列标准溶液20 μl,配制成相当于头孢地尼质量浓度为10.14、50.70、126.75、253.50、430.95、887.25、1 267.50 ng/ml的血浆样品。按照“2.3项”下操作,处理血浆样品,记录色谱图;以待测物与内标物的峰面积比值(f)为纵坐标,待测物浓度(C)为横坐标,用加权(W=1/x2) 最小二乘法进行回归运算,得到标准曲线方程为:Y=0.004 84X+0.029 6(r=0.999 2),线性范围为10.14~1 267.50 ng/ml,以信噪比为10 确定定量限,该方法的定量限为10.14 ng/ml。

A.空白血浆;B.空白血浆+头孢地尼及内标;C.受试者口服头孢地尼颗粒100 mg 后3.5 h 的血浆样本 Ⅰ.头孢地尼;Ⅱ.头孢克洛A. Blank plasma sample; B. Blank plasma sample+cefdinir; C. Plasma sample from the volunteer 3.5 h after administration of 200 mg of cefdinir; Ⅰ.Cefdinir; Ⅱ. Cefaclor图2 头孢地尼与内标头孢克洛的典型色谱图Fig 2 Typical chromatograms of cefdinir and cefaclor
2.7精密度和准确度试验
按照“2.3项”下操作,处理定量下限、低、中、高4个质量浓度的血浆模拟样本,每一浓度平行测定6份,连续测定6 d。根据同一分析批的标准曲线,计算质控样本的测定浓度,分析日内、日间精密度和准确度,见表1。批内、批间RSD均<15%,RE均在(±15%)的范围内。
2.8残留效应
测定定量上限样本之后, 随后测定1个空白血浆样本和1个定量下限样本,平行3次,来考察方法的残留效应。头孢地尼和内标的残留效应因子分别为10.7%和0%,满足分析要求。
2.9稳定性试验
分别考察低、高2个质量浓度的质控样品在不同条件下血浆样本的稳定性。结果表明含头孢地尼的血浆样品在上述条件稳定性良好,见表2。
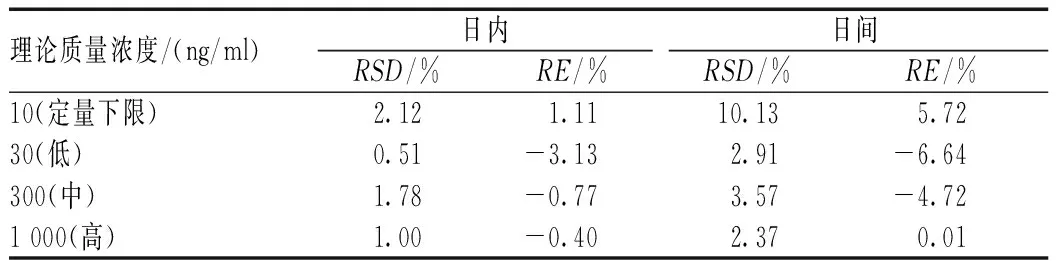
表1 血浆中头孢地尼的精密度和准确度试验结果(n=6)

表2 各种条件下低、高浓度头孢地尼稳定性试验结果(n=6)
3 生物等效性研究
3.1受试者的选择
24名中国健康男性受试者,平均年龄(23.54±2.26)岁,平均身高(173.00±6.06)cm,平均体质量(67.00±4.78)kg,平均体质量指数(22.39±1.17)kg/m2。试验前进行病史询问和体格检查,血常规、尿常规、肝肾功能及心电图检查等结果均正常。试验前2周及试验期间未服用任何药物,试验期间禁烟酒或含咖啡因的饮料。试验前皆在了解本研究的目的、意义、步骤、利益和可能发生的损害后签署知情同意书。本试验方案通过华中科技大学同济医学院医学伦理委员会审查。
3.2血药浓度测定和等效性评价
本试验采用双周期自身交叉对照试验设计,24名受试者随机分为2组,每组每次试验餐后单次口服受试制剂或参比制剂,2次试验间的清洗期为1周。受试者于前1 d入住,晚餐统一清淡饮食,禁食10 h、不禁水过夜。次日早晨摄入标准早餐(馒头约100 g、稀饭约150 ml、菜籽油约20 ml、烹饪的猪肉75 g、煎蛋1枚及蔬菜100 g);餐后30 min,用250 ml温开水送服口服受试制剂或参比制剂(100 mg)。于服药后1.0、2.0、3.0、3.5、4.0、4.5、5.0、5.5、6.0、7.0、8.0、10.0和12.0 h各取血1次,每次约4 ml,置于含乙二胺四醋酸的抗凝管中,30 min内14 800 r/min转速下离心10 min,分离血浆,置于-80 ℃冰箱备用。
采用DAS 3.2.7软件处理数据,计算餐后单次口服头孢地尼受试制剂和参比制剂的主要药动学参数(见表3、图3)。对受试制剂和参比制剂的平均药动学参数峰浓度(Cmax)、药-时曲线下面积(AUC)0~t、AUC0~∞经对数转换后进行方差分析,并采用双向单侧t检验及[1-2α]%置信区间法进行生物等效性评价,其中达峰时间(Tmax)采用非参数法(Wilcoxon符号秩检验)检验法。结果表明:Cmax、AUC0~t、AUC0-∞均拒绝生物不等效假设;对受试制剂,经对数转换后的Cmax、AUC0~t、AUC0~∞的90%置信区间分别为79.8%~110.4%、85.1%~109.8%、85.3%~109.4%,受试制剂与参比制剂的Tmax经非参数法检验,差异无统计学意义(P>0.05),表明餐后口服受试制剂和参比制剂具有生物等效性。



参数测试值参考值半衰期(t1/2)/h1.81±0.251.83±0.26tmax/h3.70±0.713.73±0.51Cmax/(μg/L)814.67±250.92870.80±281.99AUC0~t/(μg·h/L)4284.81±1150.024479.97±1333.70AUC0~∞/(μg·h/L)4425.56±1173.444632.83±1369.83

图3 24例健康受试者口服参比制剂和受试制剂后血浆头孢地尼平均血药浓度-时间曲线Fig 3 Mean plasma concentration-time profiles of oral test or reference preparation in 24 male volunteers
4 讨论
本研究根据等效性研究与生物样品处理的指导原则[12],建立了测定人血浆头孢地尼浓头度的LC-MS/MS法。该法分析时间短(<3.5 min),灵敏度高,定量下限达到10 ng/ml,且专属性强,适合于头孢地尼人体药动学与生物等效性等研究中生物样品的分析测定。在血浆样本的处理方面,比较了液-液萃取法与蛋白沉淀法,发现蛋白沉淀法处理血浆样品,方法简单、快速、成本低,且回收率更好。同时,乙酸铵溶液能提高头孢地尼的检测灵敏度,将用甲醇沉淀后上清液与10 mmol/L的乙酸铵溶液等体积稀释进样时,灵敏度大大提高。试验过程中发现,流动相中加入适量的甲酸有助于改善色谱峰的脱尾现象。
[1]Perry CM,Scott LJ.Cefdinir: a review of its use in the management of mild-to-moderate bacterial infections[J].Drugs,2004,64(13):1433-1464.
[2]张明发,辛海涛.头孢地尼的临床应用评价[J].中国医院用药评价与分析,2004,4(5):269-273.
[3]练子平.头孢地尼治疗儿童社区获得性呼吸道感染临床疗效观察[J].现代诊断与治疗,2015,26(1):119-120.
[4]Kaul M,Mark L,Parhi AK,et al.Combining the FtsZ-Targeting Prodrug TXA709 and the Cephalosporin Cefdinir Confers Synergy and Reduces the Frequency of Resistance in Methicillin-Resistant Staphylococcus aureus[J].Antimicrob Agents Chemother,2016,60(7):4290-4296.
[5]刘琳,卢亚兰,杜娟.头孢地尼对细菌感染小鼠的体内抗菌作用[J].中国医院用药评价与分析,2014,14(2):145-147.
[6]Chen J,Jiang B,Lou H.Bioequivalence evaluation of cefdinir in healthy fasting subjects[J].Arzneimittelforschung,2012,62(1):9-13.
[7]Khan A,Iqbal Z,Khan MI,et al.Simultaneous determination of cefdinir and cefixime in human plasma by RP-HPLC/UV detection method: Method development, optimization, validation, and its application to a pharmacokinetic study[J].J Chromatogr B Analyt Technol Biomed Life Sci,2011,879(24):2423-2439.
[8]Li J,Wang L,Chen Z,et al.Development and validation of a rapid HPLC method for the determination of cefdinir in beagle dog plasma integrated with an automatic on-line solid-phase extraction following protein precipitation in the 96-well plate format[J].J Chromatogr B Analyt Technol Biomed Life Sci,2012,1(895-896):83-88.
[9]Lepsy CS,Guttendorf RJ,Kugler AR,et al.Effects of organic anion, organic cation, and dipeptide transport inhibitors on cefdinir in the isolated perfused rat kidney[J].Antimicrob Agents Chemother,2003,47(2):689-696.
[10]Hishida A,Ohishi K,Nagashima S,et al.Pharmacokinetic study of an oral cephalosporin, cefdinir, in hemodialysis patients[J].Antimicrob Agents Chemother,1998,42(7):1718-1721.
[11]Jin HE,Kim IB,Kim CK,et al.Determination of cefdinir levels in rat plasma and urine by high-performance liquid chromatography-tandem mass spectrometry: application to pharmacokinetics after oral and intravenous administration of cefdinir[J].Biomed Chromatogr,2013,27(11):1423-1430.
[12]钟大放,李高,刘昌孝.药物制剂生物利用度和生物等效性试验指导原则:草案[J].药物评价研究,2011,34(5):321-334.
LC-MS/MS Method for Determination of Cefdinir in Human Plasma and the Bioequivalence Study
WANG Nanxi, ZHAI Xuejia, ZHU Chaoran, CHEN Fen, ZHANG Xinlin, LÜ Yongning
(Dept.of Pharmacy, Union Hospital,Tongji Medical College,Huazhong University of Science and Technology, Hubei Wuhan 430022, China)
OBJECTIVE:To establish a liquid chromatography-tandem mass spectrum(LC-MS/MS) method for deter-mination of cefdinir in human plasma, and to evaluate the bioequivalence after taking cefdinir granules in healthy volunteers. METHODS: A single dose of cefdinir granules of test or reference preparation were administered orally in 24 healthy male volunteers according to the randomized, two-way cross-over study. LC-MS/MS was adopted to determine the cefdinir concentration in human plasma. And the pharmacokinetic parameters and bioequivalence were calculated and evaluated with use of DAS software. RESULTS: The calibration curve was linear over the concentration ranges of 10.14-1 267.50 ng/ml(r>0.999), with the lower limit of quantitation (LLOQ) 10.14 ng/mL.RSDof within-day and between-day were lower than 1.78% and 3.75%. The main pharmacokinetic parameters of test and reference preparations were as follows:AUC0-t(4 284.81±1 150.02) μg·h/L and (4 479.97±1 333.70) μg·h/L,AUC0-∞(4 425.56±1 173.44) μg·h/L and (4 632.83±1 369.83) μg·h/L,t1/2(1.81±0.25) h and (1.83±0.26) h,tmax(3.70±0.71) h and (3.73±0.51) h,Cmax(814.67±250.92) ng/ml and (870.80±281.99) ng/ml.CONCLUSIONS: The method is rapid, sensitive and accurate for the determination of cefdinir in human plasma, which had been successfully applied in the bioequivalence study of cefdinir granules in healthy volunteers.
Cefdinir granules; LC-MS/MS; Bioequivalence; Pharmacokinetics
国家自然科学基金项目(No.81473287)
主任药师。研究方向:药动学及药物相互作用研究。E-mail:luyn_union@163.com
R978.1;R969.1
A
1672-2124(2016)08-1014-04
10.14009/j.issn.1672-2124.2016.08.002
2016-07-12)
*硕士研究生。研究方向:药动学及药物相互作用研究。E-mail:wangnx_union@163.com

