2015年欧洲心脏病学会关于特殊患者群体室性心律失常治疗和心脏性猝死预防指南的解读Δ
梁 峰,胡大一,方 全,沈珠军#
(1.首都医科大学大兴医院心内科,北京 102600; 2.北京大学人民医院心脏中心,北京 100044; 3.中国协和医科大学北京协和医院心内科,北京 100730)
·热点关注·
2015年欧洲心脏病学会关于特殊患者群体室性心律失常治疗和心脏性猝死预防指南的解读Δ
梁峰1*,胡大一2,方全3,沈珠军3#
(1.首都医科大学大兴医院心内科,北京102600; 2.北京大学人民医院心脏中心,北京100044; 3.中国协和医科大学北京协和医院心内科,北京100730)
2015年欧洲心脏病学会(european society of cardiology,ESC)关于特殊患者群体室性心律失常(ventricular arrhythmias,VA)治疗和心脏性猝死(sudden cardiac death,SCD)预防的指南为2006年美国心脏病学院(american college of cardiology,ACC)/美国心脏协会(american heart association,AHA)/ESC关于VA患者治疗和SCD预防指南相应内容的更新版[1]。依据国际主要的心律协会最近发表的VA患者治疗的共识,ESC指南委员会决定该指南的内容重点聚集于SCD的预防。应结合伴发病、患者预期寿命、对生活质量的影响和其他临床情况,考虑制订个体化的风险评估和治疗方案。本文解读特殊患者群体VA的治疗和SCD的预防。
1 精神病患者
精神病患者的心律失常风险:抗精神病药治疗时或治疗后,QTc间期>500 ms或较基线延长>60 ms,推荐将相关药物剂量调整或停药(推荐级别:ⅠC)。应用抗精神病药治疗期间,推荐监测血清钾离子浓度以避免出现低钾血症(推荐级别:ⅠC)。避免使用1种以上延长QT间期的药物治疗(推荐级别:ⅠC)。抗精神病药治疗启动前和剂量逐渐增加时,应评价QT间期(推荐级别:ⅡaC)。
1.1流行病学
精神分裂症、神经性厌食症和其他精神病患者,猝死发生率较预期更高,多认为此情况与这些疾病本身因素和治疗有关[2]。精神分裂症患者发生SCD的风险较一般人群高3倍,而且许多抗精神病药和抗抑郁药会增加VA和SCD风险,主要机制为尖端扭转型室性心动过速(torsade de pointes,TdP)。研究结果显示,抗精神病药的使用与猝死相关,且心血管病患者相关风险更高,传统或非传统抗精神病药均具有剂量依赖效应。最近的研究结果显示,使用抗精神病药会导致VA和(或)SCD的风险增加1.53倍,有高效人类果蝇相关基因钾通道阻滞作用的药物具有最高的VA 和(或)SCD风险。
1.2诊断与治疗
与选择性五羟色胺再摄取抑制剂相比,三环类抗抑郁药导致QTc延长和TdP增加的概率更高。钠通道强阻滞剂和基线风险因素常导致QT间期延长和TdP,基线风险因素包括既往心律失常、左心室功能受损、合用地高辛及低钾血症(使用利尿剂)。即使并不清楚某些药物是否延长QT间期,但不同类型药物联合应用时也必须严密监测心电图。推荐进行心血管风险评价,出现阳性发现时,由心血管医师评价治疗。启动药物治疗后,推荐进行心脏检查,出现QTc延长>500 ms或新的心脏症状时,应重新评价治疗。应避免使用与QT间期延长药物有相互作用的药物,了解所有合用的药物,包括药店购买的药物。
2 神经系统疾病患者
2.1癫痫患者突发不明原因死亡(sudden unexpected death in epilepsy,SUDEP)
癫痫患者突发SUDEP为癫痫患者的一种非意外死亡。多数病例发生于夜间或睡眠中,不能被观察到。导致SUDEP最大的风险因素是癫痫频繁发作,尤其完全强直-阵挛型癫痫。癫痫患者应进行心电图筛查,以排除与癫痫相似的疾病;当心脏和大脑离子通道异常之间存在潜在相互作用时,癫痫也可能由于神经系统离子通道病导致。预防SUDEP最佳的疗法是最大限度地控制癫痫发作。
2.2神经肌肉疾病
神经肌肉疾病患者存在心律失常的风险:肌营养不良患者推荐每年进行随访,即使在无症状和心电图正常的疾病隐匿期也应如此(推荐级别:Ⅰ B)。神经肌肉疾病患者发生VA,推荐与无神经肌肉疾病患者同样的方法治疗(推荐级别:Ⅰ C)。神经肌肉疾病患者合并任何解剖部位的Ⅲ度或高度Ⅱ度房室传导阻滞,推荐永久起搏器植入(推荐级别:Ⅰ B)。肌强直性营养不良1型(斯坦纳特病)、卡恩斯-塞尔综合征或肢带型肌营养不良症患者,合并任何程度的房室传导阻滞(包括 Ⅰ 度),由于快速进展的风险,可以考虑永久起搏器植入(推荐级别:Ⅱ bB)。肌强直性营养不良1型(斯坦纳特病)、埃默里德赖富斯肌营养不良症和肢带型肌营养不良1B型患者,当有起搏指征和VA证据时,可以考虑使用埋藏式心律转复除颤器(implantable cardioverter defibrillator,ICD)治疗(推荐级别:Ⅱ bB)。
肌营养不良症是一组遗传性疾病,可侵犯骨骼肌和心肌。心脏受累表现为退行性过程、心肌纤维化和脂肪替代,以及最常见的表现扩张型心肌病和传导阻滞,可能同时存在。所有肌营养不良症中,呼吸肌受累可能影响患者生活质量和寿命,需要考虑预防性使用器械治疗。
多数杜氏和贝克尔肌营养不良症、斯坦纳特病、埃默里德赖富斯肌营养不良症和肢带型肌营养不良1B型患者表现为心脏受累。杜氏和贝克尔肌营养不良症进展为扩张型心肌病较为常见,其进展为扩张型心肌病后会发生心律失常(室性早搏和非持续性室性心动过速)和传导阻滞,因此,心律失常的治疗与扩张型心肌病患者的推荐治疗同样重要。杜氏肌营养不良患者中,猝死主要发生于呼吸衰竭合并心力衰竭的患者。虽然心律失常性死亡的比例尚不清楚,但与其他非缺血性扩张型心肌病一样,VA和猝死在这些疾病中具有相似意义。预防性ICD的植入标准应与其他非缺血性扩张型心肌病相同[3]。
斯坦纳特病合并或不合并扩张型心肌病,出现传导阻滞常需要置入起搏器,多达1/3的患者的死亡原因为突发性意外。18项研究(1 828例患者)回顾报道,几乎30%的患者出现Ⅰ度房室传导阻滞,20%出现QRS间期>120 ms,15%有频发室性早搏以及4%有非持续性室性心动过速,7.2%出现左心室收缩功能障碍,5%出现心房颤动或心房扑动。基于心脏传导疾病高发,推测斯坦纳特病的SCD主要由进展性传导疾病所致,但是起搏器植入以及自发或可诱发室性心动过速的患者,猝死证据提示某些猝死考虑为VA。
有研究对斯坦纳特病患者进行了系列有创性H波与心室波(HV)间期测量,结果显示,一种新的传导病发生后5年内希氏束下传导延长。其他研究结果提示,有创电生理检查HV延长>70 ms可预测6年内完全性房室传导阻滞的发生。对406例基因确诊的斯坦纳特病患者的研究结果显示,房室和(或)室内传导阻滞的严重性和房颤的发生为猝死的独立风险因素。大规模回顾性研究结果发现,HV间期>70 ms的患者使用电生理检查随后进行起搏器植入,与随后进行心电图评价的患者比较,猝死发生率降低[4]。
与核纤层蛋白A或C突变相关的埃默里德赖富斯肌营养不良症和肢带型肌营养不良1B型患者,猝死占其所有死亡原因的30%。对核纤层蛋白A或C突变肌营养不良患者的系列研究结果提示,出现房室传导阻滞可导致不良预后,起搏治疗不能充分预防SCD,因此,当心脏受累时支持预防性ICD植入而非起搏器[5]。猝死和ICD治疗的风险因素包括非持续性室性心动过速、左心室射血分数<45%、男性和核纤层蛋白A或C的非错义突变。罕见的X连锁隐性遗传埃默里德赖富斯肌营养不良症与emerin基因突变有关,其治疗由于缺乏临床资料而复杂;如无特异基因信息,采用显性遗传埃默里德赖富斯肌营养不良症的治疗策略似乎合理。
3 妊娠期患者
3.1与围产期心肌病无关的心律失常
妊娠期心律失常风险的治疗[6]:妊娠期间如果出现适应证推荐ICD植入(推荐级别:Ⅰ C)。长QT综合征或儿茶酚胺敏感性多形性室性心动过速患者,妊娠期及哺乳期同样推荐β受体阻断剂治疗(推荐级别:Ⅰ C)。特发性持续性室性心动过速的长期治疗,推荐口服美托洛尔、普萘洛尔或维拉帕米(推荐级别:Ⅰ C)。持续性室性心动过速尤其血流动力学不稳定,推荐立即心脏电转复(推荐级别:Ⅰ C)。血流动力学稳定的持续单形性室性心动过速的急性转复,应考虑索他洛尔或静脉使用普鲁卡因酰胺(推荐级别:Ⅱ aC)。持续性单形性室性心动过速,当血流动力学不稳定、电转复无效或对其他药物无反应,急性转复应考虑静脉使用胺碘酮(推荐级别:Ⅱ aC)。药物无效并不易耐受的心动过速可以考虑导管消融治疗(推荐级别:Ⅱ bC)。
结构性心脏病女性患者妊娠会导致巨大的风险。哺乳期(产后40周内)先天性长QT综合征的女性患者,心脏事件的风险大幅增加,整个妊娠期和哺乳期应持续应用β受体阻断剂治疗。Brugada综合征的女性患者妊娠期和围产期使用β受体阻断剂可能安全。
妊娠期阵发性室上性心动过速发作,多数患者症状恶化。妊娠期出现新发室性心动过速,可能与儿茶酚胺升高有关。既往室性心动过速和结构性心脏病的患者,室性心动过速再发的风险较高。
当发现患者出现良性心律失常时,需安慰患者,并告知其避免兴奋如饮用咖啡、吸烟和饮酒。如果计划妊娠,妊娠前有症状的快速性心律失常患者应进行导管消融治疗。如果采用药物治疗,建议尽可能在妊娠后期开始,并使用最低有效剂量。妊娠期间无结构性心脏病的心律失常通常对β受体阻断剂敏感。如果β受体阻断剂无效,无结构性心脏病患者可考虑索他洛尔或钠通道阻滞剂(推荐级别:Ⅰ C)。

右心室流出道的特发性室性心动过速,如果出现严重症状或血流动力学障碍,维拉帕米或β受体阻断剂(美托洛尔、索他洛尔)可作为预防性用药。左心室特发性分支室性心动过速通常对β受体阻断剂无反应,可用维拉帕米治疗,其机制为部分去极化浦肯野纤维慢钙内流。药物难治或不能耐受的室性心动过速,导管消融可能是必要的。植入ICD的患者可成功安全妊娠,无婴儿受损;妊娠期间如果出现ICD的适应证,可以考虑使用皮下ICD,以避免透视射线,但经验不足时则不建议使用。
3.2围产期心肌病相关的心律失常
妊娠性心肌病相关心律失常的治疗[7]:妊娠期妇女发生血流动力学不稳定的室性心动过速或心房颤动,推荐心脏电复律或除颤(推荐级别:ⅠB)。妊娠期妇女推荐心力衰竭的标准治疗,但避免妊娠禁忌药物[血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitors,ACEI)、血管紧张素Ⅱ受体阻断剂 (angiotensin Ⅱ receptor blocker,ARB)和肾素抑制剂](推荐级别:ⅠC)。
围产期心肌病病因不清,感染、炎症和自身免疫过程可能起一定的作用,估计100 000例活产儿中有50例会发生围产期心肌病,美国围产期心肌病相关的死亡率估计为6%~10%。最近的研究结果显示,围产期心肌病可能为基因突变相关家族性扩张型心肌病的一种表现形式。
围产期心肌病通常表现为妊娠晚期或产后几个月由于左心室收缩功能障碍导致的心力衰竭。左心室可能不扩大,但射血分数几乎总是降低(<45%)。该最新的定义中对时间窗未严格限定。复杂的VA和突发心脏骤停可能为继发性原因。妊娠期最后6周内或产后早期新发室性心动过速的哺乳期妇女,应该排除产后心肌病。
急性心力衰竭的治疗指南应适用于围产期心肌病患者。妊娠期间,ACEI、ARB和肾素抑制剂禁忌使用。如果患者能够耐受,则推荐应用β受体阻断剂。首选具有选择性β1肾上腺素受体阻断特性的美托洛尔,不应使用阿替洛尔,应避免使用盐皮质激素受体拮抗剂。潜在性威胁生命的VA应该通过电复律终止。VA或低射血分数患者ICD的植入应遵循标准指南;但是制订决策时,必须考虑产后扩张型心肌病自然恢复的比例相对高(50%)。
4 阻塞性睡眠呼吸暂停
睡眠呼吸暂停发作中VA和缓慢性心律失常的治疗:缓慢性心律失常的鉴别诊断中应考虑睡眠呼吸暂停综合征(推荐级别:ⅡaB)。睡眠呼吸暂停和氧饱和度降低可以视为睡眠呼吸障碍患者SCD的一项风险因素(推荐级别:ⅡbC)[8]。
队列研究资料显示,阻塞性睡眠呼吸暂停导致死亡率增高,其与SCD的相关性一直存在争议。最近研究结果显示,阻塞性睡眠呼吸暂停导致夜间平均氧饱和度降低<93%以及最低夜间氧饱和度<78%,这是SCD的独立风险因素。因此,阻塞性睡眠呼吸暂停应被列为SCD风险分层的研究项目。随着睡眠暂停-低通气综合征严重程度的增加,心律失常发生的频率也增加,主要发生于夜间。睡眠呼吸暂停-低通气综合征患者最常见的心脏节律异常是窦性心动过缓、窦性停搏、Ⅰ 度和莫氏1型 Ⅱ 度房室传导阻滞以及室性早搏增加。研究已证明VA存在一种昼夜模式,以及睡眠期间(午夜至早晨6:00)SCD发生率增高。
目前无证据显示,睡眠呼吸暂停-低通气综合征患者可不遵守VA的标准治疗,且持续气道正压通气预防VA和SCD的价值仍不明确。心律失常与阻塞性呼吸事件完全相关的患者,阻塞性睡眠呼吸暂停的合理治疗是否可改善临床表现以及避免起搏器治疗仍不明确。最新创新性起搏疗法治疗中央型睡眠呼吸暂停-低通气综合征、使用膈神经刺激和下呼吸道刺激治疗阻塞型呼吸暂停正在研究中。
5 药物相关促心律失常
药物相关促心律失常的治疗:只要疑似药物诱导心律失常,以及排除其他致心律失常因素,推荐停用相关药物(推荐级别:ⅠB)。既使存在一项可纠正的致VA因素,但依据致命性VA将来风险的个体评价,应该考虑需要预防性植入ICD(推荐级别:ⅡaC)。
5.1基础疾病因素导致的药物-促心律失常因素的相互作用
当发现疑似药物诱导心律失常时,应停用所有相关药物,另外需进行全面评价,排除促发心律失常事件的心血管风险因素。如果遗传性或获得性致心律失常因素已排除,患者正在使用改变心脏电特性(如诱导QT间期延长)或导致电解质紊乱的药物治疗,应怀疑是否为药物诱导心律失常。左心室肥厚的患者,使用索他洛尔可导致促心律失常。同样也有研究怀疑这些患者使用氟卡胺和普罗帕酮会促心律失常,尤其存在明显的左心室肥厚(左心室壁厚度>14 mm)和(或)内在的冠心病者。既往心肌梗死或由于结构性心脏病发生持续性室性心动过速的患者,不应使用钠通道阻滞剂,也应避免使用具有钠通道阻滞活性的其他药物,如三环类抗抑郁药。如果心室功能正常,其评价和治疗应该与无抗心律失常药时发生VA的患者相似。
5.2药物之间的相互作用(特定药物和联合用药)
钠通道阻滞剂如三环类抗抑郁药,可能导致QRS间期延长以及典型的Brugada综合征心电图表现。蒽环类药物的心脏毒性为剂量依赖性,更高的累积量可增加心肌病和致死性心律失常的风险。氟尿嘧啶由于其冠状动脉痉挛作用可导致心室颤动;蟾蜍毒液可产生类似于地高辛的临床毒性;中草药如毛地黄茶也有产生类似地高辛临床毒性的报道。
对药源性心律失常高危患者,如果不是致TdP的特异药物,则治疗重点的是避免使用药物治疗。即使血清镁离子浓度正常,静脉使用镁剂可抑制TdP的发作,并不一定缩短QT间期。临时起搏对治疗TdP非常有效,此类患者也可试用异丙肾上腺素,推荐停用相关药物,以及纠正电解质紊乱。
5.3抗心律失常药的促心律失常风险
抗心律失常药对心脏离子通道具有直接作用,氟卡胺、普罗帕酮和奎尼丁具有钠通道阻滞作用。大规模临床试验如CAST和CASH结果显示,钠通道阻滞剂会升高既往心肌梗死患者死亡率。美西律和双异丙吡胺的较早试验也观察到相似的趋势。对治疗持续性室性心动过速的患者,这些药物可能导致更频繁、常更难以复律的持续性室性心动过速事件。

大多数情况下,抗心律失常药促心律失常的治疗包括停用相关药物、监测心率以及保持正常血钾水平。静脉用镁剂和临时起搏治疗可能有用。异丙肾上腺素也可用于增加心率以及缩短心室动作电位时程,消除去极化和尖端扭转性室性心动过速[10]。
5.4触发因素的促心律失常
多种触发因素可导致VA或SCD,如低钾血症(血清钾离子浓度<3.5 mmol/L)、细胞外钾快速升高和低镁血症。低镁血症常导致多形性室性心动过速或尖端扭转性室性心动过速,静脉注射镁剂可能有效。高血压病和充血性心力衰竭患者,低钾血症合并或不合并低镁血症可能导致VA(由于使用噻嗪类或袢利尿剂诱发)。多种因素可能有助于VA和SCD的发生,如心动过缓、心肌缺血、冠脉痉挛、血栓、急性饥饿和急性酒精中毒或戒断。ICD也可导致VA的发生。这些患者推荐停用任何相关的药物并纠正电解质异常。
6 心脏移植术后SCD
许多临床试验结果显示,心脏移植术后猝死频发(>10%)。某些患者经历多次严重排异事件后可能发生猝死。急性排异患者的传导系统可能受损,导致VA和猝死。由于血液透析或血浆置换过程中血流动力的刺激,心脏可能处于心律失常发生的高风险状态[11]。多数心脏移植术后猝死的患者有冠状动脉疾病,可能由于高钾血症、血液透析或血浆置换作为事件触发因素,但是也可能为原发心律失常性死亡。部分高危患者行心脏移植术后使用ICD可能合适。
7 运动员的心脏性猝死
运动员心脏性猝死的预防:仔细询问病史以发现基础心脏病、心律失常、晕厥事件或SCD家族史(推荐级别:ⅠC)。一旦心电图异常提示结构性心脏病,推荐进行超声心动图和(或)心脏磁共振成像检查(推荐级别:ⅠC)。年轻运动员赛前筛查应该考虑体格检查和静息12导联心电图检查(推荐级别:ⅡaC)。中年个体参加高强度运动应进行病史、体格检查、系统冠状动脉风险评价和静息心电图检查进行筛查(推荐级别:ⅡaC)。应对体育设施的工作人员进行心肺复苏操作和正确使用自动体外除颤仪的培训(推荐级别:ⅡaC)。
与同龄非运动员相比,运动员似乎处于过高的风险状态,年轻运动员(<35岁)SCD的发生率估计为0.7~3.0人/10万人。高龄运动员SCD的发生率更高,预计SCD发生率随着年龄的增加而增加[12]。运动的强度和运动员的年龄是核心风险因素。
年轻运动员猝死最常见的原因为遗传性心律失常性疾病(心肌病和离子通道病)和冠状动脉疾病(先天性和后天性)。美国建立了运动员猝死国家登记处,报道了27年的观察期间1 866例<40岁运动员猝死。这些登记资料显示,36%的猝死归因于明确的心血管原因,其中最常见的原因是肥厚型心肌病(36%)、先天性冠状动脉畸形(17%)、心肌炎(6%)、致心律失常性右室心肌病(arrhythmogenic right ventricular cardiomyopathy,ARVC)(4%)和离子通道病(3.6%)。意大利威尼托大区的研究者进行了一项前瞻性队列研究,入选1979—1999年参与竞技体育的<36岁运动员,结果发现24%的运动员ARVC为SCD的原因,其次为冠状动脉粥样硬化性心脏病(20%)、冠状动脉起源异常(14%)和二尖瓣脱垂(12%)。
赛前筛选似乎对预防SCD有效,但欧洲各国及欧美之间的筛选方案差异巨大。心脏筛选应适合于运动员的年龄,以针对年龄相关风险因素。年轻运动员(≤35岁)的筛选重点是遗传性心肌病和离子通道病,而对于高龄运动员,冠状动脉粥样硬化性心脏病是最常见的SCD原因,筛选也应针对性地检查缺血迹象[13]。
欧洲心血管预防与康复协会发布了中年或老年活跃者参加业余时间体育活动的心血管评价推荐方案,见图1。
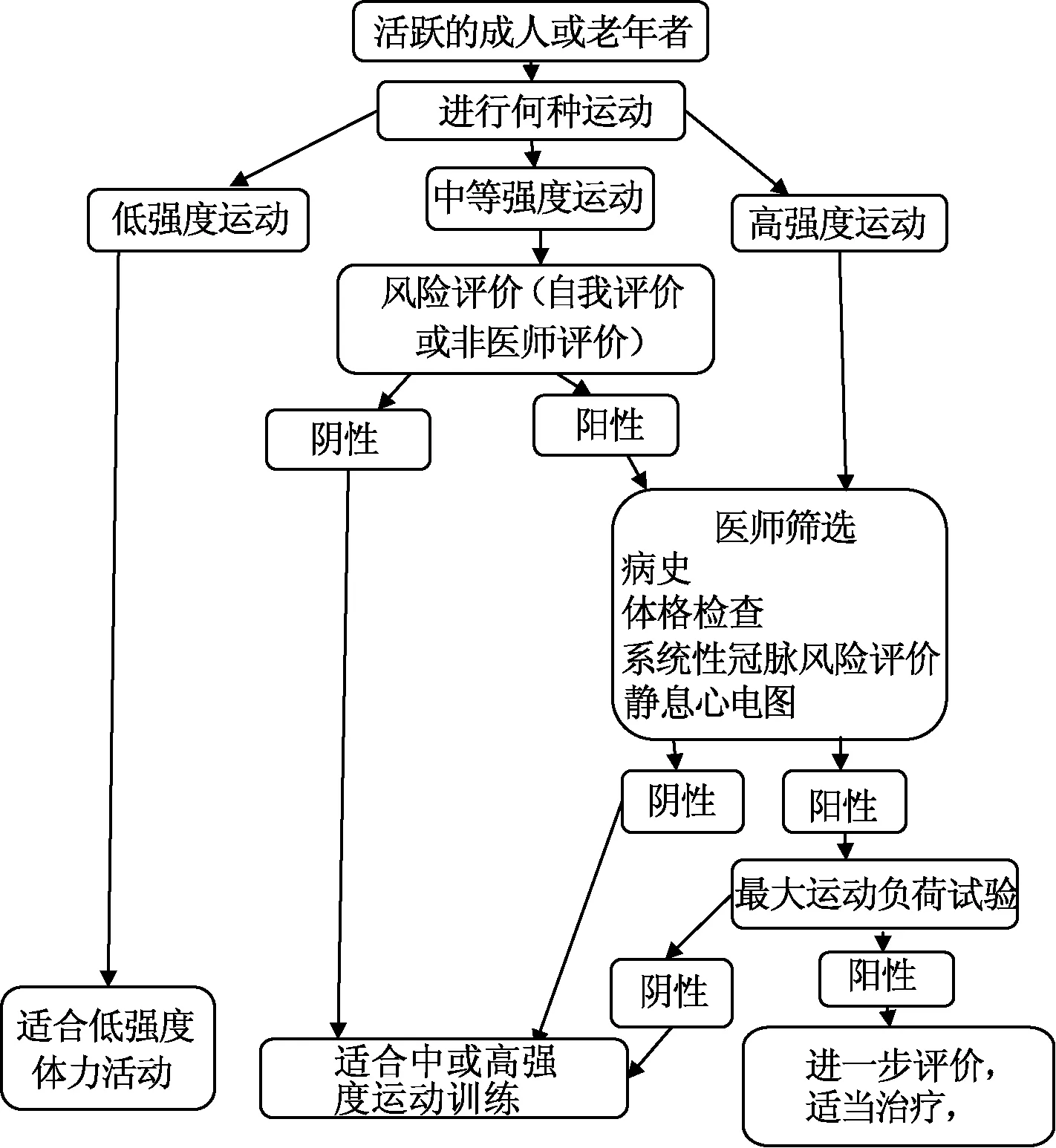
图1 无症状成人或老年人建议的体育运动赛前评价方案
有研究评价了35~56岁运动员参加高强度体育运动使用该预防策略的工作量、收益率和经济成本的意义。结果显示,2.8%的运动员被诊断出1种心血管异常,每名运动员花费199美元。研究总体评价该方案似乎可行、成本合理。重要的是,培训运动场所的教练和工作人员应正确应对紧急情况、掌握心肺复苏的操作和使用自动体外除颤仪。
8 预激综合征
预激综合征患者的治疗:由于心房颤动以及经旁道快速传导导致心室颤动发生心脏骤停的患者,复苏后推荐消融治疗预激综合征(推荐级别:ⅠB)。预激综合征患者有症状和(或)旁道不应期≤240 ms,应考虑消融治疗(推荐级别:ⅡaB)。预激综合征是SCD相当少见的原因,预计年发生率为0.05%~0.2%。SCD可能由于心房颤动合并快速心室率蜕化为心室颤动而发生。SCD的主要风险因素是旁道前向不应期短。最近8年2 169例预激综合征的前瞻性注册研究结果显示,SCD主要发生于旁道前向不应期≤240 ms和房室折返性心动过速诱发心室颤动的患者。由于心房颤动以及经旁道快速传导导致心室颤动,经心脏骤停复苏幸存的预激综合征患者,推荐心脏电生理检查并消融治疗。如果患者有症状(如晕厥或心悸)和(或)旁道不应期≤240 ms,应考虑电生理检查以及消融治疗[14]。电生理检查应包括心房颤动诱发时(或快速心房起搏过程有预激波的最短RR间期)有预激波的最短RR间期测量、旁道数量和部位、旁道和房室结顺向和逆向传导特性,以及多种不同激动周期时旁道和心室的有效不应期。预激综合征患者应避免使用钙通道阻滞剂(维拉帕米)或地高辛治疗,这些药物可通过增加房室结不应期而增加旁道前传。
9 老年患者SCD的预防
老年患者使用抗心律失常药时,应依据肝、肾清除功能降低程度、机体结构的变化和伴发病而进行调整。也应考虑药物之间的相互作用,可能需要调整剂量。如无特殊禁忌证,急性心肌梗死后老年患者应考虑使用β受体阻断剂,其可预防>65岁患者的SCD。ICD广泛用于老年患者,AVID和MADIT-Ⅱ试验的亚组分析结果显示,ICD治疗在老年和年轻患者中的获益相同。SCD一级预防试验综合资料荟萃分析结果发现,≥75岁无ICD相关并发症的患者,ICD治疗可降低全因死亡率[15]。但另一项不同的荟萃分析结果显示,严重左心室功能障碍的老年患者进行ICD治疗,可能获益较小。二级预防的汇总资料显示,ICD治疗显著降低<75岁患者全因和心律失常性死亡率,但并不降低≥75岁患者的全因死亡和心律失常性死亡率。日常临床实践一级预防的观察性研究和注册资料显示,单纯年龄因素不应排除器械的植入[16]。ICD植入的决策应考虑器械对生活质量的影响:MADIT-Ⅱ亚组分析发现,≥65岁的患者质量调整寿命年无明显减少。总之,年龄不是ICD合理使用的考虑标准,因为突然死亡的高龄者于死亡前1个月仍以良好功能状态生存。临床判断结合患者和(或)家属的意愿可能有助于决策的制订,可不同于ICD使用的标准推荐。
10 临终问题
临终治疗问题:ICD植入前和疾病进程的关键时点,应该考虑与适宜ICD植入患者讨论临终问题(推荐级别:ⅡaC)。当临床状况恶化时应考虑ICD的灭活(推荐级别:ⅡaC)。临终的患者常进展为易诱发心律失常的状态(缺氧,疼痛和电解质紊乱)。在生命的最后几周内,20%的ICD植入患者接受电击[17]。与患者和家属讨论ICD灭活,预防生命垂危者不适当的危难和痛苦是一项重要但往往被忽视的必要程序。应依据患者的意愿进行个体化考虑,履行知情同意和知情拒绝。如果患者不能自行做出决定,应该听从家属成员或代理决策者的意见,如果患者有生前遗嘱则应遵从。由于这一问题的复杂性,其执行的详细信息可参阅欧洲心律协会和美国心律协会的共识,另外应考虑地方性法规和法律。
器械的灭活可通过程控,如果不能程控则应于器械上直接使用磁铁。更好的方法可能是只暂停抗心动过速治疗而维持心动过缓的起搏治疗,以免症状恶化。
11 证据空白
(1)猝死的第一临床表现常常是致死性的,因此识别处于猝死风险的患者仍然是猝死预防的点金之石,亟需研究识别处于猝死风险无症状人群的最佳方法及适合大众筛选的简单、价廉的方法。(2)确保一种有效和快速的治疗链是非常重要的,可改善猝死者的生存情况。需要更多研究评价此种生存链的最佳设计,包括院前治疗和院内治疗方案。(3)部分患者应用穿戴式除颤仪可能是一种可行的治疗选择,但需明确适应证,完全确立之前,需要大规模随机临床事件检验。(4)SCD一级预防的里程碑式随机临床试验发表后已过去10年多,至今仍作为左心室功能障碍和心力衰竭患者ICD植入的依据。但需要新的临床试验评价ICD对现代患者SCD一级预防的可能获益。(5)需要更多的研究明确循证干预可减少对处于猝死风险的患者和家属的心理影响,优化治疗和支持。(6)除观察性数据资料外,行房室结消融的心房颤动患者CRT(或CRT-D) 的使用尚未明确,需要强有力的随机试验检验。(7)遗传性心律失常和心肌病领域在过去的20年经历了重大进展,主要由于基因诊断的广泛普及以及大规模注册临床数据的获得,但是仍然存在关键性空白。Brugada综合征、短QT综合征、ARVC和多数非缺血性扩张型心肌病的风险分层方案存在知识空白。(8)室性心动过速可使各种结构性心脏病患者的预后恶化,急需新的抗心律失常药或其他治疗,可使更广泛人群的首发或复发性致命性VA得到保护。特定的抗心律失常治疗是否可改善预后,仍然有待检验。虽然研究结果显示结构性心脏病患者复发性室性心动过速使用导管消融可显著降低其复发的次数,但室性心动过速患者使用导管消融对死亡率的影响仍不清楚,需要进一步研究。
[1]Priori SG,Blomström-Lundqvist C,Mazzanti A,et al.2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC) Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC)[J]. Europace,2015,17(11):1601-1687.
[2]Murray-Thomas T,Jones ME,Patel D,et al.Risk of mortality (inclu-ding sudden cardiac death) and major cardiovascular events in atyp-ical and typical antipsychotic users: a study with the general practice research database[J].Cardiovasc Psychiatry Neurol,2013:247486.
[3]Groh WJ.Arrhythmias in the muscular dystrophies[J].Heart Rhy-thm,2012,9(11):1890-1895.
[4]Wahbi K,Meune C,Porcher R,et al.Electrophysiological study with prophylactic pacing and survival in adults with myotonic dystrophy and conduction system disease[J].JAMA,2012,307(12):1292-1301.
[5]Meune C,Van Berlo JH,Anselme F,et al.Primary prevention of su-dden death in patients with lamin A/C gene mutations[J].N Engl J Med,2006,354(2):209-210.
[6]Regitz-Zagrosek V,Blomstrom Lundqvist C,Borghi C,et al.ESC Com-mittee for Practice Guidelines.ESC Guidelines on the mana-gement of cardiovascular diseases during pregnancy: the Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC)[J].Eur Heart J,2011,32(24):3147-3197.
[7]Sliwa K,Hilfiker-Kleiner D,Petrie MC,et al.Current state of kno-wledge on aetiology,diagnosis,management,and therapy of peri-par-tum cardiomyopathy: a position statement from the Heart Failure Ass-ociation of the European Society of Cardiology Working Group on peripartum cardiomyopathy[J].Eur J Heart Fail,2010,12(8):767-778.
[8]Gami AS,Olson EJ,Shen WK,et al.Obstructive sleep apnea and the risk of sudden cardiac death: a longitudinal study of 10,701 adults[J].J Am Coll Cardiol,2013,62(7):610-616.
[9]Rao GA,Mann JR,Shoaibi A,et al.Azithromycin and levofloxacin use and increased risk of cardiac arrhythmia and death [J].Ann Fam Med,2014,12(2):121-127.
[10]Barra S,Agarwal S,Begley D,et al.Post-acute management of the acquired long QT syndrome[J].Postgrad Med J,2014,90(1064):348-358.
[11]Vakil K,Taimeh Z,Sharma A,et al.Incidence,predictors,and temporal trends of sudden cardiac death after heart transplantation[J].Heart Rhythm,2014,11(10):1684-1690.
[12]Schmied C,Borjesson M.Sudden cardiac death in athletes[J].J Intern Med,2014,275(2):93-103.
[13]Borjesson M,Urhausen A,Kouidi E,et al.Cardiovascular evaluation of middle-aged/senior individuals engaged in leisure-time sport activities: position stand from the sections of exercise physiology and sports cardiology of the European Association of Cardiovascular Prevention and Rehabilitation[J].Eur J Cardiovasc Prev Rehabil,2011,18(3):446-458.
[14]Pappone C,Vicedomini G,Manguso F,et al.Wolff-Parkinson-White syndrome in the era of catheter ablation: insights from a registry study of 2169 patients[J].Circulation,2014,130(10):811-819.
[15]Kong MH,Al-Khatib SM,Sanders GD,et al.Use of implantable cardioverter-defibrillators for primary prevention in older patients: a systematic literature review and meta-analysis[J].Cardiol J,2011,18(5):503-514.
[16]Brullmann S,Dichtl W,Paoli U,et al.Comparison of benefit and mortality of implantable cardioverter-defibrillator therapy in patients aged ≥75 years versus those <75 years[J].Am J Cardiol,2012,109(5):712-717.
[17]Wright GA,Klein GJ,Gula LJ.Ethical and legal perspective of implantable cardioverter defibrillator deactivation or implantable cardioverter defibrillator generator replacement in the elderly [J].Curr Opin Cardiol,2013,28(1):43-49.
北京市卫生系统高层次卫生技术人才培养项目资助(No.2009-3-68)
教授。研究方向:冠脉介入诊治。E-mail:zhujun66shen@126.com
R972
A
1672-2124(2016)08-1009-05
10.14009/j.issn.1672-2124.2016.08.001
2016-01-12)
*主任医师,教授。研究方向:冠心病的临床研究。E-mail:liangfeng666@aliyun.com

