阿托伐他汀对人NK细胞杀伤HCT-116细胞的影响及其机制研究
姬会春,周 燏,刘军权,陈复兴,李 昳,费素娟
1.徐州医学院研究生院,江苏 徐州 221002; 2.中国人民解放军第97医院实验科; 3.徐州医学院附属医院消化科
阿托伐他汀对人NK细胞杀伤HCT-116细胞的影响及其机制研究
姬会春1,周 燏2,刘军权2,陈复兴2,李 昳2,费素娟3
1.徐州医学院研究生院,江苏 徐州 221002; 2.中国人民解放军第97医院实验科; 3.徐州医学院附属医院消化科
目的 探讨阿托伐他汀对人自然杀伤细胞(natural killer,NK)杀伤HCT-116细胞的影响及其机制。方法 CCK-8法测定不同浓度的阿托伐他汀对HCT-116 细胞生长抑制率的影响。自动生化分析仪测NK细胞对HCT-116 细胞的杀伤活性;流式细胞仪(FCM)检测HCT-116 细胞MICA/B的表达率。结果 不同浓度的阿托伐他汀作用于HCT-116细胞48 h后在浓度为5~40 μmol/L及作用96 h后在浓度为1.25~40 μmol/L时,对HCT-116细胞的生长抑制率与对照组相比差异有统计学意义(P<0.05)。阿托伐他汀浓度相同时,HCT-116细胞的生长抑制率在48 h组与96 h组相比,除5 μmol/L浓度组外差异均有统计学意义(P<0.05)。阿托伐他汀的浓度与HCT-116细胞的生长抑制率呈正相关(r[48h]=0.13,r[96h]=0.22,P<0.05)。NK细胞对HCT-116细胞的杀伤活性在阿托伐他汀浓度为2.5~10 μmol/L各组中均显著高于对照组(P<0.05)。2.5 μmol/L浓度组及5 μmol/L浓度组,HCT-116细胞MICA/B的表达率与对照组比较显著升高(P<0.05)。结论 阿托伐他汀呈剂量依赖性抑制HCT-116细胞的生长,且延长作用时间可以增强阿托伐他汀对HCT-116细胞生长的抑制作用;还能够增强NK细胞对HCT-116杀伤活性;以及上调HCT-116细胞MICA/B的表达率,提高其免疫原性。
阿托伐他汀;HCT-116细胞;自然杀伤细胞;MICA/B
近年,随着我国经济的发展、人们生活习惯、饮食结构的改变及环境污染等,结肠癌的发病率呈逐年上升趋势,新发病例以每年4%的速度增长,每年新发病例超过17万,现已成为我国发病率上升最快的恶性肿瘤之一[1-2],严重威胁着国人类的健康。他汀类药物是临床常用的降血脂药物。近年来有研究表明,他汀类药物具有抗肿瘤作用[3]。NK细胞是天然免疫细胞,临床上NK细胞过继免疫治疗多种肿瘤已取得了一些疗效。如何增强NK细胞对肿瘤细胞的杀伤活性是提高NK细胞抗肿瘤疗效的关键。目前尚没有阿托伐他汀与NK细胞联合应用进行抗肿瘤研究的报道。本文拟探讨阿托伐他汀对NK细胞杀伤HCT-116细胞的影响及其机制。
1 材料与方法
1.1 材料 阿托伐他汀(辉瑞制药有限公司);人结肠癌细胞株HCT-116(低分化腺癌)(中科院上海细胞所);CCK-8试剂盒(碧云天);PE标记MICA/B、PE标记的CD3、FITC标记的CD56(美国BD公司);ST-360酶标仪(上海科华实验系统有限公司);Encore自动生化分析仪(北京希亚克技术有限公司);流式细胞仪(flow cymetory,FCM)(美国BD公司)。
1.2 HCT-116细胞的培养 复苏后的HCT-116加入适宜的培养液,置于37 ℃、5%CO2的培养箱中,2~3 d半量更换培养液,平均3 d传代1次。待细胞铺满瓶底时用0.25%的胰酶消化脱壁,1 800 r/min离心6 min,离心半径为13 cm,弃上清液,收集细胞用于实验。
1.3 CCK-8检测HCT-116细胞抑制作用 收集对数生长期的HCT-116细胞,PBS洗涤3次,将细胞配成1×104个/ml的细胞悬液加入96孔板内,培养24 h后加入不同浓度的阿托伐他汀,同时设DMSO 溶剂对照组,每组设3个复孔。置于37 ℃、5%CO2培养箱内培养。分别于44 h、92 h时每孔加入CCK-8 20 μl,继续培养4 h,轻轻摇匀,于酶标仪450 nm波长处测OD值。按下列公式计算结肠癌细胞的生长抑制率:生长抑制率(%)=(1-实验组OD值/对照组OD值)×100%。
1.4 自动生化仪测定NK细胞杀伤活性 取对数生长期的HCT-116细胞予胰酶消化,洗涤3次,将细胞配成5×105个/ml的细胞悬液,加入6孔细胞培养板。分别将不同浓度的阿托伐他汀加入细胞培养板中,收集培养第48 h的HCT-116细胞,将细胞密度调整为2×105个/ml,作为靶细胞。以培养后的NK 细胞为效应细胞,调整细胞密度为2×106个/ml,按效靶比10∶1接种于试管中,置 37 ℃、5%CO2细胞培养箱培养6 h,1 000 r/min离心5 min(离心半径为13 cm),吸取上清液,自动生化分析仪测乳酸脱氢酶(LDH)值。按下列公式计算NK细胞的杀伤活性:杀伤活性=(实验组LDH值-效应细胞自然释放组LDH值)/(靶细胞最大释放组LDH值-靶细胞自然释放组LDH值)×100%。
1.5 FCM检测检测MHC-I类链相关分子A/B(MICA/B)表达 收集HCT-116细胞,调整细胞密度为5×105个/ml,以每孔5 ml接种于6孔板内,加入不同浓度的阿托伐他汀,置于37 ℃、5%CO2培养箱内培养48 h,收集细胞,PBS洗涤,调整细胞密度至1×107个/ml,取细胞悬液100 μl,加入PE-MIC A/B 20 μl,室温避光孵育15 min,同时设同型IgG1作为对照。PBS洗涤并重悬细胞,FCM检测MICA/B的表达。

2 结果
2.1 不同浓度阿托伐他汀对HCT-116细胞生长抑制率的影响 作用48 h后,阿托伐他汀浓度为5~40 μmol/L的4个实验组中及作用96 h后阿托伐他汀1.25~40 μmol/L的所有浓度组中,HCT-116细胞的生长抑制率与对照组比较差异均有统计学意义(P<0.05)。阿托伐他汀浓度相同时,HCT-116细胞的生长抑制率在48 h组与96 h组之间比较,除5 μmol/L浓度组外差异均有统计学意义(P<0.05,见表1)。另外,相关分析显示,阿托伐他汀的浓度与HCT-116细胞的生长抑制率呈正相关(r[48h]=0.13,r[96h]=0.22,P<0.05,见图1)。



药物浓度(μmol/L)HCT-116细胞生长抑制率48hOD值抑制率(%)96hOD值抑制率(%)0(对照组)1.81±0.0901.86±0.0801.251.78±0.082.08±0.181.69±0.098.36±0.18*△2.51.78±0.101.60±0.151.68±0.079.61±0.20*△51.74±0.083.79±0.38*1.69±0.088.51±0.28*101.75±0.083.52±0.34*1.63±0.0811.58±0.44*△201.68±0.097.26±0.14*1.61±0.0919.12±1.25*△401.42±0.0721.68±1.40*1.01±0.0645.46±1.96*△
注:与对照组比较,*P<0.05;与48 h组比较,△P<0.05。
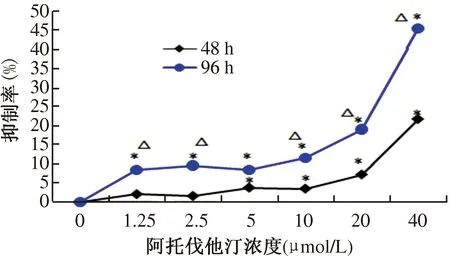
注:与对照组比较,*P<0.05;与48 h组比较,△P<0.05。
图1 不同浓度阿托他汀与HCT-116细胞生长抑制率的相关性分析
Fig 1 Correlation analysis of different concentrations of Atorvastatin and HCT-116 cell growth inhibition rate
2.2 不同浓度阿托伐他汀对NK细胞杀伤HCT-116细胞活性的影响 NK细胞对HCT-116细胞的杀伤活性在阿托伐他汀2.5~10 μmol/L的3个浓度组中均显著高于对照组(P<0.05),其中5 μmol/L浓度组NK细胞对HCT-116细胞的杀伤活性最高(见表2)。


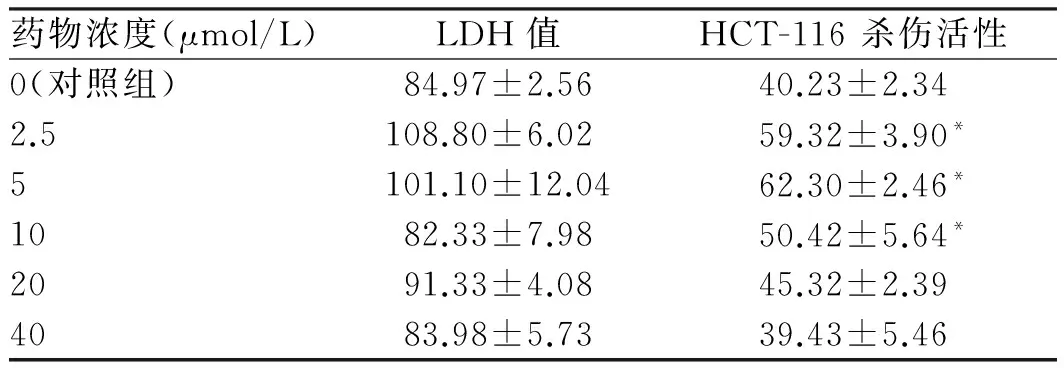
药物浓度(μmol/L)LDH值HCT-116杀伤活性0(对照组)84.97±2.5640.23±2.342.5108.80±6.0259.32±3.90*5101.10±12.0462.30±2.46*1082.33±7.9850.42±5.64*2091.33±4.0845.32±2.394083.98±5.7339.43±5.46
注:与对照组比较,*P<0.05; 1.2 μmol/L浓度组与对照组比较差异无统计学意义,未作统计。
2.3 不同浓度阿托伐他汀HCT-116细胞MIC浓度组A/B表达的影响 在2.5 μmol/L浓度组及5 μmol/L浓度组,HCT-116细胞MICA/B的表达率与对照组比较显著升高(P<0.05);40 μmol/L浓度组HCT-116细胞MICA/B表达率明显降低,与对照组比较差异有统计学意义(P<0.05,见表3)。
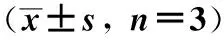


药物浓度μmol/L)MICA/B表达率P值0(对照组)51.29±2.80—2.570.98±2.10<0.05564.87±3.27<0.051055.40±3.83>0.052042.42±4.47>0.054027.19±2.78<0.05
注:1.25 μmol/L浓度组与对照组比较差异无统计学意义,未作统计。
3 讨论
结肠癌是一种发病率和死亡率均较高的恶性肿瘤,居我国男性恶性肿瘤发病率的第5位,女性的第3位[4]。由于结肠癌患者早期无明显症状,临床上确诊时大都已发展为中晚期,错过了最佳手术期,预后差、病死率高。为延长患者生存时间、提高患者生活质量,寻找新的、有效、低毒的治疗药物具有重要的临床意义。目前结肠癌的发病原因尚不明确,最近有报道认为可能为自身免疫性疾病,细胞免疫与实体肿瘤的抗肿瘤机制有关[5]。越来越多临床工作者研究利用药物增强免疫细胞的抗肿瘤功能来达到肿瘤治疗的目的。
他汀类药物作为临床常用的降血脂药物,近年来人们还发现其具有抗肿瘤作用,但目前抗肿瘤的相关机制尚不明确,多项研究表明可能与以下机制有关:(1)他汀类药物可通过抑制基因转录后的异戊二烯化从而抑制细胞生长,推测异戊二烯代谢物具有调节细胞增殖的作用[6];(2)Ras突变是肿瘤发生过程中经常发生的事件,他汀类药物可以抑制Ras蛋白翻译后修饰,阻滞Ras信号传导,从而影响细胞的增殖,并诱导细胞分化或凋亡。Park等[7]关于洛伐他汀对非小细胞肺癌细胞增殖研究中同样证实了这一点;(3)半胱氨酸蛋白酶(Caspase)是细胞凋亡中起重要作用的一类蛋白水解酶,Caspase活化与凋亡的启动有关,Bcl-2可阻碍细胞的凋亡过程。Cho等[8]通过小鼠结肠癌移植瘤动物实验中发现辛伐他汀可上调Caspase-3蛋白表达,下调Bcl-2表达,诱导HCT-l16细胞凋亡。本实验中应用不同浓度的阿托伐他汀作用于HCT-116,结果显示随着阿托伐他汀浓度的升高,对HCT-116生长抑制作用逐渐增强,分析结果显示两者呈正相关,证实阿托伐他汀呈剂量依赖性抑制HCT-116的生长,且延长作用时间可以增强阿托伐他汀对HCT-116细胞生长的抑制作用。
NK细胞是先天性免疫系统的重要组成部分,对靶细胞的识别无主要组织相容性复合体(major histocompatibility complex,MHC)限制性,肿瘤细胞表达的MICA分子与NK细胞表面的活化型受体NKG2D交联,可以促使NK细胞活化并产生穿孔素和颗粒酶裂解靶细胞,从而提高NK细胞对肿瘤的杀伤活性[9]。Pende等[10-11]研究发现,NK细胞对高表达MICA的肿瘤细胞杀伤活性明显高于低表达者或者阴性者,杀伤活性增强的机理可能与肿瘤细胞MICA等配体的表达上调诱导NK细胞的活化有关。本实验应用不同浓度阿托伐他汀作用48 h后的HCT-116与NK细胞配置成10∶1效靶比,发现NK细胞对HCT-116细胞的杀伤活性在阿托伐他汀5~10 μmol/L时显著高于对照组。证实阿托伐他汀可增强HCT-116细胞对结肠癌细胞杀伤活性,推测NK细胞的杀伤活性升高可能与阿托伐他汀提高HCT-116细胞NKG2D的配体MIC A/B表达有关。
MICA是位于HLA-B位点上游约46 kb的基因,具有多态性[12],其编码产物介导细胞应激时的信号转导,该分子在正常细胞和组织中不表达,但癌变、感染或应激状态可上调其表达,MICA具有免疫原性,是一种肿瘤相关抗原[13]。Li等[14]运用免疫组化检测82例卵巢癌患者肿瘤组织MICA/B表达,结果表明肿瘤组织中MICA/B表达率高达97.6%,而正常组织中基本不表达。而Watson等[15]研究结果显示结直肠癌MICA高表达可作为结直肠癌预后良好的指标之一。本实验结果显示不同浓度阿托伐他汀作用于HCT-116细胞48 h后,在阿托伐他汀浓度2.5 μmol/L及5 μmol/L组, MICA/B的表达率与对照组比较显著升高,差异有统计学意义,证实阿托伐他汀可以上调HCT-116细胞MICA/B的表达,增强其免疫原性,有利于NK细胞表面NKG2D受体的识别,提高NK细胞对HCT-116细胞的杀伤活性。
本研究证实阿托伐他汀能抑HCT-116细胞的增殖,能通过上调HCT-116细胞表达MICA/B,增强NKG2D受体识别MICA/B的能力,从而达到增强NK细胞杀伤HCT-116细胞敏感性。实验研究表明两者存在着药物剂量的依赖性,如何找到一种安全合适剂量进行抗肿瘤治疗是需要解决的问题。
[1]Shaukat A, Mongin SJ, Geisser MS, et al. Long-term mortality after screening for colorectal cancer [J]. N Engl J Med, 2013, 369(12): 1106-1114.
[2]Siegel R, Naishadham D, Jemal A. Cancer stalistics 2012 [J].CA Cancer J Clin, 2012, 62(1): 10-29.
[3]Zhao XB, Ni M, Tao X. Progress on the multiple pharmacological activity and mechanism of statins [J]. Journal of Pharmaceutical Practice, 2013, 31(1): 19-21. 赵心彬, 倪敏, 陶霞. 他汀类药物多效药理作用及其机制研究进展 [J]. 药学实践杂志, 2013, 31(1): 19-21.
[4]Chen WQ, Zheng RS, Zeng HM, et al. Report of cancer incidence and mortality in China, 2011 [J]. China Cancer, 2015, 24(1): 1-10. 陈万青, 郑荣寿, 曾红梅, 等. 2011年中国恶性肿瘤发病和死亡分析 [J]. 中国肿瘤, 2015, 24(1): 1-10.
[5]Zhang X, Jin J, Peng X, et al. Simvastatin inhibits IL-17 secretion by inhibiting the expression of IL-17 transcription factor RORC in CD4+lymphocytes [J].J Immunol, 2008, 180(10): 6988-6996.
[6]Su KL, Yin LL, Li J. Anti-tumour effects of statins [J]. J Int Oncol, 2013, 40(5): 342-344. 苏克莉, 尹林林, 李静. 他汀类药物抗肿瘤作用机制 [J]. 国际肿瘤学杂志, 2013, 40(5): 342-344.
[7]Park IH, Kim JY, Jung JI, et al. Lovastatin overcomes gefitinib resistance in human non-small cell lung canecr cells with K-Ras mutations [J]. Invest New Drugs, 2010, 28(6): 791-799.
[8]Cho SJ, Kim JS, Kim JM, et al. Simvastafin induces apoptasis in human colon cancer cells and in tumor xenografts and attenuates colitis-associated colon cancer in mice [J]. Int J Cancer, 2008, 123(4): 95l-957.
[9]Zwirner NW, Fuertes MB, Girart MV, et al. Cytokine-driven regulation of NK cell functions in tumor immunity:role of the MICA-NKG2D system [J]. Cytokine Growth Factor Rev, 2007, 18(1-2): 159-170.
[10]Pende D, Rivera P, Marcenaro S, et al. Major histocompatibility complex class I-related chain A and UL16-binding protein expression on tumor cell lines of different histotypes: analysis of tumor susceptibility to NKG2D-dependent natural killer cell cytotoxicity [J]. Cancer Res, 2002, 62(21): 6178-6186.
[11]Raffaghello L, Prigione I, Airoldi I, et al. Downregulation and/or lease of NKG2D ligands as immune evasion strategy of human neuroblastoma [J]. Neoplasia, 2004, 6(8): 558-568.
[12]Dragun D, Philippe A, Catar R. Role of non-HLA antibodies in organ transplantation [J]. Curr Opin Organ Transplant, 2012, 17(4): 440-445.
[13]Cerwenka A, Lanier LL. NKG2D ligands: unconventional MHC class I-like molecules exploited by viruses and cancer [J]. Tissue Antigens, 2003, 61(5): 335-343.
[14]Li K, Mandai M, Hamanishi J, et al. Clinical significance of the NKG2D ligands, MICA/B and ΜLBP2 in ovarian cancer: high expression of ΜLBP2 is an indicator of poor prognosis [J]. Cancer Immunol Immunother, 2009, 58(5): 641-652.
[15]Watson NF, Spendlove I, Madjd Z, et al. Expression of the stress-related MHC class I chain-related protein MICA is an indicator of good prognosis in colorectal cancer patients [J]. Int J Cancer, 2006, 118(6): 1445-1452.
(责任编辑:马军)
The effect and mechanism of Atorvastatin on the cytotoxicity of human NK cells to HCT-116 cells
JI Huichun1, ZHOU Yu2, LIU Junquan2, CHEN Fuxing2, LI Yi2, FEI Sujuan3
1.School of Postgraduate, Xuzhou Medical College, Xuzhou 221002; 2.Department of Laboratory, the 97th Hospital of PLA; 3.Department of Gastroenterology, the Affiliated Hospital of Xuzhou Medical College, China
Objective To investigate the mechanism of the cytotoxicity of NK cell induced by Atorvastatin to HCT-116 cells.Methods The effect of different concentrations of Atorvastatin on the growth of HCT-116 cells was measured by CCK-8. Automatic biochemical analyzer was applied to test the cytotoxicity of NK cells to HCT-116 cells. Flow cytometry (FCM) was used to detect the expression rate of MICA/B in the cells.Results Atorvastatin could inhibit the growth of HCT-116 cells, the inhitbition rates of HCT-116 were higher than those in the control group in different concentrations of Atorvastatin treatment 48 hours and 96 hours. Statistical analysis showed that the inhibition rates of HCT-116 had significant difference compared with the control group (P<0.05) when Atorvastatin was 5-40 μmol/L after 48 hours and 1.25-40 μmol/L after 96 hours. Correlation analysis showed that the concentration of Atorvastatin and the growth inhibition rate of HCT-116 cells were positively correlated(r[48h]=0.13,r[96h]=0.22,P<0.05). The cytotoxicity of NK cells to HCT-116 cells was higher than the control group when Atorvastatin was 2.5-10 μmol/L (P<0.05). The expression of MICA/B on HCT-116 cells was higher than the control group (P<0.05) in the concentration of 2.5 μmol/L and 5 μmol/L.Conclusion Atorvastatin could inhibit the growth of HCT-116 cells in a dose-dependent manner; and it could enhance the cytotoxic activity of the NK cells to HCT-116 cells; it also could promote the expression of MICA/B on HCT-116 cells, and improve the immunogenicity of HCT-116 cells.
Atorvastatin; HCT-116; Natural Killer cells; MICA/B
南京军区医学科技创新课题(13MA039)
姬会春,硕士研究生,主治医师,研究方向:消化道肿瘤免疫治疗。E-mail:48587581@qq.com
费素娟,硕士,教授,硕士生导师,主任医师,研究方向:消化系肿瘤的基础与临床研究。E-mail:feisj1031@ yahoo.com.cn
10.3969/j.issn.1006-5709.2016.03.019
R735.3
A
1006-5709(2016)03-0304-04
2015-06-04

