miR-181a及其靶基因Atg5在胃癌中的表达及临床意义
周 艺,聂玉强,林 泳,杜艳蕾
广州医科大学附属广州市第一人民医院消化内科,广东 广州 510180
miR-181a及其靶基因Atg5在胃癌中的表达及临床意义
周 艺,聂玉强,林 泳,杜艳蕾
广州医科大学附属广州市第一人民医院消化内科,广东 广州 510180
目的 研究miR-181a及其靶基因Atg5在人胃癌细胞株和胃癌组织中的表达及其与临床病理参数的关系。方法 体外培养人胃癌细胞株(MGC-803、SGC-7901、BGC-823)和正常胃黏膜细胞株(GSE-1),收集30例胃癌血清和手术切除的癌组织及癌旁正常组织,并以30名正常人血清标本为对照,应用实时荧光定量PCR(qRT-PCR)技术检测血清、细胞株、组织中miR-181a及细胞株、组织中Atg5 mRNA的表达情况。结果 胃癌细胞株、组织、血液中miR-181a的表达较正常细胞、癌旁正常组织及正常人血清明显升高(P<0.05);Atg5 mRNA相对表达量在胃癌细胞株和胃癌组织中均分别低于正常胃黏膜细胞株和癌旁正常组织(P<0.05)。在胃癌组织和癌旁正常组织中,miR-181a与Atg5 mRNA表达呈负相关。结论 miR-181a在胃癌细胞株、胃癌组织和血清中显著高表达,提示其有望成为潜在的胃癌标志物。Atg5在胃癌中低表达并与miR-181a表达呈负相关,提示其可能是miR-181a在胃癌中的潜在作用靶基因。
胃癌;miR-181a;Atg5;RT-PCR
在世界范围内,胃癌正严重威胁着人们的健康[1]。microRNA(miRNA)参与了肿瘤的发生、增殖、侵袭、转移、复发等多种恶性生物学行为的调控[2]。miRNA通过其“种子区”与靶基因的3’非翻译区(3’UTR)的完整配对,使mRNA降解或者抑止mRNA的翻译,从而转录后调控靶基因表达[3]。我们课题组前期通过基因芯片和qRT-PCR证实miR-181a作为癌基因在胃癌的进展中起重要作用[4-5]。自噬是细胞一个有高度保护作用的代谢途径,能降解异常的蛋白质和受损的细胞器,是保护细胞癌变的一个机制[6]。
自噬也是恶性肿瘤形成及恶性肿瘤发展的一个关键步骤,一些自噬相关蛋白(如:Bif-1、Beclin1、Atg4C、Atg5、UVRAG)具有肿瘤抑制活性[7-8]。Tekirdag等[9]研究发现Atg5是miR-181a的靶基因,miR-181a的过表达会减少Atg5蛋白和mRNA的表达水平,miR-181a是一种新的自噬调控通路。因此,本研究探讨miR-181a、Atg5的表达水平在胃癌发生、发展中的临床意义,为胃癌的诊治等提供新的参考依据。
1 材料与方法
1.1 细胞、血液组织标本来源 GES-1、BGC-823、MGC-803均由南方医科大学消化科惠赠,SGC-7901购自南京凯基生物。配对胃癌组织血液标本30例,其中高分化腺癌1例,中分化腺癌16例,低分化腺癌13例;18例有局部淋巴结转移。25例为外科手术切除病灶获得,5例胃镜活检所得,所有标本均经病理学确诊,全部病例收取标本前均未行放疗、化疗。对照组外周血为在广州市第一人民医院住院的非肿瘤患者(经胃、肠镜、影像学、实验室检查排除肿瘤),以急性胃肠炎、功能性胃肠病等疾病为主,并排除合并有胃肠道息肉、胃溃疡、炎症性肠病等共30例。标本取出立即放液氮速冻后存放在-80 ℃冰箱。血液用抗凝管采集1~2 h,3 000 r/min离心置于-80 ℃冰箱,用于提取总RNA 或microRNA。
1.2 引物设计与合成 miR-181a及内参U6由Qiagen公司设计合成,Atg5自UCSC 数据库(http://genome.ucsc.edu/) 查找基因序列,用Primer-Express 2.0软件进行引物设计。
1.3 实验方法
1.3.1 总RNA和miRNA提取:用TRIZOL提取细胞和组织中的总RNA,血液中miRNA按QIGEN血清中提取miRNA试剂盒的操作说明,检测OD260/280值,判断纯度;RNA样品在1%琼脂糖凝胶电泳观察总RNA中的5s rRNA、18s rRNA和28s rRNA条带,3条条带完整即证明总RNA抽提比较完整。
1.3.2 miR-181a的检测:应用实时荧光定量PCR(qRT-PCR)技术检测miR-181a的表达:按照QIGEN逆转录试剂盒的操作说明合成cDNA,qRT-PCR使用的是MJ Research荧光定量PCR仪和Opticon Monitor 2软件操作系统,PCR反应试剂购自QIGEN,U6和miR-181a的PCR反应条件:预变性:95 ℃,15 min,PCR反应:94 ℃,15 s;55 ℃,30 s;70 ℃,30 s。对55 ℃到95 ℃升温过程进行全程荧光信号收集,绘制溶解曲线。以U6作为内参,用2-△△Ct比较目的基因在癌组织、癌旁组织及正常胃黏膜组织中的表达差异。
1.3.3 Atg5 mRNA的检测:应用RT-PCR技术检测组织中Atg5的表达,总mRNA提取,mRNA浓度、纯度及完整性测定方法与上述相同:按照TAKARA逆转录试剂盒操作说明合成cDNA,PCR反应条件为: 预变性95 ℃,30 s,1个循环; PCR反应:95 ℃,5 s;60 ℃,20 s;40个循环,融解曲线分析 95 ℃,60 s;65 ℃,60 s;从65 ℃开始每1 s加热0.1 ℃直至95 ℃。用U6作为内参进行分析。

2 结果
2.1 miR-181a的表达量 胃癌细胞株中miR-181a的表达量均高于正常胃黏膜细胞中miR-181a的表达量(P<0.05),而MGC-803、 SGC-7901、BGC-823 三种癌细胞柱间miR-181a的表达量比较差异无统计学意义(P>0.05)。miR-181a在正常组织和胃癌组织中的mRNA的表达量分别为1.0021和3.1205,而在血液中mRNA 的表达量正常组为 0.4536,胃癌组为1.2702,两组比较差异有统计学意义(P<0.05,见图1)。

注:1组为组织中miR-181a含量水平;2组为血液中miR-181a含量水平,与正常组比较,*P<0.05。
图1 胃癌组与正常组miR-181a的表达量比较
Fig 1 Comparison of miR-181a expression between gastric cancer group and control group
2.2 Atg5 mRNA相对表达量 胃癌细胞株中Atg5 mRNA相对表达量低于正常胃黏膜细胞株(P<0.05),MGC-803、 SGC-7901、BGC-823 三种癌细胞株间Atg5 的表达量比较差异无统计学意义(P>0.05),Atg5 在正常组和胃癌组组织中表达量分别为0.6896和0.2429,两组比较差异有统计学意义(P<0.05)。
2.3 Atg5表达与miR-181a表达的关系 在正常细胞株和胃癌细胞株中Atg5与miR-181a呈负相关(r=-0.999,P<0.05)。在30例胃癌组织中28例Atg5的表达降低,26例的miR-181a高表达,显示在胃癌组织中Atg5与miR-181a的表达呈负相关(r=-0.459,P<0.05,见图2)。
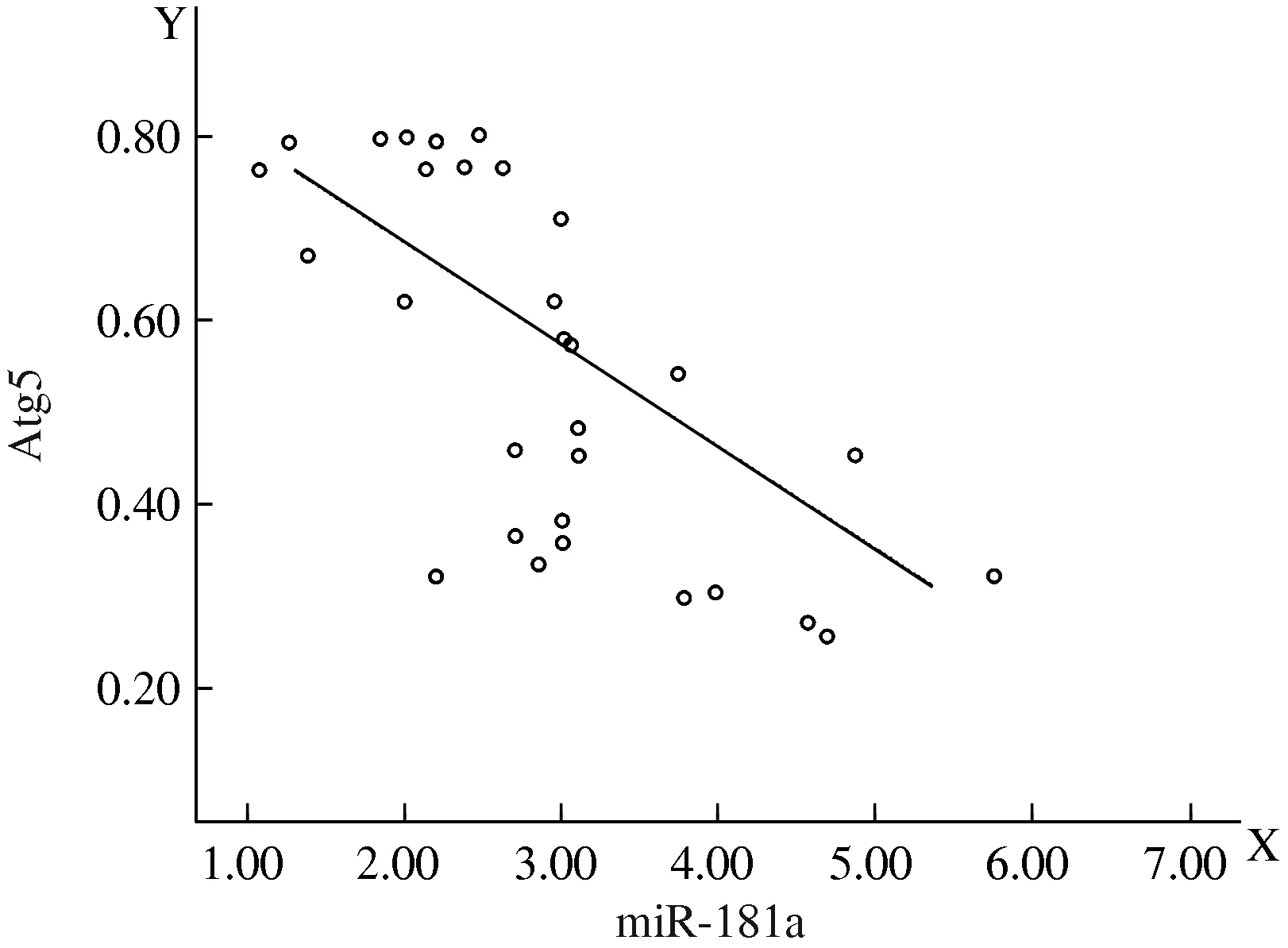
图2 胃癌组织中Atg5与miR-181a的相关性分析
Fig 2 Correlation analysis of Atg5 and miR-181a expression in gastric cancer
3 讨论
miRNA是一种内源性的19~25个核苷酸组成的小分子RNA,广泛存在于真核生物中,经由核糖核酸酶Drosha和Dice切割。miR-181家族的成员有4个:miR-181a、miR-181b、miR-181c和miR181d,研究发现多个mRNAs受这4个成员的调控,而miR-181a是其中重要的一员,能通过与Bcl-2等基因的靶向调节,调控肿瘤的发生、发展。在口腔癌、神经胶质瘤、胃癌等肿瘤的形成和发展中起重要作用。Yang 等[10 ]发现miR-181可调控细胞的运动,在口腔癌中呈高表达与淋巴结转移、血管侵袭及不良预后密切相关。Guo 等[11]通过 qRT-PCR 等方法发现miR-181家族4个成员在人胃癌细胞系中与正常胃黏膜细胞相比表达均上调。
Huang等[12]发现某些miRNA调控的mRNA参与自噬过程,包括miR-181a和miR-374a。实验发现miR-181a抑制剂能增加Atg5蛋白表达,Tekirdag等[13]发现在饥饿和雷帕霉素两种常见的自噬应激条件下都有miR-181a的过表达。miR-181a作为一个新的分子调控自噬通路,在细胞自噬调控中具有关键作用。miR-181a的过表达会减少Atg5蛋白和mRNA的表达水平,由于在Atg5基因的3’UTR区域中发现了MRE作为miR-181a的应答区域,且这段序列的突变会影响到miRNA的作用,因此在细胞自噬过程中,Atg5是作为miR-181a的限速靶基因和重要因素。根据本研究结果miR-181a高表达,推测miR-181a升高引起自噬活性抑制导致自噬基因Atg5表达下调有关,即随着淋巴转移的增加,miR-181a 蛋白的表达水平也随之升高;随着细胞分化程度降低,Atg5的 mRNA表达水平也随之下降。提示胃癌的发生、发展与miR-181a和Atg5 密切相关。因此,结合前面的研究结果,我们认为:在胃癌中miR-181a的高表达引起Atg5的表达降低,从而影响胃癌的发生、发展。胃癌患者血清中miR-181a表达量明显上调,可作为肿瘤标志物进一步深入研究。
[1]NCCN gastric cancer clinical practice guidelines (Chinese version) expert group. NCCN clinical practice guidelines for gastric cancer (China Version) [C]. 2011,MS-1. NCCN胃癌临床实践指南(中国版)专家组. NCCN胃癌临床实践指南(中国版)[C]. 2011,MS-1.
[2]Giordano S, Columbano A. MicroRNAs: new tools for diagnosis, prognosis, and therapy in hepatocellular carcinoma?[J]. Hepatology, 2013, 57(2): 840-847.
[3]Brodersen P, Voinnet O. Revisiting the principles of microRNA target recognition and mode of action [J]. Nat Rev Mol Cell Biol, 2009, 10(2): 141-148.
[4]Ye M, Nie YQ, Chen X, et al. Differential expression of microRNA in gastric carcinoma tissue [J]. Chin J Biomed Eng, 2011, 17 (5): 403-406. 叶敏, 聂玉强, 陈熙, 等. 胃癌组织中microRNA的差异表达[J].中华生物医学工程杂志, 2011, 17(5): 403-406.
[5]Zhang X, Nie Y, Du Y, et al. MicroRNA-181a promotes gastric cancer by negatively regulating tumor suppressor KLF6 [J]. Tumour Biol, 2012, 33(5): 1589-1597.
[6]Pattingre S, Espert L, Biard-Piechaczyk M, et al. Regulation of macroautophagy by mTOR and Beclin 1 complexes [J]. Biochimie, 2008, 90(2): 313-323.
[7]Jin S, White E. Role of autophagy in cancer: management of metabolic stress [J]. Autophagy, 2007, 3(1): 28-31.
[8]Mizushima N, Levine B, Cuervo AM, et al. Autophagy fights disease through cellular self-digestion [J]. Nature, 2008, 451(7182): 1069-1075.
[9]Tekirdag KA, Korkmaz G, Ozturk DG, et al. MIR181A regulates starvation- and rapamycininduced autophagy through targeting of Atg5 [J]. Autophagy 2013, 9(3): 374-385.
[10]Yang CC, Hung PS, Wang PW, et al. miR-181 as a putative biomarker for lymph-node metastasis of oral squamous cell carcinoma [J]. J Oral Pathol Med, 2011, 40(5): 397-404.
[11]Guo JX, Tao QS, Lou PR, et al. miR-181b as a potential molecular target for anticancer therapy of gastric neoplasms [J]. Asian Pac J Cancer Prev, 2012, 13(5): 2263-2267.
[12]Huang Y, Guerrero-Preston R, Ratovitski EA, et al. Phospho-ΔNp63α-dependent regulation of autophagic signaling through transcription and micro-RNA modulation [J]. 2012, 11(6): 1247-1259.
[13]Tekirdag KA, Korkmaz G, Ozturk DG, et al. MIR181A regulates starvation-and rapamycin-induced autophagy through targeting of Atg5 [J]. Autophagy, 2013, 9(3): 374-385.
(责任编辑:李 健)
Expression and clinical significance of miR-181a and its target gene Atg5 in gastric cancer
ZHOU Yi, NIE Yuqiang, LIN Yong, DU Yanlei
Department of Gastroenterology, Guangzhou First People’s Hospital, Guangzhou Medical University, Guangzhou 510180, China
Objective To study expressions of miR-181a and its target gene Atg5 in human gastric cancer tissue and cell lines and to investigate whether these two genes expression changes were related with the clinicopathological parameters. Methods The miRNA levels of both miR-181a and Atg5 were detected by qRT-PCR in the gastric cancer cell line (MGC-803, SGC-7901 and BGC-823) and normal gastric mucosa cell lines (GSE) in vitro, in the gastric adenocarcinoma tissue and the adjacent to non-carcinoma tissue specimens from 30 gastric cancer patients. qRt-PCR was used to detect miR-181a expression in the serum of 30 gastric cancer patients and 30 healthy people. Results The expression of miR-181a in gastric cancer cells, serum and the gastric cancer tissue was increased significantly compared with the cells and the serum of healthy controls groups, and also the adjacent to non-carcinoma specimens (P<0.05). Atg5 mRNA expression in gastric cancer cells and the gastric cancer tissue was significantly lower than that in normal gastric mucosa cell lines and normal tissue adjacent to carcinoma (P<0.05). miR-181a mRNA expression had a negative correlation with Atg5 mRNA expression in gastric cancer tissue and normal tissue adjacent to carcinoma. Conclusion In gastric cancer cell lines, cancer tissue and serum of gastric cancer patients, miR-181a expression is significantly elevated, suggesting that it may be the potential markers for gastric carcinoma. Atg5 has low expression in gastric cancer and has a negative correlation with miR-181a, suggesting it may be the potential target gene of miR-181a in gastric cancer.
Gastric cancer; MiR-181a; Atg5; RT-PCR
10.3969/j.issn.1006-5709.2016.03.010
国家自然科学基金(813802078)
周艺,硕士研究生,研究方向:消化道肿瘤。E-mail:158005515@qq.com
聂玉强,主任医师,博士,E-mail:158005515@qq.com
R735.2
A
1006-5709(2016)03-0276-03
2015-05-12

