槲皮素对动脉粥样硬化小鼠自噬蛋白表达的影响
刘 亮 高 超 姚 平 宫智勇
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
槲皮素对动脉粥样硬化小鼠自噬蛋白表达的影响
刘亮高超1姚平2宫智勇
(武汉轻工大学食品科学与工程学院,湖北武汉430023)
〔摘要〕目的探讨槲皮素对高脂膳食诱导动脉粥样硬化(AS)小鼠自噬相关蛋白表达的影响。方法采用高脂高胆固醇膳食喂养apoE-/-小鼠24 w,建立AS模型,同时给予三个剂量槲皮素干预。饲养结束后处死动物,分离主动脉,用油红O染色检测主动脉脂质沉积;用Western印迹方法检测主动脉组织中雷帕霉素靶蛋白(mTOR)、p62和溶酶体相关膜蛋白2(LAMP-2)的蛋白表达变化。结果与模型组小鼠相比,100 mg/kg体重的槲皮素干预可显著减少(P<0.05)小鼠主动脉脂质浸润并缓解AS损伤,而50 mg/kg体重和100 mg/kg体重槲皮素干预均能使AS小鼠主动脉组织中mTOR、p62和LAMP-2蛋白表达显著下调(P<0.05)。结论高脂膳食诱导的小鼠自噬功能损伤可能是AS的发病机制之一,槲皮素可通过自噬调节功能缓解AS损伤。
〔关键词〕槲皮素;动脉粥样硬化;自噬;溶酶体
1中国疾病预防控制中心营养与健康所
2华中科技大学公共卫生学院营养与食品卫生学系
第一作者:刘亮(1979-),男,博士,讲师,硕士生导师,主要从事食品营养研究。
黄酮类化合物可降低心脑血管疾病(CVD)风险〔1〕。Macready等〔2〕的最新研究也发现,富含黄酮类化合物的水果和蔬菜的摄入量与CVD事件显著相关。槲皮素及其衍生物广泛存在于植物的花、叶、果实当中,也是人类饮食中最主要的生物类黄酮(约占膳食总黄酮摄入量的60%~75%)。研究发现,槲皮素与其他黄酮类化合物相比,在预防动脉粥样硬化(AS)发生发展过程中似乎具有更加优越的性能〔3〕。利用自行合成的单抗,Kawai〔4〕发现,槲皮素可选择性地富集于AS斑块内活化的巨噬细胞中而非正常的动脉组织,为槲皮素的抗AS效应奠定了直接的物质基础。但槲皮素预防AS的分子机制至今仍未详尽阐明。因此,本研究采用高脂膳食喂养载脂蛋白E基因敲除(ApoE-/-)小鼠建立AS模型,并同时进行槲皮素干预,探讨槲皮素对高脂诱导AS的保护效应及其相关机制。
1材料与方法
1.1主要试剂槲皮素(≥95%)购于美国sigma公司;兔抗雷帕霉素靶蛋白(mTOR)抗体、兔抗p62抗体、HRP标记抗兔IgG抗体、辣根过氧化物酶(HRP)标记抗小鼠IgG抗体、HRP标记抗大鼠IgG抗体均购自美国Cell Signal公司;大鼠抗LAMP-2抗体购自美国santa cruz公司;小鼠抗GAPDH抗体购自博士德生物有限公司。
1.2实验动物75只6周龄雄性ApoE-/-小鼠以及15只相同遗传背景下野生型C57BL/6小鼠,体重(18±2)g,购于北京维通利华实验动物技术有限公司。
1.3动物分组及模型建立50只ApoE-/-小鼠在SPF级动物房适应性喂养1 w后随机分为普通饲料组(ND)、高脂组(HFD)、低(25 mg/kg体重)、中(50 mg/kg体重)、高(100 mg/kg体重)三个剂量槲皮素干预组(HFD+LQR、HFD+MQR、HFD+HQR组),高脂饲料配方含胆固醇1.25%,脂肪21%〔5〕;以10只相同遗传背景下野生型C57BL/6小鼠为对照组(CT),持续喂养24 w。实验期间每周称量体重和进食量。所有小鼠均按照动物饲养标准饲养于同济医学院营养与食品卫生系SPF级动物实验室(SYXK鄂 2005-0033),控制房间温度(24±1)℃,明暗交替周期12/12 h。
1.4主动脉横截面油红O染色每组随机抽取4只小鼠,以2%戊巴比妥钠麻醉后,连同主动脉根部分离心脏,OCT包埋并于冰冻切片机(-20℃)切片,切片厚度为10 μm,油红O染色后在显微镜下观察血管内壁脂质浸润情况,以红色斑块面积占主动脉管腔横截面的面积(回归标准圆形)的百分比代表AS病变的相对大小。
1.5小鼠主动脉组织中自噬相关蛋白表达检测主动脉组织经生理盐水匀浆离心后,取上清采用改良Lowry法测定蛋白浓度后,以最低浓度组为标准调整蛋白浓度,取30~50 μg蛋白,经8%~12%的SDS-PAGE凝胶电泳后转至PVDF膜,置5%牛奶室温封闭2 h或者4℃过夜后,将膜分别置于兔抗鼠mTOR、LAMP-2、p62和内参中4℃过夜或者室温摇床孵育,用带有HRP标记的羊抗兔IgG液孵育洗涤后的上述结合相应一抗的PVDF膜1 h,洗膜后在膜上滴加ECL发光试剂约3~5 min,充分孵育后吸干发光试剂,将膜置于玻璃板上且在凝胶成像系统中成像。用Gel Pro 3.0软件读取条带积分光密度值(OD),以目的蛋白的OD值除以内参条带的OD值作为目的蛋白的相对OD值,每个蛋白至少取三组条带进行分析。
2结果
2.1槲皮素对AS小鼠主动脉斑块损伤面积的影响(油红O染色)HFD组小鼠动脉管壁厚薄不均,脂质浸润严重,内膜明显增厚,管腔狭窄,内膜处可见纤维组织增生,替代平滑肌细胞,可见由大量泡沫细胞形成的脂纹、脂斑;平滑肌细胞显著增生,尚能见由纤维帽覆盖的纤维斑块期病变;血管内可见明显针状胆固醇结晶。而ND组则表现出动脉壁完整,厚薄均匀,并且内膜、中膜及外膜均未见明显异常,基本无AS病灶;血管内无血栓、胆固醇沉积;平滑肌细胞呈长条形、梭形,细胞核成椭圆形或梭形。与HFD组相比,三个剂量槲皮素干预后病变程度有所缓解,但依然有大量红色脂滴浸润和少量胆固醇结晶,其中高剂量槲皮素可显著减少(P<0.05)脂质浸润。见表1,图1。
2.2槲皮素对高脂膳食mTOR和p62蛋白表达的影响与ND组相比,HFD组小鼠主动脉组织中mTOR的蛋白表达显著下降(P<0.01)。与HFD组相比,中、高剂量槲皮素干预后小鼠主动脉组织中的mTOR的蛋白表达进一步显著下降(P<0.05)。HFD组小鼠p62的蛋白表达量虽高于ND组,但无统计学差异。与HFD组相比,槲皮素干预后p62的蛋白表达下调,但只有中、高剂量的槲皮素对p62的下调具有统计学差异(P<0.05)。见表1,图2。
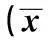
表1 槲皮素对小鼠主动脉斑块面积和蛋白表达的影响±s,n=4)
与ND组比较:1)P<0.01;与HFD组比较:2)P<0.05,3)P<0.01

图1 主动脉横截面油红O染色(×100)及斑块损伤面积分析
2.3槲皮素对高脂膳食LAMP-2蛋白表达的影响HFD组小鼠主动脉LAMP-2的蛋白表达显著上调(P<0.01),槲皮素干预可抑制高脂膳食对LAMP-2的诱导作用,其中高剂量槲皮素对LAMP-2的抑制达到极显著水平(P<0.01)。见表1,图3。

图2 槲皮素对mTOR和p62蛋白表达的影响

图3 槲皮素对LAMP-2蛋白表达的影响
3讨论
在本研究中,小鼠经24 w高脂膳食后主动脉血管结构发生明显变化,并出现AS的典型特征,而槲皮素干预后可使该变化得以缓解。研究证实,槲皮素还可以降低高脂喂养小鼠肝脏脂质积累,降低与脂肪肝相关基因表达〔6〕,调节肝脏脂质代谢相关基因表达〔7〕,提高巨噬细胞胆固醇输出〔8〕,保护低密度脂蛋白诱导的巨噬细胞凋亡〔9〕。本文发现,低、中剂量槲皮素干预后斑块面积变化没有显著差异,这可能因为饲养周期过长,AS病变过于严重,槲皮素生物活性以不足以修复和逆转由此造成的严重主动脉损伤;还有可能是因为小鼠的个体差异以及样本量不够多,以致显著性被掩盖。
自噬是细胞溶酶体代谢降解长寿蛋白和衰老受损细胞器等物质且相对保守的生物过程,也是维持细胞稳态和能量代谢的重要调节机制〔10〕。大量研究表明,多种疾病与自噬机制有关〔11〕。主动脉大量脂质积累是AS的显著特征,脂质积累的泡沫细胞的形成是启动AS形成的关键步骤〔12〕。目前,他汀类药物被认为是临床上稳定AS斑块的常用有效药物,但是当患者服用该类制剂后仍存在心血管疾病(CAD)的较大风险,表明AS的有效预防仍面临严峻挑战〔13〕。2009年首次发现自噬机制参与脂滴降解,自噬体可将脂滴输送到溶酶体腔内水解〔14〕。因此,自噬调节脂质代谢成为一个新的研究领域。虽然Zhang等〔15〕用ox-LDL诱导脐静脉内皮细胞后发现自噬-溶酶体途径参与了ox-LDL吸收后的降解,但该结果只是在细胞水平上验证,在体内具体过程仍待深入研究。
哺乳动物雷帕霉素靶蛋白(mTOR)是自噬的有效抑制剂,通过抑制mTOR可以作为治疗CAD的有效方法〔16〕。由此可知,mTOR作为自噬的负调节蛋白,抑制mTOR的表达可以作为缓解晚期AS的有效方式〔17〕。本研究的结果与以上报道观点一致,抑制mTOR可显著活化自噬体〔18〕。本实验条件下,高脂膳食可诱导自噬,而槲皮素干预使自噬能力得到进一步加强。
p62/SQSTM1是应激可诱导蛋白,可以调节细胞生存和死亡的多个信号通路〔19〕,也是目前已知最好的自噬特异性底物和评价“自噬潮”最有效的标记物〔20〕。Mathew等〔21〕研究发现自噬损伤可导致p62大量积累。本研究结果显示,高脂膳食并没有引起小鼠肝脏和主动脉组织中p62积累,说明该模型下组织的自噬功能并没有受到严重损伤,这可能与自噬的自我反馈修复机制有关。因为研究表明自噬可以调节p62蛋白表达水平,相反,p62也可以通过活化mTOR的方式抑制自噬〔19〕。本文中,中、高剂量槲皮素干预可显著降低p62蛋白表达水平,这表明槲皮素干预可以促进自噬体形成〔18〕,并可能进一步通过增加自噬机制降解溶酶体内的脂质,而且这一变化趋势与mTOR蛋白表达基本保持一致。
LAMP-2在介导溶酶体与自噬体融合中具有实质性的作用〔15〕。在临床调查的外周白细胞的CAD病人中,LAMP-2的基因和蛋白表达水平显著增加,这表明溶酶体大量积累。这一结果也充分说明,溶酶体水解酶和蛋白表达不足,从而导致脂质代谢和胆固醇异常,这可能也是造成CAD始发和进展的主要原因之一。对134例CAD病人外周白细胞溶酶体标记蛋白LAMP-2分析发现,CAD病人外周白细胞LAMP-2的基因表达和蛋白表达水平显著上升〔22〕。心肌梗死病人外周白细胞中LC3的基因和蛋白表达水平显著降低,而LAMP-2的基因和蛋白表达水平显著提高〔23〕,本研究LAMP-2蛋白表达趋势与上述报道一致。
本研究表明,槲皮素在AS发病过程中对自噬具有明显调节作用,这可能是槲皮素发挥预防AS发病的可能机制之一。
4参考文献
1Mozaffarian D,Kumanyika SK,Lemaitre RN,etal.Cereal,fruit,and vegetable fiber intake and the risk of cardiovascular disease in elderly individuals〔J〕.JAMA,2003;289(13):1659-66.
2Macready AL,George TW,Chong MF,etal.Flavonoid-rich fruit and vegetables improve microvascular reactivity and inflammatory status in men at risk of cardiovascular disease-FLAVURS:a randomized controlled trial〔J〕.Am J Clin Nutr,2014;99(3):479-89.
3Loke WM,Proudfoot JM,Hodgson JM,etal.Specific dietary polyphenols attenuate atherosclerosis in apolipoprotein E-knockout mice by alleviating inflammation and endothelial dysfunction〔J〕.Arterioscler Thromb Vasc Biol,2010;30(4):749-57.
4Kawai Y.Immunochemical detection of food-derived polyphenols in the aorta:macrophages as a major target underlying the anti-atherosclerotic activity of polyphenols〔J〕.Biosci Biotechnol Biochem,2011;75(4):609-17.
5Saeed O,Otsuka F,Polavarapu R,etal.Pharmacological suppression of hepcidin increases macrophage cholesterol efflux and reduces foam cell formation and atherosclerosis〔J〕.Arterioscler Thromb Vasc Biol,2012;32(2):299-307.
6Kobori M,Masumoto S,Akimoto Y,etal.Chronic dietary intake of quercetin alleviates hepatic fat accumulation associated with consumption of a Western-style diet in C57/BL6J mice〔J〕.Mol Nutr Food Res,2011;55(4):530-40.
7Jung C H,Cho I,Ahn J,etal.Quercetin reduces high-fat diet-induced fat accumulation in the liver by regulating lipid metabolism genes〔J〕.Phytother Res,2013;27(1):139-43.
8Chang YC,Lee TS,Chiang AN.Quercetin enhances ABCA1 expression and cholesterol efflux through a p38-dependent pathway in macrophages〔J〕.J Lipid Res,2012;53(9):1840-50.
9Yao S,Sang H,Song G,etal.Quercetin protects macrophages from oxidized low-density lipoprotein-induced apoptosis by inhibiting the endoplasmic reticulum stress-C/EBP homologous protein pathway〔J〕.Exp Biol Med (Maywood),2012;237(7):822-31.
10Ravikumar B,Sarkar S,Davies JE,etal.Regulation of mammalian autophagy in physiology and pathophysiology〔J〕.Physiol Rev,2010;90(4):1383-435.
11De Meyer G R,Martinet W.Autophagy in the cardiovascular system〔J〕.Biochim Biophys Acta,2009;1793(9):1485-95.
12Wang L,Cheng X,Li H,etal.Quercetin reduces oxidative stress and inhibits activation of c-Jun N-terminal kinase/activator protein1 signaling in an experimental mouse model of abdominal aortic aneurysm〔J〕.Mol Med Rep,2014;9(2):435-42.
13Martinet W,De Loof H,De Meyer GR.mTOR inhibition:A promising strategy for stabilization of atherosclerotic plaques〔J〕.Atherosclerosis,2014;233(2):601-7.
14Singh R,Kaushik S,Wang Y,etal.Autophagy regulates lipid metabolism〔J〕.Nature,2009;458(7242):1131-5.
15Zhang YL,Cao YJ,Zhang X,etal.The autophagy-lysosome pathway:a novel mechanism involved in the processing of oxidized LDL in human vascular endothelial cells〔J〕.Biochem Biophys Res Commun,2010;394(2):377-82.
16Tarantino G,Capone D.Inhibition of the mTOR pathway:a possible protective role in coronary artery disease〔J〕.Ann Med,2013;45(4):348-56.
17Beutner F,Brendel D,Teupser D,etal.Effect of everolimus on pre-existing atherosclerosis in LDL-receptor deficient mice〔J〕.Atherosclerosis,2012;222(2):337-43.
18Wang X,Li L,Niu X,etal.mTOR Enhances Foam Cell Formation by Suppressing the Autophagy Pathway〔J〕.DNA Cell Biol,2014;33(4):198-204.
19Komatsu M,Kageyama S,Ichimura Y.p62/SQSTM1/A170:physiology and pathology〔J〕.Pharmacol Res,2012;66(6):457-62.
20Itakura E,Mizushima N.p62 Targeting to the autophagosome formation site requires self-oligomerization but not LC3 binding〔J〕.J Cell Biol,2011;192(1):17-27.
21Mathew R,Karp CM,Beaudoin B,etal.Autophagy suppresses tumorigenesis through elimination of p62〔J〕.Cell,2009;137(6):1062-75.
22Wu G,Huang J,Wei G,etal.LAMP-2 gene expression in peripheral leukocytes is increased in patients with coronary artery disease〔J〕.Clin Cardiol,2011;34(4):239-43.
23Wu G,Liu L,Huang J,etal.Alterations of autophagic-lysosomal system in the peripheral leukocytes of patients with myocardial infarction〔J〕.Clin Chim Acta,2011;412(17-18):1567-71.
〔2015-10-15修回〕
(编辑徐杰)
The effects of quercetin on the protein expression of autophagy in atherosclerotic mice
LIU Liang, GAO Chao, YAO Ping,etal.
College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, Hubei,China
【Abstract】ObjectiveTo investigate protective role of quercetin against atherosclerosis via autophagy regulation in high-fat diets mice.MethodsApoE-/-mice were given high-fat diets and(or) three different doses of quercetin for 24 weeks. All the animals were sacrificed at the end of feeding, and the aortas were removed for red oil O staining in order to analyze the atherosclerotic lesions. The protein expressions of mTOR, p62 and LAMP-2 in aortic tissues were measured with Western blot.ResultsThe atherosclerotic lesions were alleviated and lipid infiltration was decreased in aortic(P<0.05) and quercetin-treated group (100 mg·kg-1·bw-1) as compared to high-fat diets group. The expressions of mTOR, p62 and LAMP-2 were significantly (P<0.05) reduced at translational level in quercetin-treated groups (50 and 100 mg·kg-1·bw-1). ConclusionsAutophagy dysfunction is the potential mechanism of atherosclerosis, and quercetin has the significant protective effects by autophagy regulation and alleviating atherosclerotic lesions.
【Key words】Quercetin; Atherosclerosis; Autophagy; Lysosome
基金项目:国家自然科学基金项目(31201351,81172658)
〔中图分类号〕TS201.4
〔文献标识码〕A
〔文章编号〕1005-9202(2016)03-0539-04;doi:10.3969/j.issn.1005-9202.2016.03.010

