慢病毒转染大鼠破骨样细胞研究
傅继凡 陈 健
(厦门大学医学院,福建 厦门 361000)
慢病毒转染大鼠破骨样细胞研究
傅继凡陈健1
(厦门大学医学院,福建厦门361000)
〔摘要〕目的探讨慢病毒转染大鼠破骨样细胞的可行性。方法诱导大鼠骨髓间充质干细胞(BMSCs)培养成破骨样细胞(OLC)后,将其用绿色荧光蛋白(GFP)标记的对照慢病毒进行转染,荧光显微镜下观察不同感染复数(MOI)时慢病毒转染OLC的荧光率,并用TRAP染色鉴定OLC。选择最适宜的MOI并加入不同干预进行对照,分为OLC对照组、NFAT2抑制剂(VIVIT)组、NFAT2iRNA慢病毒组、对照病毒组,用RT-PCR进行基因验证。结果对照病毒转染后,OLC随着MOI值的升高,荧光转染率增加;MOI=15时荧光数最多(41.00±9.19)个/视野。不同干预后,NFAT2抑制剂组和NFAT2iRNA慢病毒组的NFAT2的基因表达明显低于OLC对照组和对照病毒组(P<0.05)。结论慢病毒可转染大鼠破骨样细胞,并在一定范围内随MOI升高转染率增高。
〔关键词〕慢病毒;破骨样细胞;活化T细胞核因子家族
1厦门大学附属中山医院康复医学科
第一作者:傅继凡(1990-),女,在读硕士,主要从事骨质疏松研究。
骨代谢的平衡由骨形成和骨吸收维持,成骨细胞(OB)和破骨细胞(OC)起着重要作用。其中,OC是一种具有独特骨吸收功能的多核巨细胞,来源于造血细胞系,属于终末细胞,不能增殖和传代〔1〕。而破骨样细胞(OLC)是指具有OC性质,通过原代培养或实验诱导生成的,用于实验研究的细胞。到目前为止,还没有成熟的OC株。自从Testa等〔2〕首次在体外培养骨髓造血细胞时发现能够形成OC后,骨髓诱导培养法分化OLC的技术形成并逐渐开展应用。获得OC的方法多种多样,包括诱导培养、直接培养等技术都逐渐趋于稳定成熟,有助于着手从基因水平深入研究骨吸收的机制,从而进一步开发代谢性骨病的治疗药物。本文拟证实慢病毒转染OLC的可行性,为进一步利用OLC进行基因学研究奠定重要基础。
1材料与方法
1.1实验动物4周龄雌性SD大鼠,购自吴氏实验动物中心。
1.2主要试剂、材料和仪器低糖DMEM培养基(美国Hyclone公司),中美胎牛血清(Bioind),红细胞裂解液,双抗、磷酸盐缓冲液(PBS,美国Gibco公司),鼠M-CSF、RANKL(美国Peprotech公司),抗酯酸性蛋白酶染色试剂盒(TRAP,美国Sigma公司),NFAT抑制剂(德国Calbiochem公司),Trizol(美国Ambion公司),逆转录试剂盒(TaKaRa),SYBR Green试剂(Invitrogen),NFAT2RNAi慢病毒、对照病毒由厦门欣基公司包装合成,引物由上海生工公司合成;10 cm培养皿、六孔板(美国Corning公司);CO2培养箱(美国Thermo公司),DM2500荧光显微镜(德国Leica公司),PCR扩增仪(美国Bio-Rad公司),荧光定量PCR仪7500型(美国ABI公司)。
1.3大鼠骨髓间充质干细胞(BMSCs)的分离与诱导培养取SD大鼠麻醉后处死,无菌条件下取双侧股骨和胫骨,剔除多余软组织,用5 ml注射器吸取适量低糖DMEM冲洗骨髓腔,直至骨髓腔变白,取冲洗液充分吹打制成细胞悬液后离心,800 r/min,3 min。弃上清加红细胞裂解液,混匀静置2 min,800 r/min离心3 min,弃上清去除红细胞,得到白细胞沉淀。重悬于含25.0 ng/ml M-CSF +50.0 ng/ml RANKL的低糖DMEM完全培养液(含10%FBS、1%青霉素与链霉素),接种于10 cm培养皿,37℃、5%CO2、饱和湿度培养箱中培养24 h。取未贴壁细胞,调整细胞密度为2.5×105重悬于含25.0 ng/ml M-CSF +50.0 ng/ml RANKL(大鼠)的低糖DMEM完全培养液,接种于六孔培养板,继续培养,首次半定量换液,以后每隔3 d换液。
1.4慢病毒转染OLC并分组以hela细胞(2.5×104/孔)对比,待获得的OLC生长融合达约60%时,对照病毒(无NFAT2沉默)转染按感染复数(MOI)15、5、1各分为三组,18 h后首次换液,此后每2~3 d换液1次并于第5天观察荧光表达情况,荧光显微镜(×200)下随机选取5个视野拍摄OLC和hela细胞,并用Image-Pro Plus专业图像分析软件计数。
1.5TRAP染色及计数将OLC于转染后第5天弃培养基,PBS冲洗2遍,柠檬酸盐/丙酮固定液室温下固定30 s,用蒸馏水冲洗、晾干,按试剂盒说明书行TRAP染色,倒置相差显微镜(×200)下随机选取5个视野计数3个核以上破骨细胞,并在200倍光镜下,用Image-Pro Plus专业图像分析软件计数。
1.6NFAT2抑制剂干预OLC将获得的OLC融合率达到60%左右时,进行不同干预并分为OLC对照组、NFAT2抑制剂(VIVIT)组、NFAT2iRNA慢病毒组、对照病毒组。NFAT2iRNA慢病毒组和对照病毒组病毒剂量均以MOI=15为参数,VIVIT试剂以2 μmol/L每孔连续干预3 d,此后每2~3 d换液1次并于第5天进行RT-PCR检测。
1.7RT-PCR检测细胞总RNA用Trizol提取。取总RNA 2 μg,按反转录试剂盒(TaKaRa)步骤完成反转录。以GAPDH为内参照,取2 μl反转录产物分别以下述引物进行PCR扩增。引物序列及反应条件:①NFAT2:顺向GGAGGGAAGAAGATGGTGTTGT,反向CTGGTTATTCTCTGGTTGCGG;②GAPDH:顺向AGTGCCAGCCTCGTCTCATAG,反向CGTTGAACTTGCCGTGGGTAG;反应条件:95℃ 30 s后,95℃ 5 s,60℃ 34 s,反复循环40次,95℃ 15 s,60℃ 1 min,95℃ 15 s后结束反应。采用2-ΔCt的方法计算基因相对表达量,公式:目的基因表达量=2-ΔCt,ΔCt=Ct目的基因-Ct内参基因。
1.8统计学方法应用SPSS13.0软件选用单因素方差分析(One-way ANOVA)、LSD方法统计。
2结果
2.1细胞生长特性倒置显微镜下观察,大鼠BMSCs培养24 h后开始贴壁,呈梭形,诱导后细胞逐渐变大,集落融合成多核破骨细胞,第9天时细胞状态最佳,数量最多,随后细胞开始皱缩,出现大量空泡。MOI=15、5、1均未见明显的细胞毒性。见图1。
2.2转染及计数带有绿色荧光蛋白(GFP)标记的对照病毒转染OLC后第5天在倒置荧光显微镜下观察,可见转染上的OLC发出较强的绿色荧光,胞体大、形态不一、核数≥3、细胞外围有一明显皱褶缘。随着MOI值的升高,hela的转染数增加,各组之间比较均有显著差异(P<0.01)。OLC组在MOI=15时,转染数最多,与MOI=5、1比较有统计学差异(P<0.01)。MOI=15时,OLC褶皱缘明显、荧光强;MOI=5、1时,转染的OLC荧光较弱,皱褶缘少,其他细胞转染较多。见图2,表1。

图1 不同时间点OLC的形态(×200)

图2 荧光显微镜OLC及hela细胞(×200)
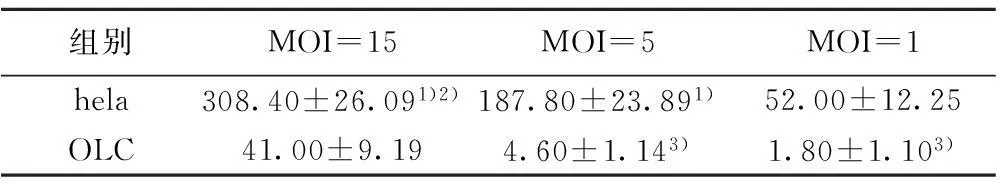
组别MOI=15MOI=5MOI=1hela308.40±26.091)2)187.80±23.891)52.00±12.25OLC41.00±9.194.60±1.143)1.80±1.103)
与MOI=1比较:1)P<0.01;与MOI=5比较:2)P<0.01;与MOI:15比较:3)P<0.01
2.3TRAP染色及数量诱导的OLC经TRAP染色后胞质深染呈紫红色,而胞核阴性,核数目≥3,多位于周边。经Image-Pro Plus计数分析后,MOI=15组(53.60±3.65)、MOI=5组(47.20±3.83)、MOI=1组(48.80±7.12)细胞数量均无显著差异(P>0.05)。见图3。
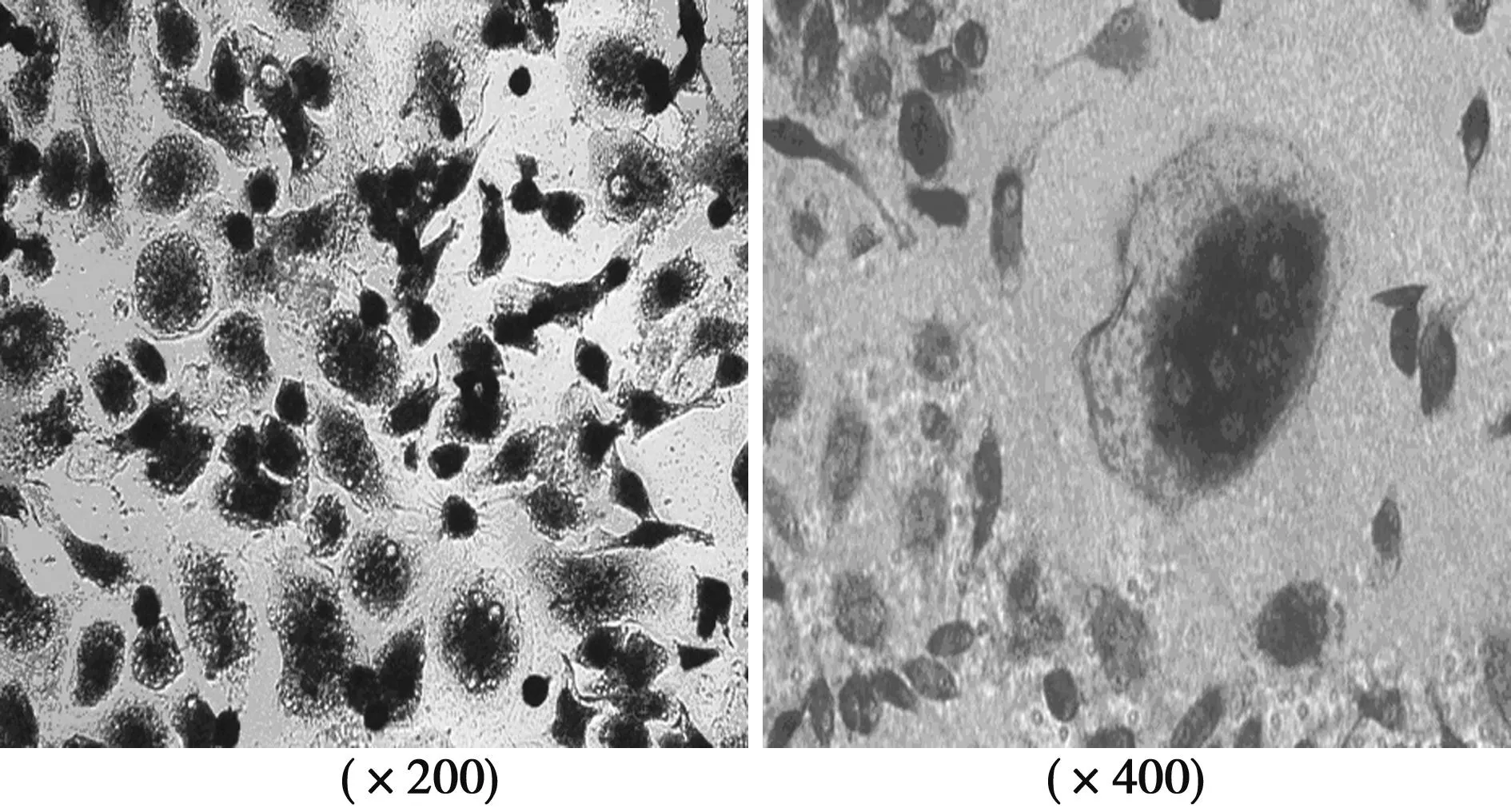
图3 诱导法OLC的TRAP鉴定
2.4NFAT2iRNA慢病毒转染OLC后NFAT2的表达不同病毒转染OLC后荧光显微镜下观察,与对照病毒组比较,NFAT2iRNA慢病毒组OLC数目少,荧光强度弱,未见皱褶缘。经过不同干预后,NFAT2抑制剂组(0.009 7±0.001 7)和NFAT2iRNA慢病毒组(0.009 6±0.002 0)的NFAT2基因表达明显低于OLC对照组(0.015 8±0.002 6)和对照病毒组(0.015 9±0.002 5)(P<0.05)。而OLC对照组和对照病毒组、NFAT2抑制剂组和NFAT2iRNA慢病毒组之间的NFAT2基因表达无显著差异(P>0.05)。见图4。
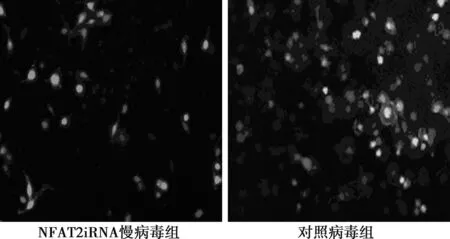
图4 慢病毒转染后第5天荧光显微镜下破骨样细胞(×200)
3讨论
骨代谢疾病如骨质疏松、Paget病、牙周炎等病理变化都存在骨吸收异常,其中OC起重要作用〔3〕。OC在体外很脆弱,培养难度高,纯度不高。本实验将大鼠BMSC在体外培养过程中加25.0 ng/ml M-CSF +50.0 ng/ml RANKL 进行诱导,获得一定量的成熟OLC,观察培养至第9天时数量最多,与其他培养方法比较,与体内OC生物学功能最接近〔4〕,最适合用于体外深入研究。
慢病毒载体是以人类免疫缺陷I型病毒(HIV-1)为基础发展起来的基因治疗载体,可以将外源基因有效地整合到宿主染色体上,从而达到持久稳定的表达。在感染能力方面不同于腺病毒和逆转录病毒,可有效地感染一些较难转染的细胞,如原代细胞、干细胞、不分化细胞等,适用于OC的体外研究〔5〕。GFP是一种新型报告基因,与目的基因构成融合基因后,通过载体(如质粒、慢病毒、腺病毒)转染,细胞可表达GFP蛋白,产生绿色荧光。本实验发现慢病毒转染效果与MOI值有密切关系,随MOI值的增加而升高,TRAP染色进一步验证MOI=15、5、1对细胞均无较明显毒性作用。
Ca2+/NFATc1信号通路是OC内重要的信号系统,参与调节OC的分化和成熟〔6〕。活化T细胞核因子家族中的NFATc1已被证实是其中重要的转录调节因子,参与许多OC特异性基因的表达调控,对OC分化和骨吸收功能至关重要〔7〕。有研究表明,NFATc1基因敲除的小鼠表现为骨硬化症〔8〕;其基因缺陷的胚胎干细胞不能分化成OC,但表达外源性NFATc1的前体细胞在没有RANKL的情况下也能向OC分化〔9〕。因此,可选择最适宜的MOI值用NFAT2iRNA慢病毒对OC进行基因验证。NFAT2iRNA慢病毒进入OC转染成功后使NFAT2基因沉默,表达下降,而对照病毒没有使NFAT2沉默的作用,同时加入VIVIT作为对照,VIVIT组和NFAT2iRNA慢病毒组的NFAT2基因表达明显低于OLC对照和对照病毒组,说明转染成功。此外,荧光显微镜也进一步证明NFAT2对OC的分化和成熟的重要性。
体外成功转染OC的主要措施:保证转染前细胞活性处于最佳状态;病毒转染前更换新培养基效果最好;加病毒后一般需在8~12 h更换培养基。经过反复大量实验,发现对于OC 18个小时为最佳换液时间;采用1~2个月大鼠,所诱导的OC最多;动物从处死到分离细胞速度要快,OC不易受损;严格无菌操作,诱导因子足量;采用差速贴壁法纯化OC,因所分离成纤维细胞等贴壁速度快,在培养24 h后收集未贴壁细胞接种至另一培养板中可提高纯度;纯化后OC为更好贴壁,2~3 d内需要静置培养,不宜挪动。
综上所述,此次OC转染成功为今后骨代谢疾病的基因治疗开拓了广阔的道路,利用携带目的基因慢病毒载体转染OLC,研究骨吸收的具体分子机制及有关OC内分化的信号通路是今后进一步实验的方向。
4参考文献
1Duong LT,Rodan GA.Regulation of osteoclast formation and function〔J〕.Rev Endocr Metab Disorders,2001;2(1):95-104.
2Testa NG,Allen TD,Lajtha LG,etal.Generation of osteaclasts in vitro〔J〕.J Cell Sci,1981;47(1):127-37.
3Rodan GA,Martin TJ.Therapeutic approaches to bone diseases〔J〕.Science,2000;289(5484):1508-14.
4付应霄,顾建红,王世涛,等.2种方法诱导形成的破骨细胞特性比较〔J〕.中国兽医学报,2013;33(1):94-7.
5Kubo S,Kataoka M,Tateno C,etal.In vivo stable transduction of humanized liver tissue in chimeric mice via high-capacity adenovirus-lentivirus hybrid vector 〔J〕.Hum Gene Ther,2010;21(1):40-50.
6Hwang SY,Putney J.Calcium signaling in osteoclasts 〔J〕.Biochim Biophys Acta,2011;1813(5):979-83.
7Negishi KT,Takayanagi H.Ca2+-NF ATc1 signaling is an essential axis of osteoclast differentiation 〔J〕.Immunol Rev,2009;231(1):241-56.
8Winslow MM,Pan MG,Starbuck M,etal.Calcineurin/NFAT signaling in osteoblasts regulates bone mass 〔J〕.Dev Cell,2006;10( 6):771-82.
9Takayanagi H,Kim S,Koga T,etal.Induction and activation of the transcription factor NFATc1(NFAT2)integrate RANKL signaling in terminal differentiation of osteoclasts〔J〕.Dev Cell,2002;3(6):889-901.
〔2015-05-11修回〕
(编辑袁左鸣)
Research of lentivirus transfect osteoclast-like cells
FU Ji-Fan,CHEN Jian.
College of Medicine,Xiamen University,Xiamen 361000,Fujian,China
【Abstract】ObjectiveTo explore the feasibility of lentivirus transfect osteoclast-like cells.MethodsAfter the bone mesenchymal stem cells(BMSC)of rat were induced osteoclast-like cells(OLC),the contrast lentivirus that marked Green fluorescent protein(GFP)was used to transfect the OLC.The fluorescent ratio of different multiplicity of infection(MOI)was observed under fluorescent microscope,and then Tartrate resistant acid phosphatase(TRAP)staining was used to identify the osteoclast-like cells.The most appropriate MOI value was selected and then divided into OLC,NFAT inhibitor(VIVIT),NFAT2iRNA lentivirus,control lentivirus groups,respectively.ResultsThe number of fluorescent cells was increased with elevating of MOI value after contrast lentivirus transfect osteoclast-like cells.The maximum fluorescent number was(41.00±9.19)/view when MOI=15.After different intervention,the mRNA expression of NFAT2 in NFAT inhibitor group and NFAT2iRNA lentivirus group were more decreased than those of OLC and control lentivirus groups(P<0.05).ConclusionsLentivirus could transfect osteoclast-like cells of rat.Furthermore,fluorescent transfect rate is increased with the rise of MOI value in a certain range.
【Key words】Lentivirus;Osteoclast-like cells;Nuclear factor of activated T cells
通讯作者:陈健(1963-),男,博士,主任医师,硕士生导师,主要从事骨质疏松研究。
基金项目:国家自然科学基金资助项目(No.81272168);福建省医学创新课题资助项目(No.2012-CXB-32)
〔中图分类号〕R3
〔文献标识码〕A
〔文章编号〕1005-9202(2016)03-0516-04;doi:10.3969/j.issn.1005-9202.2016.03.002

