健脾化瘀方对缺氧微环境下结肠癌SW480细胞生物学行为的影响*
马宇霆,王 丹,王瑞平,邹 玺
1.南京中医药大学 第一临床医学院(南京 210023);2.南京中医药大学 基础医学院(南京 210023);3.江苏省中医院 肿瘤内科(南京 210029)
结肠癌是最常见的消化道肿瘤之一,其发病率和死亡率均较高。近年来,结肠癌的发病率呈明显上升趋势[1]。邹玺等[2]认为结肠癌的病机以脾气虚弱、瘀毒内结为主,治法以健脾化湿、活血化瘀为主,并自拟以健脾化瘀法为主的中药煎剂辨证治疗各证型结肠癌。前期研究[3]发现,健脾化瘀方对人肝癌HepG2细胞、结肠癌LoVo细胞、人胃癌SGC-7901细胞的增殖及侵袭转移能力有明显抑制作用。越来越多的证据表明缺氧普遍存在于人类肿瘤中,随着实体瘤的发生发展,肿瘤内部不能得到足够的血液供应,导致局部处于缺血缺氧状态,使肿瘤组织内局部氧分压改变[4-5]。目前,恶性肿瘤病死率仍较高,常见的手术、放化疗及靶向治疗等方法均未能取得突破性进展,其原因主要是肿瘤细胞具有无限增殖、侵袭和转移的能力。本实验采用CoCl2刺激结肠癌SW480细胞,模拟肿瘤体内缺氧微环境,观察健脾化瘀方对缺氧微环境下SW480细胞增殖及侵袭转移能力的影响。
1 材料与方法
1.1 药物与试剂
健脾化瘀方[6]:白术10g、地锦草15g、丹参15g、蚤休15g、莪术10g、半枝莲30g、茵陈15g,用1 100mL超纯水加热回流提取2次,合并药液进行浓缩处理,微波真空干燥,高温高压灭菌,配制成相当于生药浓度0.8g/mL的水提液,再用完全培养液稀释为0.2、0.4、0.8mg/mL,22μm微孔滤膜过滤。4℃冰箱保存备用。
RPMI-1640培养基购自南京凯基生物技术公司,氯化钴六水合物、胰蛋白酶粉、PBS粉购自美国Sigma公司;胎牛血清购自杭州四季青生物公司,MTT粉剂购自Biosharp公司,二甲基亚砜(DMSO)分析纯购自成都科隆化学品有限公司,FN胶和Matrigel胶购自美国密理博(Millipore)公司。
结肠癌SW480细胞购自南京凯基生物公司,用含10%胎牛血清及1%双抗的1640培养液常规培养,取对数生长期的细胞用于后续实验[6]。
1.2 方法
1.2.1 健脾化瘀方对缺氧条件下SW480细胞增殖能力的影响 采用MTT法测定,重复实验3次。实验分为空白组、CoCl2组、健脾化瘀方不同浓度(0.2、0.4、0.8mg/mL)处理组,每组设3个复孔。取对数生长期细胞,以6×103个/mL接种于96孔板,100μL/孔,培养24h,待细胞贴壁后弃去原培养液,空白组每孔加入200μL完全培养液,其余4组均加入同等剂量的CoCl2,使其终浓度为200μmol/L,健脾化瘀方不同浓度组加入适量健脾化瘀方,使其终浓度为0.2、0.4、0.8mg/mL。常规培养24h后,用PBS溶液小心清洗每孔3遍,将96孔板倒置于吸水纸上,吸干PBS溶液后,于每孔加入100μL 1640完全培养液和20μL MTT溶液,继续放入培养箱培养4h,吸去所有上清液,每孔加入150μL DMSO,水平振荡器避光振荡10min,使用酶标仪于波长490nm处测定各孔吸光度(A)值,计算细胞抑制率[7-8]。抑制率(%)=[1-(给药组A490值-空白组A490值)/(CoCl2组A490值-空白组A490值)]×100%。
1.2.2 健脾化瘀方对缺氧条件下SW480细胞黏附能力的影响 分组同上。取对数期细胞,消化,离心(离心半径6cm,800r/min,离心5min),并重悬于完全培养液中,调整细胞浓度为1×105个/孔,接种于96孔板中。待细胞贴壁后,给药,具体给药方式同1.2.1;继续培养30、60、90、120min。酶标仪测定490nm波长处各孔A值,观察健脾化瘀方对缺氧微环境下的结肠癌SW480细胞黏附能力的影响[9]。
1.2.3 健脾化瘀方对缺氧条件下SW480细胞侵袭能力的影响 分组同上。Matrigel胶和超纯水按1∶9稀释,并予50μL均匀平铺于每个Transwell小室底部,4℃风干过夜,待用。取对数期细胞,将培养皿中原有培养液弃去,换成含1%小牛血清的1640培养液饥饿细胞12h后,给药,具体给药方式同1.2.1。常规培养24h后,收集空白组皿中上清液,作为条件培养液,同时消化各组细胞,离心(离心半径6cm,800r/min,离心5min)计数,维持细胞浓度为1×106个/mL,用含1%小牛血清的培养液重悬细胞,每个上室加入约250μL细胞悬液,再向下室中加入300μL完全培养液,以及300μL条件培养液,继续培养24h后取出小室,吸去小室上室中的培养液,倒置小室,通风处风干,再用75%乙醇固定细胞,待自然风干后,用台盼蓝溶液对于穿透小室的细胞染色,自然风干。取出小室基底膜,载玻片固定,倒置显微镜下随机选择5个400倍视野,记录由小室迁移至基底膜下的细胞数量,计算细胞侵袭抑制率,对各组侵袭细胞拍照计数,统计各组差异,侵袭抑制率=[(CoCl2组穿膜细胞数-健脾化瘀方不同浓度处理组穿膜细胞数)/CoCl2组穿膜细胞数]×100%[10]。
1.3 统计学方法
应用SPSS 16.0软件进行统计分析,计量资料采用均数±标准差(±s)表示,采用方差分析比较组间差异,进一步采用SNK法进行两两比较;定性资料采用百分比表示,采用χ2检验分析组间差异,检验水准α设定为0.05。
2 结果
2.1 MTT法检测健脾化瘀方对缺氧SW480细胞增殖能力的影响
与空白组比较,缺氧条件下的人结肠癌细胞株SW480增殖能力明显下降,24h时,健脾化瘀方各浓度组对缺氧下的人结肠癌细胞株SW480的增殖有不同程度的抑制作用,但与CoCl2组比较差异无统计学意义(P>0.05);48h时,健脾化瘀方浓度为0.4、0.8mg/mL时,与 CoCl2组比较,差异有统计学意义(P<0.05,P<0.01)(表1)。
表1 健脾化瘀方对缺氧SW480细胞增殖能力的影响(±s,%)
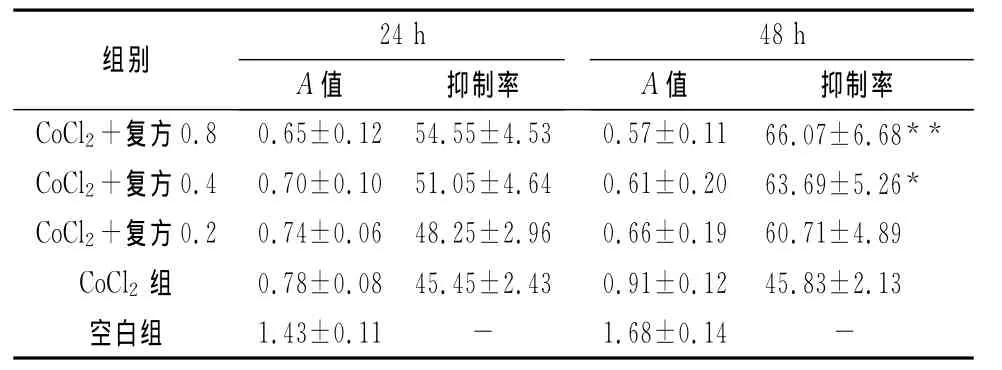
表1 健脾化瘀方对缺氧SW480细胞增殖能力的影响(±s,%)
注:与CoCl2组比较,*P<0.05,**P<0.01
组别24h A 抑制率CoCl2+复方0.8 0.65±0.12 54.55±4.53 0.57±0.11 66.07±6.68值 抑制率48h A 值**CoCl2+复方0.4 0.70±0.10 51.05±4.64 0.61±0.20 63.69±5.26*CoCl2+复方0.2 0.74±0.06 48.25±2.96 0.66±0.19 60.71±4.89 CoCl2 组 0.78±0.08 45.45±2.43 0.91±0.12 45.83±2.13空白组 1.43±0.11 - 1.68±0.14 -
2.2 MTT法检测健脾化瘀方对缺氧SW480细胞黏附能力的影响
CoCl2组较空白组黏附能力明显增强,且随时间增加而增强;各浓度健脾化瘀方作用于缺氧SW480细胞后,其黏附能力较CoCl2组减弱(P<0.05,P<0.01),且其黏附抑制能力随作用时间延长而逐渐增强(P<0.05,P<0.01)(表2)。
表2 健脾化瘀方对缺氧SW480细胞黏附能力的影响(±s,%)

表2 健脾化瘀方对缺氧SW480细胞黏附能力的影响(±s,%)
注:与CoCl2组比较,*P<0.05;与CoCl2+复方0.2组比较,#P<0.01;与CoCl2+复方0.4组比较,△P<0.05,△△P<0.01
抑制率CoCl2+复方0.8 0.79±0.10 52.16±3.26*#△△ 0.83±0.06 55.89±5.56*#△ 0.89±0.08 62.44±6.13*#△ 0.83±0.08 70.25±7.41*#△组别30min A 值 抑制率60min A 值 抑制率90min A 值 抑制率120min A 值CoCl2+复方0.4 1.23±0.12 24.68±3.83*# 1.34±0.07 29.28±3.22*# 1.44±0.07 37.87±4.32* 1.41±0.10 48.74±5.13*#CoCl2+复方0.2 1.51±0.06 7.93±2.14* 1.59±0.08 15.31±2.81* 1.73±0.09 24.81±3.75* 1.87±0.11 32.16±4.37*CoCl2 组 1.64±0.15 -20.16±1.36 1.88±0.21 -22.86±2.3 2.32±0.35 -25.29±1.41 2.73±0.40 -25.83±1.86空白组 1.36±0.11 - 1.53±0.15 - 1.85±0.22 - 2.17±0.17 -
2.3 Transwell小室法检测健脾化瘀方对缺氧SW480细胞侵袭能力的影响
CoCl2组较空白组侵袭细胞数明显增多(P<0.01),各浓度的健脾化瘀方均能抑制SW480细胞的体外侵袭能力,各浓度组穿过Matrigel胶的细胞数随健脾化瘀方浓度的增大而减少,侵袭抑制率增大,差异有统计学意义(P<0.01)(表3)。
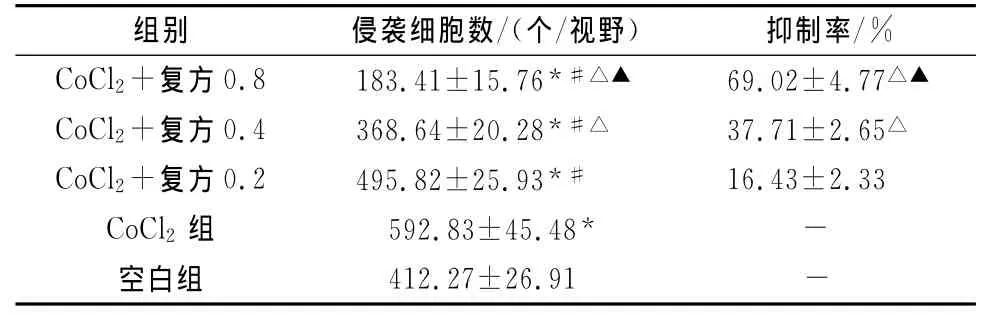
表3 健脾化瘀方对缺氧SW480细胞侵袭能力的影响
3 讨论
缺氧是肿瘤组织发展到一定阶段后的生存状态,是影响肿瘤生长与转移的重要因素[11]。已有研究[12-14]表明,缺氧不仅能够诱导肿瘤细胞抗凋亡能力增强,还能够调节肿瘤血管生成,促进代谢和转移侵袭。本研究采用CoCl2处理SW480细胞,模拟肿瘤体内缺氧环境,观察健脾化瘀方对SW480细胞的增殖及侵袭转移能力的影响。
健脾化瘀方在临床治疗结肠癌中已取得一定疗效[15]。本研究表明,在化学模拟缺氧微环境下,结肠癌细胞SW480的增殖能力受到明显抑制,健脾化瘀方作用于缺氧微环境下的SW480细胞时,随健脾化瘀方浓度及作用时间的增加,其增殖抑制率升高,当药物浓度达到0.8mg/mL时,其抑制率最高;缺氧微环境下肿瘤细胞的黏附能力增强,导致肿瘤细胞发生转移的可能性明显增加,不同浓度健脾化瘀方均具有抑制缺氧诱导的人结肠癌细胞SW480黏附能力的作用,高浓度健脾化瘀方的黏附抑制能力明显高于低浓度,且随时间的延长,其黏附抑制能力有逐渐增强的趋势;缺氧环境下的SW480细胞侵袭能力较空白组明显增强,健脾化瘀方作用于缺氧诱导的人结肠癌细胞SW480后,其侵袭能力明显减弱,且随着健脾化瘀方浓度的增加,其抑制作用逐渐增强。综上所述,健脾化瘀方在体外可明显抑制缺氧微环境下SW480细胞增殖及侵袭转移能力,呈一定的浓度依赖性,其具体分子机制尚待进一步研究。
[1]黄智芬,黎汉忠,张作军,等.健脾化瘀汤配合化疗治疗晚期大肠癌34例临床观察[J].中国中医药科技,2006,13(6):431-432.
[2]邹玺,王瑞平,胡玥.健脾化瘀药物对消化道肿瘤细胞的体外抑制作用[J].南京中医药大学学报,2010,26(1):33-35.
[3]陈鑫,张一鸣,石小花,等.缺氧微环境下微管相关蛋白4在人表皮细胞中的表达变化及对细胞迁移能力的影响[J].第三军医大学学报,2013,35(22):2426-2429.
[4]Zeisberg M, Neilson EG.Biomarkers for epithelialmesenchymal transitions [J].The Journal of Clinical Investigation,2009,119(6):1429.
[5]Santoyo RP,Likhatcheva M,García EA.Hypoxia-inducible factors molulate the stemness and malignancy of colon cancer cells by playing opposite roles in canonical Wnt signaling[J].PLoS One,2014,9(11):112580.
[6]季芳,狄文.肿瘤微环境影响卵巢癌生物学行为的研究进展[J].国际妇产科学杂志,2012,39(4):352-355.
[7]Murray PJ,Wynn TA.Protective and pathogenic functions of macrophage subsets[J].Nature Reviews Immunology,2011,11(11):723-737.
[8]凌博凡,王瑞平,邹玺,等.健脾化瘀方对肝癌bel-7402/5-FU细胞表面耐药蛋白影响的研究[J].世界中西医结合杂志,2013,8(2):120-123.
[9]Borthwick LA,McIlroy EI,Gorowiec MR,et al.Inflammation and epithelial to mesenchymal transition in lung transplant recipients:role in dysregulated epithelial wound repair[J].American Journal of Transplantation,2010,10(3):498-509.
[10]De Jong MC,Pulitano C,Ribero D,et al.Rates and patterns of recurrence following curative intent surgery for colorectal liver metastasis:an international multi-institutional analysis of 1669patients[J].Ann Surg,2009,250(3):440-448.
[11]严雪冰.结直肠癌中肿瘤微环境对上皮细胞间质转化的调控机制研究[J].医学综述,2014,20(10):1781-1783.
[12]Höckel M,Vaupel P.Tumor hypoxia:definitions and current clinical,biologic,and molecular aspects[J].J Natl Cancer Inst,2001,93(4):266-760.
[13]Wang LY,Liu YP,Chen LG,et al.Pyruvate kinase M2plays a dual role on regulation of the EGF/EGFR signaling via E-cadherin-dependent manner in gastric cancer cells[J].PLoS One,2013,8(6):67542.
[14]蒋树龙,花宝金.JAK2/STAT3/SOCS3信号通路与肿瘤转移[J].中国肿瘤生物治疗杂志,2014,21(6):698-702.
[15]王永兴,姜永光,罗勇,等.缺氧微环境下缺氧诱导因子-1α对前列腺癌细胞上皮间质转化的影响[J].首都医科大学学报,2014,35(3):278-283.

