不同剂量川芎嗪和葛根素配伍对脑缺血大鼠神经元凋亡的影响
陈 玲,韩江全,李文锦
1.遵义医学院珠海校区 实验中心(珠海 519000);2.澳门镜湖医院(澳门 515031);3.遵义医学院第五附属医院 神经内科(珠海 519100)
脑卒中是导致人类死亡及残障的主要原因[1-2],其中缺血性脑卒中大约占所有脑卒中的80%[3],但目前仍然缺乏有效的治疗手段[4]。缺血半暗带区凋亡神经元的多寡直接决定梗死面积,影响神经功能缺失的严重程度;Caspase-3、Cyt-c、NK-κβ与细胞凋亡过程密切相关。中医药作为我国医学的瑰宝,在治疗心脑血管疾病方面历史悠久,备受关注。目前,有不少关于川芎嗪及葛根素单药成分对缺血再灌注后神经元凋亡调控的实验研究[5-9],但尚无川芎嗪和葛根素配伍对缺血性脑卒中神经元凋亡及相关凋亡因子的研究报道,因而需更深入的研究来为临床治疗提供理论依据。本实验通过观察不同剂量的川芎嗪和葛根素组合对脑缺血细胞凋亡的影响,探讨川芎嗪和葛根素配伍对脑缺血损伤的保护机制,深入研究其防止脑缺血损伤的协同作用及量效关系,以期为研究中药配伍应用于临床提供理论及实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 健康成年雄性SD大鼠84只,体质量320~350g,由遵义医学院珠海校区实验动物中心提供。
1.1.2 药物 盐酸川芎嗪注射液(合肥平光制药有限公司,批号:H20050593);葛根素注射液(浙江康恩贝制药股份有限公司,批号:H20033408)。
1.1.3 试剂 苏木素(碧云天生物技术研究所,批号:C0105);伊红(碧云天生物技术研究所,批号:C0107);Tunnel凋亡染色试剂盒(碧云天生物技术研究所,批号:C1091);羊抗兔HRP标记二抗(天津厚普生物技术开发有限公司,批号:A0208);Caspase-3(Abcam 公司,批号:Ab32351);Cyt-c(Abcam 公司,批号:Ab133504);NK-κβ(Epitmics公司,批号:1559-1)。
1.1.4 仪器 手术器械(上海青浦泸西仪器厂,XW-80A);超净工作台(FLUKO 公司,F6-10);荧光倒置显微镜(Olympus公司,IX71);低温冷冻离心机(Sigma公司,3K15);手握式电动匀浆机(FLUKO公司,F6-10);漩涡振荡器(上海青浦泸西仪器厂,XW-80A);低速离心机(上海卢湘仪器厂,TDZ4B-WS);水浴锅(莱卡公司,HI1210);移液器(Thermo 公 司 );电 泳 仪(Bio-Rad 公 司,Mini-PROTEAN 3cell)。
1.2 实验方法
1.2.1 造模方法 左大脑中动脉阻塞模型造模方法:大鼠经10%水合氯醛腹腔注射麻醉(0.35mL/100g),仰卧位固定。作颈部正中切口,分离并暴露左侧颈总动脉及颈内、外动脉,颈总动脉近心端和颈内动脉搭一根尼龙线系活扣,颈外动脉近心端和远心端分别用一根尼龙线结扎,两根结扎尼龙线间距0.5cm。左侧颈总动脉动脉夹夹闭后,剪短颈外动脉上两根结扎的尼龙线,然后下翻颈外动脉近心端,与颈内动脉成一条直线。从颈外动脉剪一个小口,插入线栓,插入长度为(20.0±0.5)mm,感到有轻微阻力时停止。在颈内动脉处扎紧尼龙线、固定线栓,并扎紧颈总动脉近心端尼龙线,取下动脉夹,缝合皮肤。术后常规护理。待实验动物清醒后,行Bederson神经功能评分,神经功能评分标准:1)无神经功能损伤症状,动物正常活动、进食,评0分;2)将动物尾巴提起后,左前肢屈曲,评1分;3)将动物放置平板上,向左侧转圈,评2分;4)将动物放置平板上,用手轻推,向左侧倾倒,评3分;5)动物左侧偏瘫,不能自发行走,意识朦胧或丧失,评4分。评分≥2分表明模型成功,<2分予以去除。
1.2.2 分组及给药 造模成功后的大鼠分为7组,每组12只。给药剂量参考文献[8-9],各组具体给药方式及剂量如下:1)假手术组:腹腔注射3mL生理盐水2次,间隔6h;2)模型组:缺血后0、6h予3mL生理盐水腹腔注射;3)川芎嗪组:缺血后0、6h予川芎嗪50mg/kg腹腔注射;4)葛根素组:缺血后0、6h予葛根素50mg/kg腹腔注射;5)低剂量组:缺血后0、6h予川芎嗪20mg/kg+葛根素20mg/kg腹腔注射;6)中剂量组:缺血后0、6h予川芎嗪50mg/kg+葛根素50mg/kg腹腔注射;7)高剂量组:缺血后0、6h予川芎嗪80mg/kg+葛根素80mg/kg腹腔注射。
1.2.3 标本采集 实验动物缺血后24h进行神经功能评分,然后处死,生理盐水灌注后取脑。脑组织标本1/2用多聚甲醛固定,蜡块包埋,用于脑组织病理切片。另1/2脑组织置于冻存管中,液氮冻存,用于Western blot检测。
1.2.4 观察指标及方法 1)神经功能行为学评分:采用Bederson神经功能检查法;2)脑组织病理学改变:采用 HE染色检测;3)凋亡细胞检测:采用Tunnel法检测。4)Caspase-3、Cyt-C和 NF-κβ蛋白表达:采用Western blot法检测。
1.3 统计学方法
采用SPSS 13.0软件对数据进行处理,定量资料以均数±标准差(±s)描述,并采用方差分析和差异显著性检验,检验水准α设定为0.05。
2 结果
2.1 对神经功能的影响
与假手术组比,其他各组大鼠的Bederson神经功能缺失评分明显升高,差异有统计学意义(P<0.01)。与模型组相比,低、中、高剂量组大鼠的Bederson神经功能评分降低,且随剂量增大评分逐渐下降,但差异无统计学意义(P>0.05)(表1)。
表1 神经功能学评分及凋亡细胞计数结果(n=12,±s)

表1 神经功能学评分及凋亡细胞计数结果(n=12,±s)
注:与假手术组相比,*P<0.01;与低剂量组比较,#P<0.05;与中剂量组比较,&P<0.05
组别 神经功能缺失评分/分 凋亡细胞计数/(个/视野)假手术组0.17±0.41 0.91±0.65模型组 2.67±0.52* 17.98±1.01*川芎嗪组 2.33±0.52* 16.32±1.52*葛根素组 2.17±0.41* 15.98±2.30*低剂量组 2.17±0.41* 15.72±1.85*中剂量组 1.83±0.41* 13.22±1.35*#高剂量组 1.67±0.52* 11.12±1.12*&
2.2 对局灶脑缺血形态学的影响
假手术组大鼠脑组织形态正常,表现为染色均匀,组织结构清晰致密,神经元呈颗粒状、锥体状及不规则形状,细胞质淡红色,饱和蓝染,轮廓清楚。模型组大鼠可见灶状缺血区,结构紊乱,有水肿,可见神经元数量减少和变性坏死改变。给药各组脑组织也可见模型组改变,但组织结构紊乱和间质水肿较轻,坏死细胞减少,川芎嗪和葛根素配伍组组织坏死程度改善较单用川芎嗪和葛根素组明显,且随着用药剂量增加病变程度减轻(图1)。
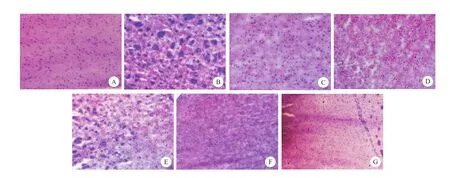
图1 不同剂量川芎嗪和葛根素配伍对大鼠缺血脑组织形态学影响(HE染色,×200)
2.3 对凋亡细胞计数的影响
Tunnel染色显示,假手术组仅见极少量棕色凋亡阳性神经元;模型组和低、中、高剂量配伍组均有较明显凋亡阳性神经元,细胞形态学方面表现为胞体缩小、核固缩、染色质凝聚,呈棕黄色或黄褐色颗粒状,呈现出凋亡特征。用药后,凋亡阳性细胞减少,黄褐色变淡,配伍用药较单药疗效明显,且凋亡细胞计数随配伍药物剂量增加而减少,差异有统计学意义(P<0.05)(表1和图2)。
2.4 对Caspase-3、Cyt-C、NF-κβ表达的影响
模型组 Caspase-3、Cyt-C、NF-κβ蛋白较假手术组增多,差异有统计学意义(P<0.01);配伍用药组较模型组均下降,且在高剂量组较中剂量组下降,中剂量组较低剂量组下降,差异有统计学意义(P<0.05)(表2和图3)。
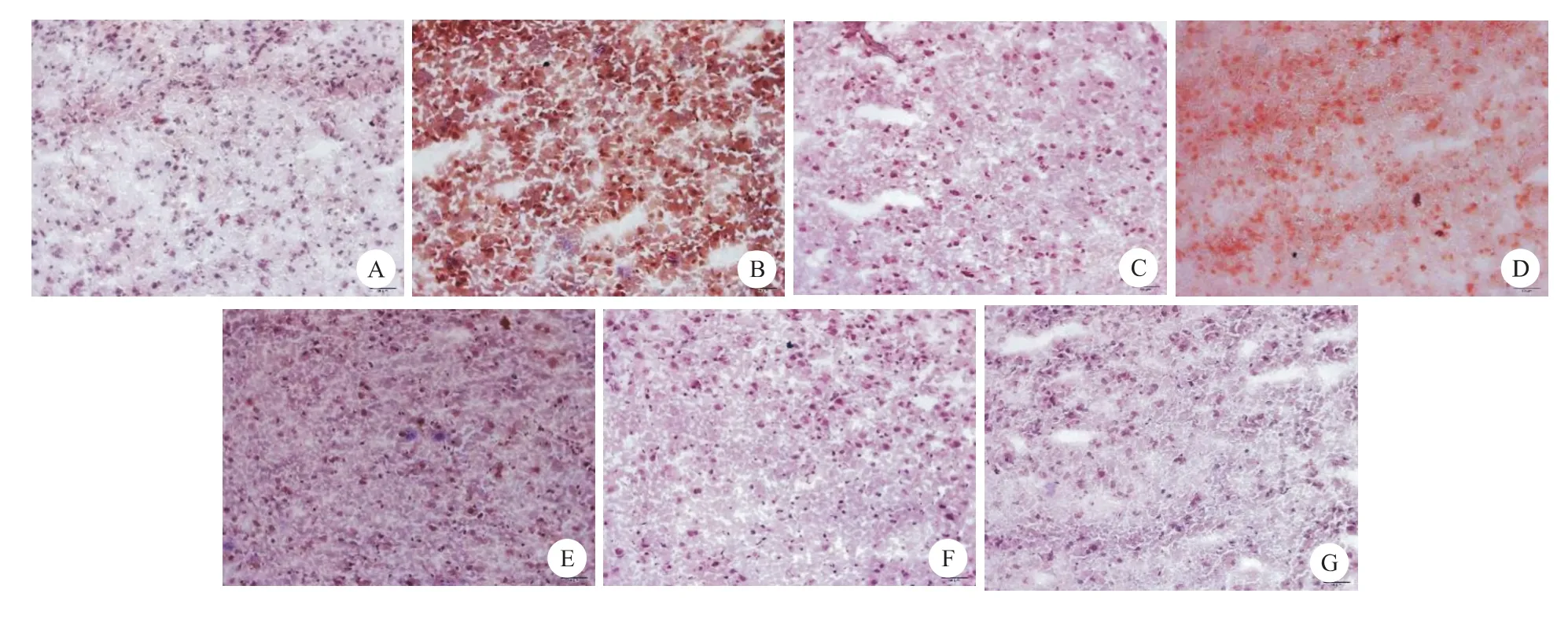
图2 不同剂量川芎嗪和葛根素配伍对大鼠缺血脑组织凋亡细胞检测(Tunnel染色,×400)
表2 各组大鼠Caspase-3、Cyt-C、NF-κβ蛋白表达水平的浓度(n=12,±s,μg/μL)
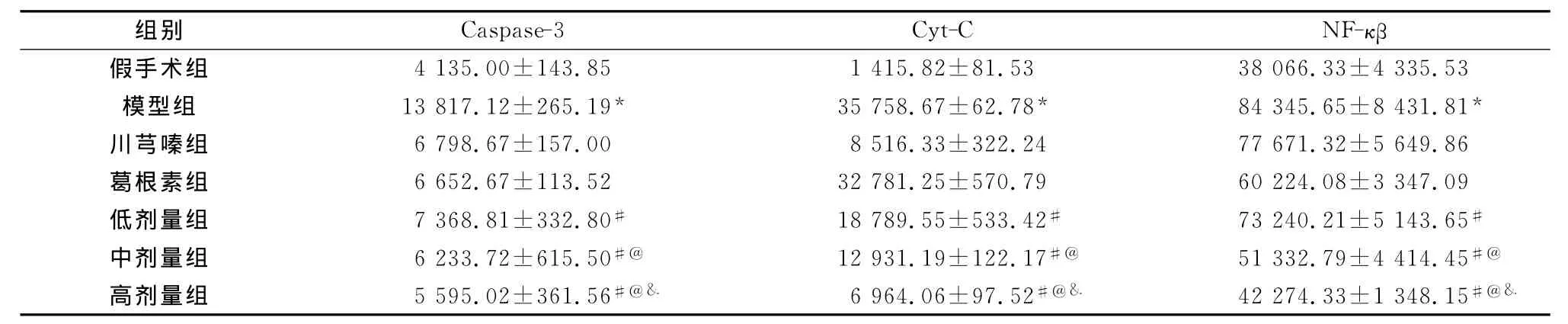
表2 各组大鼠Caspase-3、Cyt-C、NF-κβ蛋白表达水平的浓度(n=12,±s,μg/μL)
注:与假手术组相比,*P<0.01;与模型组比较,#P<0.05;与低剂量组比较,@P<0.05;与中剂量组比较,&P<0.05
组别 Caspase-3 Cyt-C NF-κβ假手术组 4 135.00±143.85 1 415.82±81.53 38 066.33±4 335.53模型组 13 817.12±265.19* 35 758.67±62.78* 84 345.65±8 431.81*川芎嗪组 6 798.67±157.00 8 516.33±322.24 77 671.32±5 649.86葛根素组 6 652.67±113.52 32 781.25±570.79 60 224.08±3 347.09低剂量组 7 368.81±332.80# 18 789.55±533.42# 73 240.21±5 143.65#中剂量组 6 233.72±615.50#@ 12 931.19±122.17#@ 51 332.79±4 414.45#@高剂量组 5 595.02±361.56#@& 6 964.06±97.52#@& 42 274.33±1 348.15#@&
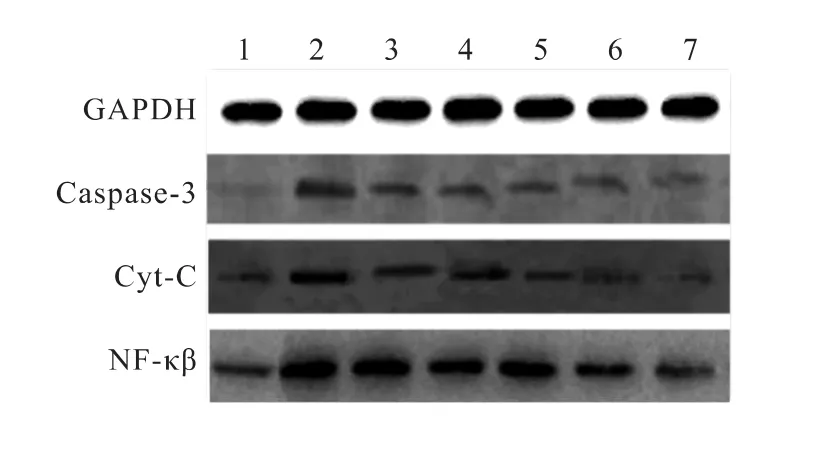
图3 不同剂量川芎嗪和葛根素配伍对大鼠缺血脑组织影响
3 讨论
脑缺血损伤机制极为复杂,炎症、氧化应激以及凋亡各种损伤因素均与缺血损伤及损伤扩大的过程密切相关。由于细胞凋亡主要发生在梗死区周围的缺血半暗带区,凋亡神经元的多寡直接决定着神经元坏死数量和梗死区域的面积,因此细胞凋亡在脑缺血损伤中起着重要作用,及时有效的抗凋亡措施有望成为缺血性脑卒中的有效治疗方法[10]。其中,Caspase家族蛋白是细胞凋亡启动和执行过程中起关键作用的一类蛋白水解酶,而Caspase-3是关键的执行分子[11]。细胞色素C从线粒体释放到胞浆是凋亡程序关键的一步,在凋亡机制中发挥着重大作用[12]。NF-κB作为细胞内最重要的一种核转录因子,主要通过调控下游基因如细胞因子、Bcl-2家族、TRAF和IAP等的表达参与细胞凋亡的调控。通过动物实验研究川芎嗪和葛根素配伍对上述凋亡相关因子的作用,能进一步揭示其脑保护作用的分子机制,可为川芎嗪和葛根素的临床应用提供理论和实验室依据。
祖国医学[13]认为,“血瘀阻滞脑络”是脑损伤的重要发病机制,其病机为气虚不能统血或气滞血瘀脉络不通。在治疗脑缺血损伤中,饮片配伍是临床应用的主要形式,但存在成分不清、机制不明以及疗效不稳定等不足;但单用中药有效组分配伍进行研究,又脱离了中医理论的指导。中药有效成分配伍的药效物质基本明确,作用机制相对清楚,存在着多种相互影响的反馈机制,既贯彻了中医的病症结合、方证对应理念,又克服了传统饮片配伍化学成分复杂及有毒成分不清等缺点,而且剂量准确、质量可控、针对性强,是当今中医药现代化中的中药配伍新模式[14]。川芎和葛根合用遵循了中药的配伍理论和方法,有通阳活血之效,并且针对了脑缺血损伤的病机。川芎嗪为中药川芎的有效成分之一,经现代药理学研究[15]证实,它可扩张血管、抑制血小板聚集、改善微循环、有效清除自由基,并可作为钙拮抗剂起作用。而葛根素为中药野葛根中提取的一种黄酮苷,具有扩张血管、改善微循环、抗氧化剂、修复内皮细胞损伤等作用[16]。临床上,川芎嗪与葛根素合用治疗缺血性脑血管病具有协同作用。新近研究[17-18]表明,川芎嗪合用葛根素,可相互提高血药浓度,延长其体内作用时间。本实验通过观察不同剂量的川芎嗪和葛根素组合对脑缺血细胞凋亡的影响,探讨川芎嗪和葛根素配伍对脑缺血损伤的保护机制,深入研究其防止脑缺血损伤的协同作用及量效关系,可为研究中药配伍应用于临床提供理论及实验依据。
本研究实验结果显示,模型组与其他5个用药组在神经功能缺失评分上比较,差异无统计学意义(P>0.05),但神经功能评分较模型组降低,而增加配伍药物剂量后,神经功能有所改善。在组织病理学改变及凋亡细胞表达上,模型组组织水肿、凋亡形态更明显,凋亡细胞表达计数明显增多;配伍用药治疗后,病理组织水肿及凋亡改变有改善,凋亡细胞计数减少,增加配伍用药剂量可使上述状况进一步改善。模型组 Caspase-3、Cyt-C和 NF-κβ蛋白较假手术组增多,差异有统计学意义(P<0.01),表明上述3个凋亡因子在细胞凋亡途径中起重要作用。配伍用药与模型组相比较,上述3个凋亡因子均下降,差异有统计学意义(P<0.05),说明配伍用药可有效改善缺血损伤细胞凋亡,其潜在机制可能为下调Caspase-3、Cyt-C和 NF-κβ蛋白表达;且高剂量组上述3个凋亡因子较中剂量组下降,中剂量组较低剂量组下降,差异有统计学意义(P<0.05),说明在一定范围内增加药物剂量可以下调凋亡因子,改善大鼠脑缺血损伤。
综上所述,川芎嗪和葛根素配伍可以协同治疗缺血性大鼠脑卒中,降低脑损伤程度,且在一定范围内与剂量成正相关。
[1]Lo EH.Degeneration and repair in central nervous system disease[J].Nat Med,2010,16(11):1205-1209.
[2]Moskowitz MA,Lo EH,Iadecola C.The science of stroke:Mechanisms in search of treatments[J].Neuron,2010,67(2):181-198.
[3]孙世光.中国急性缺血性脑卒中诊治指南2010[J].中华神经科杂志,2010,43(2):146-153.
[4]Fan W,Dai Y,Xu H,et al.Caspase-3modulates regenerative response after stroke[J].Stem Cells,2014,32(2):473-486.
[5]韩江全,于奎营,何敏,等.葛根素对大鼠脑缺血再灌注侧皮质区细胞凋亡及p-Akt(Ser473)表达的影响[J].中国中西医结合杂志,2012,32(8):1069-1072.
[6]韩江全,李均,李官成,等.葛根素对大鼠缺血侧皮质、纹状体区神经元凋亡及胶质细胞源性神经生长因子的影响[J].第三军医大学学报,2009,31(19):1912-1913.
[7]韩江全,李官成,周晓兰,等.葛根素对大鼠局灶性脑缺血再灌注后神经细胞凋亡及Bcl-2、Bax蛋白表达的影响[J].中西医结合心脑血管病杂志,2008,6(10):1179-1181.
[8]韩江全,李均,李官成,等.葛根素对脑缺血大鼠神经元凋亡及脑源性神经营养因子的影响[J].西部医学,2009,21(11):1844-1846.
[9]王玉,万海同,严伟民,等.川芎嗪与葛根素合用对海马神经元损伤后的影响[J].中国中药杂志,2008,33(4):424-427.
[10]Wu J,Li J,Hu H,et al.Rho-kinase inhibitor,fasudil,prevents neuronal apoptosis via the Akt activation and PTEN inactivation in the ischemic penumbra of rat brain[J].Cellular and Molecular Neurobiology,2012,32(7):1187-1197.
[11]Brentnall M,Rodriguez ML,De Guevara RL,et al.Caspase-9,caspase-3and caspase-7have distinct roles during intrinsic apoptosis[J].BMC Cell Biology,2013,14(1):32.
[12]Caroppi P,Sinibaldi F,Fiorucci L,et al.Apoptosis and human diseases:mitochondrion damage and lethal role of released cytochrome C as proapoptotic protein[J].Current Medicinal Chemistry,2009,16(31):4058-4065.
[13]王永炎.中医内科学[M].上海:上海科学技术出版社,1994:124-125.
[14]陈畅,李马兴,满国峰,等.组合药物-现代药物研发的新趋势[J].中国实验方剂杂志,2012,18(14):310-312.
[15]万海同,王玉,杨洁红,等.体外培养海马神经元糖氧剥夺损伤模型的建立及川芎嗪对其胞内钙离子的影响[J].中国中西医结合杂志,2007,27(3):234-236.
[16]徐晓虹,陈瑜,郑筱祥.葛根素对脑缺血诱导神经细胞凋亡的保护作用[J].中国药学杂志,2006,41(21):1628-1631.
[17]韩凤梅,潘莹,杜鹏,等.丹参、川芎与葛根配伍对葛根素的大鼠药动学影响[J].中国药学杂志,2009,44(19):1497-1499.
[18]王玉,万海同,严伟民,等.川芎嗪与葛根素合用对海马神经元损伤后的影响[J].中国中药杂志,2008,33(4):424-427.

