硝普钠对保存期间悬浮红细胞变形性的作用研究
李海军
广元市中心医院 检验科(广元 628000)
输血是临床抢救患者生命时一种不可替代的治疗手段,在现代医学中占据重要地位。目前,成分输血已成常态,主要有悬浮红细胞、血浆和血小板三大血液制品。其中,悬浮红细胞的应用非常广泛,其用量居首位[1]。众所周知,红细胞输注的主要作用是改善患者因贫血导致的氧供不足。虽然悬浮红细胞在保存过程中,其携氧量没有发生改变,但在红细胞输入人体后,能否顺利随着血液循环流动到目标组织或器官,取决于红细胞的变形性。若红细胞变形能力差,无法通过微小血管,不能顺利携带氧气到达目标器官或组织,反而可能引起栓塞,造成不良影响。已有较多研究[2-4]发现,红细胞在保存期间变形能力逐渐下降,其原因在于红细胞的一氧化氮(NO)丢失。硝普钠是一种常见的NO供体,能够释放NO分子[5]。因此,本研究探讨补充硝普钠对悬浮红细胞在保存期间红细胞变形性的影响。
1 资料与方法
1.1 实验分组
来源于中心血站的50袋悬浮红细胞,200mL/袋,于保存期的第1、3、5、7、14、21、28、35天各取20mL,分装成4管,5mL/管。根据数字随机表法,按照编号将标本随机分为4组,A组作为对照组,不做任何处理,另外3管分别与硝普钠混合培养成浓度为1μmol/L(B组)、5μmol/L(C组)和10μmol/L(D组)。
1.2 试剂与仪器
SNP试剂(碧云天生物技术研究所,海门)、PBS溶液(0.072 5M,pH 7.4,国产分析纯)、SA6000自动血液流变测试仪(赛科希德科技发展有限公司,北京)。
1.3 红细胞变形性的检测
红细胞变形性的检测采用赛科希德SA6000自动血液流变测试仪,该仪器采用锥-板式旋转结构原理,利用黏度测量法计算血液流变学相关指标,其测定的红细胞变形指数越大,表示红细胞变形性越差。
1.4 统计学方法
采用SPSS 17.0软件进行处理,定量资料以均数±标准差(±s)描述。同一时间点的不同组间比较采用随机区组设计的方差分析,并进一步采用SNK法进行两两比较;同一组不同时间点的比较采用重复测量方差分析。检验水准α设定为0.05。
2 结果
2.1 不同组别的相关指标随时间延长而变化的趋势图
每组标本的红细胞变形指数、聚集指数和刚性指数均有随着时间延长而缓慢增高的趋势(图1~4)。
2.2 同一时间点不同组间的比较
各时间点,与A组的红细胞变形指数相比,B组和D组差异无统计学意义(P>0.05),而C组有明显变化(P<0.05);与A组的聚集指数和刚性指数比较,B、C、D 3组之间差异无统计学意义(P>0.05)(表1~3)。
2.3 同一组不同时间点的比较
随着时间延长,4组标本的红细胞变形指数、聚集指数和刚性指数均发生改变。其中,A、B、C、D 4组红细胞变形指数分别在D14、D21、D28、D21发生明显变化,其后保持明显增高趋势(P<0.05)。A、B、C、D 4组红细胞的聚集指数均在D21后保持明显增高趋势(P<0.05),4组变化趋势一致。A、B、C、D 4组红细胞的刚性指数均在D28后保持明显增高趋势(P<0.05),4组变化趋势一致(表1~3)。
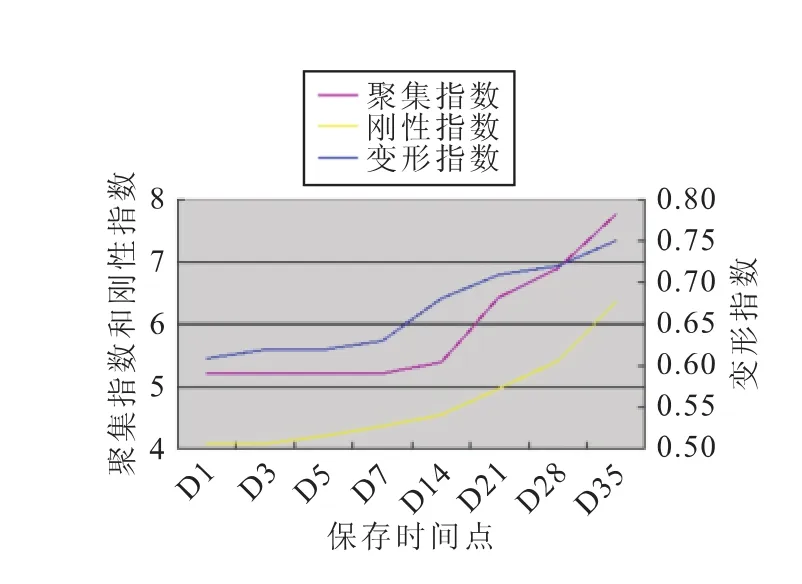
图1 A组相关指标的变化趋势
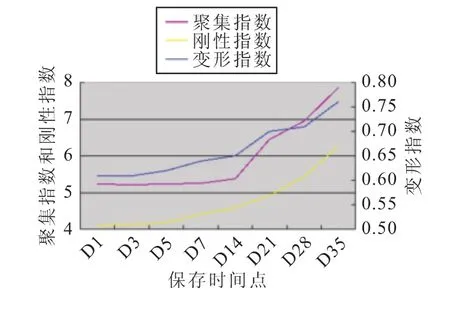
图2 B组相关指标的变化趋势
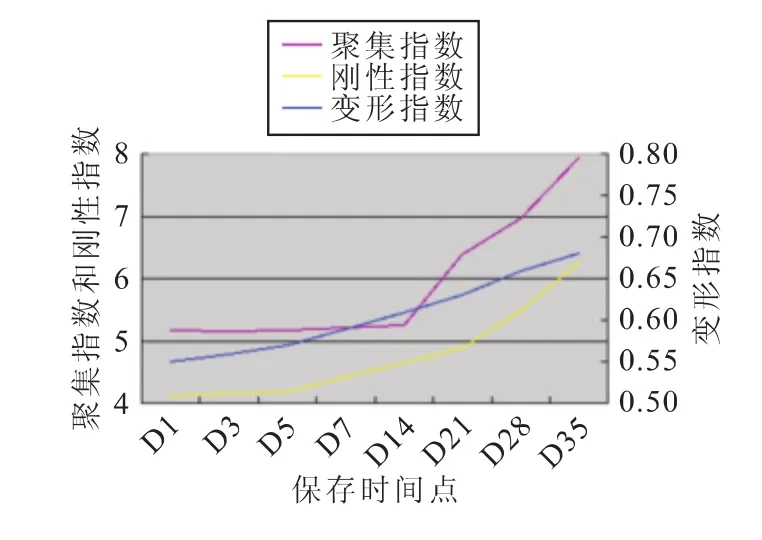
图3 C组相关指标的变化趋势
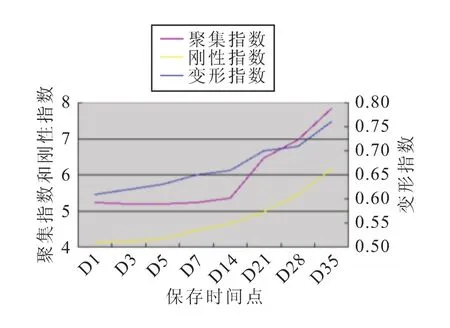
图4 D组相关指标的变化趋势
表1 不同保存时间点的悬浮红细胞的变形指数(±s,n=50)
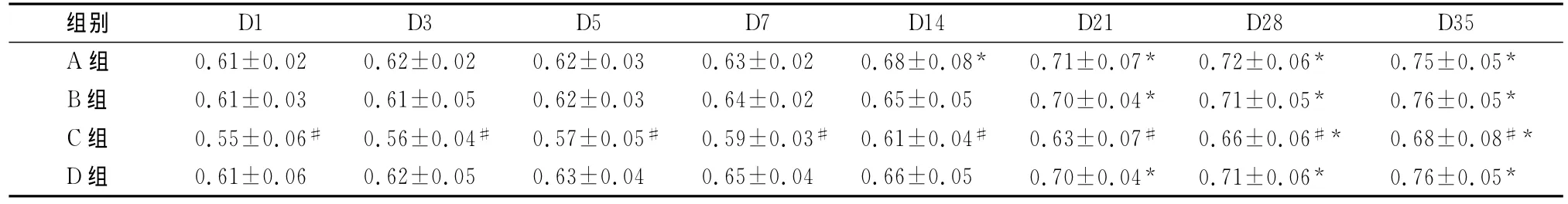
表1 不同保存时间点的悬浮红细胞的变形指数(±s,n=50)
注:与A组比较,#P<0.05;同一组不同时间点比较,*P<0.05
D1 D3 D5 D7 D14 D21 D28 D35 A组 0.61±0.02 0.62±0.02 0.62±0.03 0.63±0.02 0.68±0.08* 0.71±0.07* 0.72±0.06* 0.75±0.05组别*B组 0.61±0.03 0.61±0.05 0.62±0.03 0.64±0.02 0.65±0.05 0.70±0.04* 0.71±0.05* 0.76±0.05*C组 0.55±0.06# 0.56±0.04# 0.57±0.05# 0.59±0.03# 0.61±0.04# 0.63±0.07# 0.66±0.06#* 0.68±0.08#*D组 0.61±0.06 0.62±0.05 0.63±0.04 0.65±0.04 0.66±0.05 0.70±0.04* 0.71±0.06* 0.76±0.05*
表2 不同保存时间点的悬浮红细胞的聚集指数(±s,n=50)
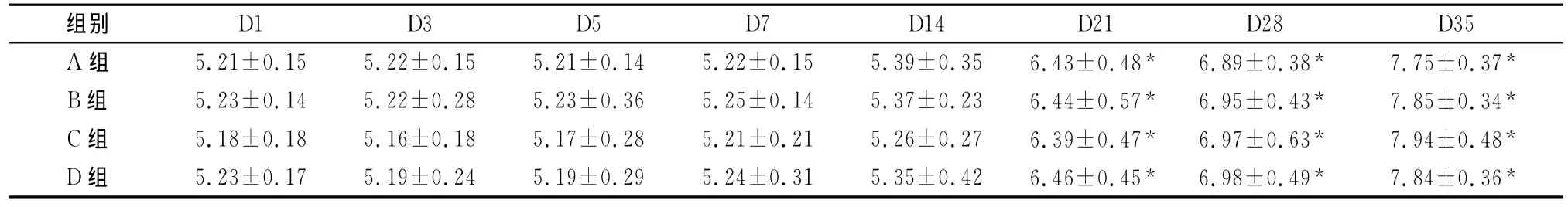
表2 不同保存时间点的悬浮红细胞的聚集指数(±s,n=50)
注:同一组不同时间点比较,*P<0.05
D1 D3 D5 D7 D14 D21 D28 D35 A组 5.21±0.15 5.22±0.15 5.21±0.14 5.22±0.15 5.39±0.35 6.43±0.48* 6.89±0.38* 7.75±0.37组别*B组 5.23±0.14 5.22±0.28 5.23±0.36 5.25±0.14 5.37±0.23 6.44±0.57* 6.95±0.43* 7.85±0.34*C组 5.18±0.18 5.16±0.18 5.17±0.28 5.21±0.21 5.26±0.27 6.39±0.47* 6.97±0.63* 7.94±0.48*D组 5.23±0.17 5.19±0.24 5.19±0.29 5.24±0.31 5.35±0.42 6.46±0.45* 6.98±0.49* 7.84±0.36*
表3 不同保存时间点的悬浮红细胞的刚性指数(±s,n=50)

表3 不同保存时间点的悬浮红细胞的刚性指数(±s,n=50)
注:同一组不同时间点比较,*P<0.05
D1 D3 D5 D7 D14 D21 D28 D35 A组 4.08±0.14 4.09±0.25 4.22±0.23 4.38±0.35 4.55±0.71 4.97±0.31 5.41±0.45* 6.34±0.27组别*B组 4.10±0.25 4.14±0.29 4.19±0.23 4.42±0.36 4.59±0.23 4.92±0.45 5.43±0.32* 6.27±0.55*C组 4.14±0.41 4.18±0.50 4.20±0.31 4.43±0.26 4.66±0.43 4.89±0.42 5.49±0.41* 6.26±0.43*D组 4.13±0.29 4.17±0.44 4.24±0.31 4.47±0.33 4.65±0.28 4.98±0.54 5.46±0.42* 6.16±0.38*
3 讨论
NO在心血管活动中起重要作用,主要归因于它对血管平滑肌的作用。人类红细胞能够表达诱导型一氧化氮合酶(NOS2或iNOS)和内皮型一氧化氮合酶(NOS3或eNOS),因此有能力合成 NO[6]。不管是细胞内或细胞外的NO,均能调节红细胞的生理功能[7-8]。红细胞变形性是红细胞的重要生理功能之一,研究[9-10]发现,NO 能够调节红 细胞的 变形能力。Mesquita等[11]的研究证实,乙酰胆碱和NO供体spermine-NONOate都能改善红细胞变形性,而且他们认为乙酰胆碱的作用可能是归因于其能诱导红细胞膜上乙酰胆碱M1型受体介导的NO合成,同时还发现NO供体对红细胞变形性的调节作用存在浓度依赖性。硝普钠是一种无机亚硝酸盐,临床常用作降压药,其作用机制是通过释放NO,增加血管平滑肌细胞内的cGMP水平,从而达到扩张血管,降低血压的作用[5]。本研究通过补充硝普钠发现,当其浓度为5μmol/L时,能够明显降低悬浮红细胞的变形指数,说明其能够改善悬浮红细胞的变形能力(P<0.05),但对红细胞的聚集指数和刚性指数无明显影响(P>0.05)。当硝普钠浓度为1μmol/L或10μmol/L时,其对红细胞变形性无影响,说明硝普钠对红细胞变形性的作用存在浓度依赖性,只有在合适的浓度才能发挥作用。
红细胞的变形能力对于维护血液循环有着重要意义,它能使红细胞通过微循环的小血管,降低大血管的高切应力血液黏滞。Grau等[12]通过小鼠实验发现,红细胞变形性的降低对微循环灌注造成了损伤。因此,重视悬浮红细胞在保存期间变形性的改变,对于红细胞的输血疗效具有重要意义。影响红细胞变形性的因素主要为细胞比容、细胞形状、细胞质的黏滞性和细胞膜的机械特性。其中,细胞膜的机械特性才是细胞膜黏弹性的主要决定因素。正常红细胞的变形性依赖细胞代谢:1)离子泵的转运,例如 Na+-K+-ATP 和 Ca2+-ATP;2)Na+-K+-ATP是红细胞比容的调节器,细胞质的黏滞性维持细胞内外渗透压的平衡;3)Ca2+-ATP可以使细胞内Ca2+维持低浓度水平,其本质是保护正常的红细胞变形性[13-14]。尽管本研究和其他文献[9-11]都 证 明,NO具有调节红细胞力学性状的作用,但NO对红细胞变形性的影响机制还未完全清楚。
综上所述,本研究结果表明,NO能够显著影响红细胞变形性,且NO对红细胞变形性的维持具有调控作用。在体内,红细胞具有两种来源的NO:一种是上皮细胞合成并弥散到血流的;一种是红细胞本身合成的。因此,除了NO的血流阻抗作用之外,NO对红细胞变形性的影响也对血流量的控制有直接作用。但是,NO影响红细胞变形性的目标结构或功能尚未明确,有待进一步研究。
[1]胡丽华.临床输血学检验[M].北京:人民卫生出版社,2012:158-159.
[2]张洪为,李代渝,赵华,等.一氧化氮对库血红细胞变形性的影响特征之探讨[J].重庆医学,2009,38(21):2695-2697.
[3]Yang XM,Liu J,Ji J,et al.Effects of dexmedetomidine on the defoemability of erythrocytes in vitro and in anesthesia[J].Exp Ther Med,2014,7(6):1631-1634.
[4]Carvalho FA,Maria AV,Braz N,et al.The relation between the erythrocyte nitric oxide and hemorheological parameters[J].Clin Hemorheol Microcirc,2006,35(1):341-347.
[5]李松,陈畅,史艳秋,等.一氧化氮供体最新研究进展及应用前景[J].中国生化药物杂志,2007,27(6):374-378.
[6]张洪为,李代渝,古天明.一氧化氮的生理学及对输血的影响[J].中国输血杂志,2008,21(5):384-386.
[7]Kleinbongard P,Keymel S,Kelm M.New functional aspects of the L-arginine-nitric oxide metabolism within the circulating blood[J].Thrombosis and Haemostasis,2007,98(5):970-974.
[8]Simmonds MJ,Detterich JA,Connes P.Nitric oxide,vasodilation and the red blood cell[J].Biorheology,2013,51(2-3):121-134.
[9]Silva-Herdade AS,Freitas T,Almeida JP,et al.Erythrocyte deformability and nitric oxide mobilization under pannexin-1 and PKC dependence[J].Clin Hemorheol Microcirc,2015,59(2):155-162.
[10]Canino B,Hopps E,Calandrino V,et al.Nitric oxide metabolites and erythrocyte Deformability in a group of subjects with obstructive sleep apnea syndrome[J].Clin Hemorheol Microcirc,2015,59(1):45-52.
[11]Mesquita R,Pires I,Saldanha C,et al.Effects of acetylcholine and spermineNONOate on erythrocyte hemorheologic and oxygen carrying properties[J].Clinical Hemorheology,2001,25(3-4):153-163.
[12]Grau M,Pauly S,Ali J,et al.RBC-NOS-dependent S-nitrosylation of cytoskeletal proteins improves RBC deformability[J].PLoS One,2013,8(2):56759.
[13]Suhr F,Brenig J,Muller R,et al.Moderate exercise promotes human RBC-NOS activity,NO production and deformability through Akt kinase pathway [J].Plos One,2012,7(9):45982.
[14]Adderley SP,Thuet KM,Sridharan M,et al.Identification of cytosolic phosphodiesterases in the erythrocyte:A possible role for PDE5[J].Med Sci Monit,2011,17(5):241-247.

