药物临床试验受试者损害赔偿方案调研
张 莉,康长清,舒 鹤,郭晋敏
(济南军区总医院药剂科,山东 济南 250031,jjzyyzl1210@163.com)
·药事伦理·
药物临床试验受试者损害赔偿方案调研
张 莉,康长清,舒 鹤*,郭晋敏
(济南军区总医院药剂科,山东 济南 250031,jjzyyzl1210@163.com)
目的 分析与探讨药物临床试验中受试者损害赔偿方案现状,推动临床试验为受试者提供损害赔偿的实施与规范化。方法 回顾性调查某院2008年1月~2014年12月药物临床试验对受试者提供赔偿情况,调查资料主要包括试验协议、知情同意书和保险。结果 试验协议中均声明由试验药物引起的受试者损害赔偿由申办方承担,但缺乏细则。部分知情同意书中缺失受试者损害赔偿的告知。70项试验项目中,17项提供保险,综合参保率为24.3%。国际多中心项目的参保率(100%)显著高于国内项目(9.1%)。对国内项目进行分析,其参保率逐年增加,但不同分期的参保率无差别。17项保险中,有13项为临床试验责任保险,其余为产品和一般责任保险;有5项提供了保险说明书,其余只备有保险证明或保单;有2个项目的保险单为外文,无中文版本。结论该院通过项目准入制度、加强伦理审批、强化试验质量管理来预防受试者损害发生,发生损害事件后应充分保障受试者的健康及权益,以及积极宣传临床试验保险来完善受试者损害赔偿机制,保障受试者的权益,降低临床试验风险。
受试者;损害赔偿;保险;药物临床试验
在药物临床试验中,受试者往往直接暴露在安全性及有效性尚未得到充分、有效验证的药物面前。不管如何控制试验过程,受试者都将不可避免地面临各种未知的风险。我国GCP规定:[1]“申办者应对参加临床试验的受试者提供保险,对于发生与试验相关的损害或死亡的受试者承担治疗的费用及相应的经济补偿。申办者应向研究者提供法律上与经济上的担保,但由医疗事故所致者除外。”
对于由试验所要求的药物、治疗、程序或者检验而导致疾病、不良反应或者伤害,试验医生和试验发起人将确定受试者的疾病、不良反应或者伤害是否由于试验的因素引起。对于确认是因试验引起的损害,申办者会对其进行相应的补偿。[2]补偿的方式可以选择为受试者办理临床试验保险,或者给受试者提供损害治疗,也可以对其直接进行经济补偿。不论何种赔偿机制,均应在试验协议中与研究机构进行约定,也应在知情同意书中对受试者进行说明,以保证充分知情,维护受试者的权益。
加强对受试者权益的保护,建立受试者损害补偿机制,是药物临床试验组织面临的重要问题。文章通过调查我院(济南军区总医院)2008年1月至2014年12月期间承接的药物临床试验项目资料,对受试者损害赔偿方式进行调研,分析受试者损害赔偿机制的现状,旨在推动药物临床试验受试者损害赔偿规范化,建立健全受试者损害赔偿机制,保障受试者的权益。
1 材料与方法
1.1 一般资料
检索2008年1月~2014年12月我院药物临床试验机构承接的新药及医疗器械临床试验。
1.2 调查方法
从药物临床试验机构办公室检索Ⅱ-Ⅳ期药物临床试验中对受试者提供赔偿情况,调查内容包括:新药分期、试验协议、知情同意书、赔偿声明和保险。
2 结果
2.1 在协议与知情同意书中赔偿方案现状
药物临床试验协议中基本均声明:与试验药物有关的不良事件的治疗费用及相应的经济补偿由申办方承担,但医疗事故除外。从2009开始,赔偿声明的覆盖率达100%(见表1)。除提供保险的项目明确说明赔偿方案(即保险承担)外,其余项目在协议中对该条并未细化出赔偿方案。
为保证受试者明晰其在临床研究中的权利义务,损害赔偿方案及原则,应该明确地在知情同意书中告知受试者。我院知情同意书中告知赔偿事宜的覆盖率呈现逐年增加的趋势,截至2014年,有81.8%的项目在知情同意书中明确告知赔偿事宜。
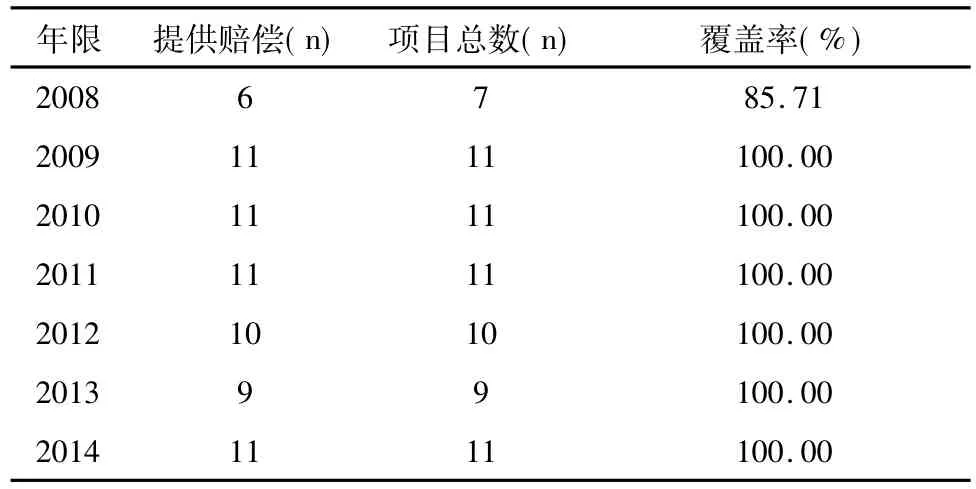
表1 临床试验协议中赔偿覆盖率
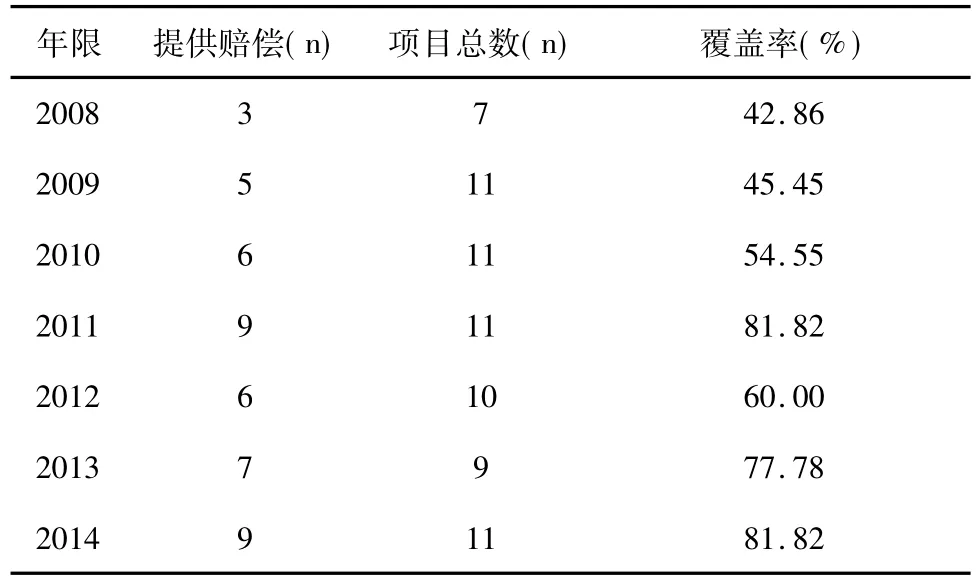
表2 知情同意书中赔偿覆盖率
2.2 提供保险的现状
2.2.1 国际多中心参保率高于国内项目。
2008年-2014年承接的70项药物临床试验中,17项提供保险,参保率为24.3%。17项参保项目中,8项为国际多中心临床试验,占47.1%。国际多中心的参保率为100%,显著高于国内项目(见图3)。

表3 国际/国内项目参保率
2.2.2 国内项目参保率逐年增加。
从2008-2014年,总项目参保率亦呈现逐年增加的趋势,除2011年有较大的波动,主要原因是2011年承接的国际多中心临床试验较多。尽管我院国内项目总参保率很低,仅为9%。但从2011年开始,国内提供保险的项目数也在逐年增加(见表4)。
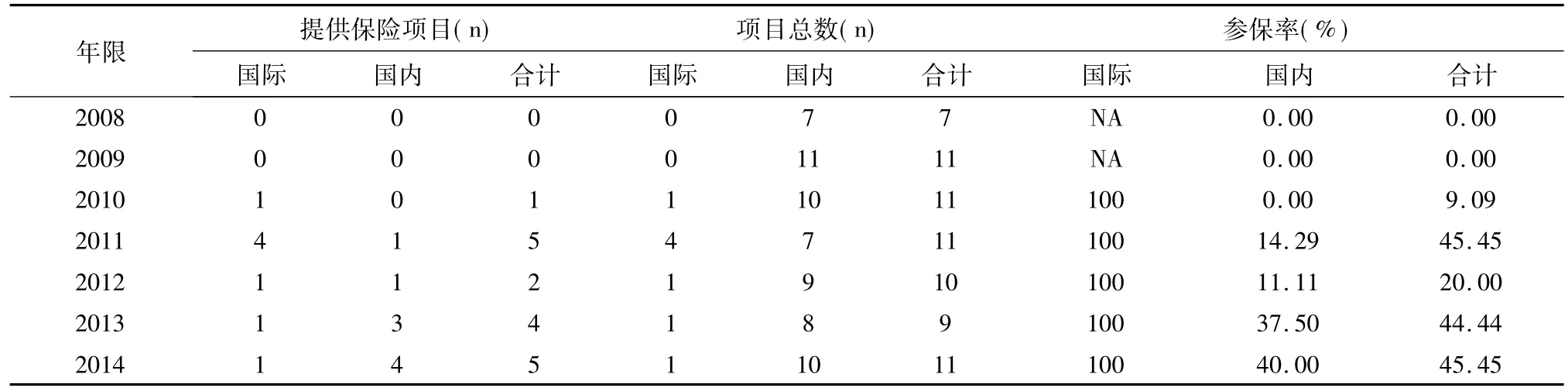
表4 临床试验保险率
2.2.3 不同分期临床试验参保比较。
通过分析可以看出,不同分期临床试验的总参保率存在差别,如表5所示,Ⅲ期的参保率最高,其主要原因是Ⅲ期国际多中心临床试验比重较大。而单独从国内多种临床试验的角度分析,各期试验的参保率并无较大差别。
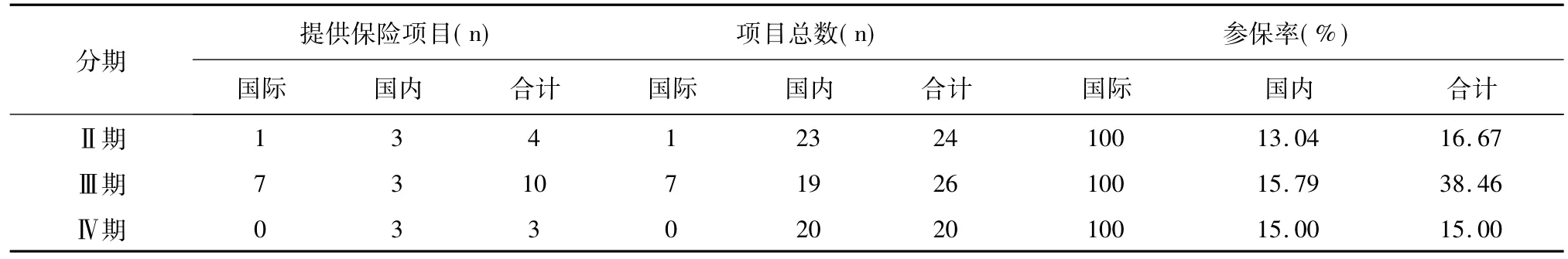
表5 不同分期临床试验的参保率
2.2.4 保险及险种。
17个项目的保险中,有82.35%为临床试验责任保险,其余为产品责任保险和一般责任保险。针对保险,应提供详细的保险说明,在17个参保项目资料中,只有5个项目提供了详细的保险条款,其余只备有保险证明或保单,17个保险中,多数语言为中文,但仍有2个项目的保险单为英文,无中文版本。被保险人均为申办方,只有1个项目将研究机构列入被保险人中。
3 讨论
3.1 我院受试者损害赔偿的现状
相比已上市的药品,临床试验药物存在更多未知、不可控的风险,即使试验前制定完善周密的方案和应急措施也不能完全避免不良事件的发生,尤其在发生严重不良事件后如何对受试者进行损害赔偿,对受试者的权益来说至关重要。[3]因此,试验前应明确具体的赔偿标准与办法,推行保险就是最有效的措施,[4]不但能使不良事件发生后受试者获得及时的经济赔付和医疗救治,也可以减轻申办方的经济负担,化解经济纠纷。本次调研发现,保险在临床试验中的综合覆盖率不足25%,其中国内申办者购买保险甚至不足10%。究其原因,主要是法律法规对药物临床试验保险相关条款的要求并不具有强制性,以及申办方对于药物临床试验风险意识认识不够使得在我国开展的临床试验保险覆盖率较低。未提供保险的试验项目,申办方在试验协议中均明确:与试验药物有关的不良事件的治疗费用及相应的经济补偿由申办方承担,但医疗事故除外。但该条款流于形式,无细则,赔付时容易发生纠纷。另外,知情同意书是保障受试者权益的主要措施,是患者了解临床试验内容,明确自身义务和权利最直接、有效的途径,[5]那么相应的损害补偿及赔偿措施也应明确地在知情同意书中告知受试者。我院部分知情同意书中该内容缺失,使受试者处于被动地位,无法掌握损害信息并根据切实情况获得合理赔偿。目前我院无1例受试者提出损害赔偿,可能也与其对损害赔偿不完全知情有一定的关系。
在我院提供的17份保险中,也存在以下问题:①险种:申办者提供的大多为“药物临床试验责任险”,其投保产品为临床试验,这是保险公司专门为临床试验开发的、为每个受试者购买试验发生意外的保险。但仍有少部分提供的是公众责任险或产品责任险,其保险内容并不太符合临床试验,且适用的受害人群并非特指在某项临床试验的受试者。[6]②被保险人:在中国平安、中国太平和永诚财产保险等制定的药物临床试验责任保险条款中,明确指出:本保险的被保险人还可以包括:参加药物临床试验的医生、护士、咨询机构、医院、药物临床试验机构、合同研究组织及伦理委员会。试验机构作为实施临床试验的责任方,应纳入到被保险人中,以避免发生受试者损害问题时,申办者、研究者及受试者相互争执、互相指责推卸责任的现象。在我院的17份保险中,只有1份将参研的药物临床试验机构并列为被保险人。临床试验过程中,由于法律保障体系的缺失,医疗机构的声誉、安全、稳定不能得到充分的保障。③承保公司及语言:国际多中心临床试验的保险通常为国外总部全球投保,申办方大多选择国内的保险公司为其承保。但有1份保险的保单范围为全球,部分保险证明或保险合同只有外文,无中文翻译。一旦索赔,就会出现与国外保险公司联系困难,我国法律法规不适用等一系列障碍,不仅导致索赔期限延长,对受试者权益的维护也会更加困难。[7]④保险说明书:即保险具体条款,应在试验机构备案,使研究者了解受试者损害赔偿的相关事宜。⑤赔偿认定机制:申请赔偿时,首先需要进行损害归责,通常由研究者判定不良事件与试验药物的关联性,确定为“相关”,即确认是因试验引起的损害,申办者会对其进行相应的理赔。[8]但药物临床试验责任保险的保险责任条款中,常缺乏对药物不良事件与药物不良反应的描述,在临床试验中出现药物不良事件与药物可能有关、无法判定或可能无关时是否赔偿,均没有定义。曾有受试者出现了严重不良事件,虽与试验药物无直接关系,但法院判决申办者应赔偿,法院推定保险合同包含了严重不良事件的赔偿。[9]有学者建议我国确立临床试验损害的无过错归责原则。[10]即在药物临床试验中如果受试者受到损害,只要不能明确排除该损害与药物试验的关系,就应当对受试者的损害后果给予赔偿,这样扩大了法律保护的损害范围,更有利于保护受试者的权益。
3.2 完善我院受试者损害赔偿工作的措施
①项目准入制度:机构办公室在承接药物临床试验时,加强对申办方为试验投保方面的审查,对提供临床试验保险的项目可适当加快审批速度,并优先接收。将投保证明(必须有中文版)、保险合同和保险说明书列为试验前必须的备案文件。机构与申办方签订协议时,要求将赔偿部分尽可能细化。
②强化伦理审批:伦理委员会加强对试验风险和受试者保护方面的审查,如强化试验风险的评估,将是否提供保险、保险险种、保额等作为评估指标之一。另外,对知情同意书中的损害赔偿部分进行审查,要求如实告知受试者试验的风险及相应的赔偿方案并取得受试者的知情同意。[11]
③强化试验质量管理,预防受试者损害事件的发生:试验前重视启动培训,要求所有参研人员熟悉各自职责并严格执行试验方案;配备专职的CRC来协助研究者完成试验;为保证充分知情同意,可由申办方录制统一的解说光盘资料,经伦理委员会审查后在执行知情同意时向受试者播放,再由研究者当面解答疑惑;试验实施期间定期进行质量控制,发现问题及时解决。
④发生损害事件后,充分保障受试者的健康及权益:发生AE/SAE,研究者应进行积极有效的救治,并客观判断试验药物与不良事件的关联性,由于该项直接影响到受试者的损害赔偿,若研究者无法判定,可以进行科室讨论,还可以进一步申请伦理委员会上会讨论。若判定为“有关”,研究者应主动要求申办方进行相应赔偿,并报机构备案。
⑤积极宣传临床试验保险:由于新药会有种种未知情况发生,药物临床试验全程充满了高风险,如发生较大规模的SAE时,申办方需承担数额较大的费用,或者职业试药人或医闹的敲诈等。使申办者了解临床试验的风险,了解推行保险可将申办方自身的风险最小化,赔付最小化,从而保证临床试验的顺利完成。机构办公室与各银行合作,设立资料栏,存放药物临床试验责任保险相关材料,供申办方监查员、合同研究组织CRO、研究协调员CRC等了解查阅。同时,研究者应积极协助申办者对将要进行试验的产品做有预计性的药物不良事件的阐述,同时和保险公司充分讨论,对和临床试验药物有关/无关的严重不良事件设定赔偿的细则,完善保险公司对临床试验专业的理解。
4 结论
在药物临床试验中,受试者权益必须放在首位,坚持以受试者健康为核心,以受试者知情同意为前提,以及时治疗和赔偿为保障,明确试验各方的法律责任和义务,合理分散试验风险。受试者损害赔偿是伦理原则的必然要求,然而,目前国内临床试验尚属起步发展阶段,在这方面较为薄弱。因此,迫切需要建立规范的受试者损害赔偿机制,完善临床试验风险保障体系和保险制度,[12]以最大限度地保障受试者的权益,最大程度地降低临床试验风险,促进我国临床试验质量管理规范的切实实行。
[1] 国家食品药品监督管理局.药物临床试验质量管理规范[Z].2003-09-01.
[2] 杨钊,李春潇,武志昂.关于加强临床试验中受试者权益保护的探讨[J].中国药师,2013,16 (4):610-613.
[3] 唐博謇.临床试验中受试者的保护:历史与现状[J].中华医学杂志,2003,21(3):1926-1928.
[4] 汶柯,王瑾,王睿.新药临床试验保险应成“必选项”[J].中国新药与临床杂志,2014,33 (1):19-21.
[5] 姜柏生,郑逸飞.人体生物医学研究知情同意书质量分析[J].医学与哲学,2013,34(9A):42-45.
[6] 高惠君.重视受试者安全保护,有效推进创新[C].上海:药品审评中心(CDE),2011中国药物创新论坛,2011.
[7] 王瑾,汶柯,曹江,等.从我院药物临床试验投保情况浅谈我国临床试验风险管理现状[J].中国新药与临床杂志,2013,32(12):946-949.
[8] 顾俊,李娜,张志勇.浅议药物临床试验机构的风险管理[J].中国新药与临床杂志,2011,30 (10):797-800.
[9] 老妪试新药休克告拜耳[N].北京晨报,2013-02-22(A19).
[10]沈玉红,张正付,李正奇.美国药物临床试验受试者的损害补偿及其启示[J].药学实践杂志,2013,31(4):271-276.
[11]赵帼英,江滨,史录文.我国药物临床试验伦理委员会运作模式及监管机制探讨[J].中国药事,2007,21(1):25-28.
[12]张明杭.论我国强制责任保险制度的建立[D].成都:西南财经大学,2009:3.
〔修回日期 2015-09-03〕
〔编 辑 吉鹏程〕
Study on Damage Compensation for Subjects in Drugs Clinical Trials
ZHANG Li,KANG Changqing,SHU He,GUO Jinmin
(Pharmacy Department,Jinan Military General Hospital,Jinan 250031,China,E-mail:jjzyyzl1210@163.com)
Objective:To investigate the current situation of damage compensation for subjects in drugs clinical trials.Methods:Retrospective analyzes was conducted on 70 drug clinical trail from January 2008 to December 2014 in our hospital,including protocols、informed consent and insurance.Results:It was written in most protocols that sponsor undertook damage compensation due to experimental drugs,however,lack of detailed rules.Damage compensation for subjects was missed in some informed consents.17 drugs clinical trials provided insurance,the rate of jointing insurance 24.3%.In international trail,the rate of jointing insurance(100%)was higher than that in domestic trail(9.1%).As to domestic trail,the rate of jointing insurance increased gradually.There was no difference between insurance of different periods.In 17 insurance,13 were clinical trial liability insurance,others were product and general liability insurance;5 provided insurance instruction,only insurance certificate or policy in others;2 insurance applied foreign language.Conclusion:Through project access system,strengthening the ethical approval,strengthening quality management to prevent the damage occurred,participants damage happened after fully protect the health and rights and interests of the subjects,and actively promote clinical trial insurance to perfect our subjects'damage compensation mechanism,the protection of the rights of the subjects,and reduce the risk of clinical trials.
Subjects;Damage Compensation;Insurance;Drug Clinical Trials
R197.32
A
1001-8565(2015)05-0758-04
2015-06-27〕
* 通讯作者,E-mail:shuher@126.com

