慢病毒介导过表达组织蛋白酶S基因对肝癌MHCC97H细胞增殖和迁移的作用
张智 朱广志 彭涛 赵国良 徐静
作者单位:530021 南宁 广西医科大学第一附属医院肝胆外科
基础研究
慢病毒介导过表达组织蛋白酶S基因对肝癌MHCC97H细胞增殖和迁移的作用
张智 朱广志 彭涛 赵国良 徐静
作者单位:530021 南宁 广西医科大学第一附属医院肝胆外科
目的 建立慢病毒介导过表达组织蛋白酶S(cathepsin S,Cat S)基因的肝癌细胞株,观察Cat S基因对肝癌MHCC97H细胞增殖和迁移的影响。方法 利用Age I和EcoR I双酶切获得目的基因片段,构建靶向过表达Cat S基因的慢病毒载体pLVX-EGFP-3FLAG-Puro,通过人胚肾上皮293T细胞进行慢病毒制备并感染肝癌MHCC97H细胞。使用嘌呤霉素加压筛选,建立稳定过表达Cat S基因的肝癌细胞株。通过RT-PCR、Western blot、MTT、Transwell和划痕实验研究稳定过表达Cat S基因对肝癌MHCC97H细胞增殖和迁移的影响。结果 成功包装靶向过表达Cat S基因慢病毒载体并感染肝癌MHCC97H细胞。慢病毒感染后,与空载对照细胞Mock-MHCC97H相比,慢病毒CatS-MHCC97H细胞CatSmRNA、CatS蛋白及MMP-2蛋白表达量明显升高(P<0.05),细胞增殖、迁移、侵袭能力亦明显增强(P<0.05)。结论 慢病毒介导的CatS基因过表达可能通过上调MMP-2蛋白表达促进肝癌MHCC97H细胞增殖、转移,Cat S基因可能是治疗肝癌的一个潜在靶点,这为阐明肝癌增殖和转移的分子生物学机制及提高肝癌基因治疗提供了新的实验依据。
肝肿瘤;组织蛋白酶S;过表达;慢病毒;增殖;迁移
肝细胞癌(hepatocellular carcinoma,HCC,以下简称“肝癌”)是世界范围内第五位常见癌症[1],据统计全世界每年新增病例超过660 000例[2,3]。诊断技术的发展使肝癌能获得早期诊断和治疗[4,5],但即使早期小肝癌手术切除后,5年转移、复发率仍然超过50%[6]。因此,寻找与肝癌侵袭、转移相关的敏感靶蛋白对研究肝癌发生侵袭、转移的分子机制具有重要意义。组织蛋白酶S(cathepsin S,Cat S)基因是溶酶体半胱氨酸蛋白酶家族(Cat B、C、F、H、K、L、O、S、V、W和X)成员之一。研究表明Cat S基因在肺癌、前列腺癌、胃癌和星形细胞瘤等多种肿瘤中过表达[7~10],而沉默Cat S基因可抑制腺肿瘤模型中肿瘤细胞的侵袭和血管生成,提示其在肿瘤的侵袭、转移中起重要作用[11]。我们的前期研究结果表明,Cat S基因在肝癌组织中呈高表达并和门静脉癌栓及肿瘤肝外转移关系密切[12]。然而,过表达Cat S基因在肝癌细胞的生长和侵袭中的作用尚未清楚。为此,本研究通过慢病毒介导稳定过表达Cat S基因,观察其对肝癌MHCC97H细胞生长和增殖的影响,以期阐明Cat S基因在体外对肝癌细胞侵袭和转移的作用机制,为肝癌治疗提供新思路。
1 材料和方法
1.1 材料
1.1.1 细胞株和质粒 肝癌MHCC97H细胞购自中科院上海细胞库,该细胞经转染慢病毒载体pLVXEGFP-3FLAG-Puro,不携带红色荧光的绿色荧光蛋白(GFP)标记。大肠杆菌DH5α和人胚肾上皮293T细胞株由上海第二军医大学附属长海医院中医科实验室保存。肝癌MHCC97H细胞和293T细胞均培养于10%FBS的DMEM中,细胞培养条件为恒温37°C、5%CO2、饱和湿度的细胞培养箱。
1.1.2 试剂和仪器 Age I和EcoR I购于美国NEB公司,慢病毒表达包装试剂盒(Lenti-PacTMHIV Expression Packaging Kit)购自美国Invitrogene公司,无内毒素质粒小量提取试剂盒购自美国Promega公司,Trizol购自美国Invitrogene公司,RT-PCR试剂盒购自日本TaKaRa公司,引物合成购自上海捷瑞生物工程有限公司,MTT购自美国Sigma公司,琼脂糖凝胶回收试剂盒购自美国Omega公司,六孔板、细胞培养瓶和Transwell小室购自美国Corning公司,Anti-Cat S抗体和 Anti-rabbit HRG酶标 IgG抗体购于美国 Santa Cruz公司,Anti-βactin抗体购于美国 Sigma公司,Western blot一抗稀释液和RIPA裂解液购于碧云天生物技术研究所,ECL化学发光成像系统购于美国Bio-Rad公司。
1.2 实验方法
1.2.1 慢病毒载体pLVX-EGFP-3FLAG-Puro构建及鉴定 使用EcoR和Xba I对pLVX-EGFP-3FLAGPuro表达载体进行双酶切,切去EGFP-3FLAG片段(810 bp),酶切产物进行琼脂糖凝胶电泳后回收约8.1 kb的载体片段。对目的基因进行扩增。引物设计合成:上游引物为5′-CGCAAATGGGCGGTAGGCGTG-3,下游引物为5′-CAGCGGGGCTGCTAAAGCGCATGC-3′。利用EcoR I和Xba I对化学合成的目的基因进行酶切,酶切产物进行琼脂糖凝胶电泳后回收约1 kb的目的基因片段。将目的基因连接入表达载体,将连接反应混合物转化大肠杆菌DH5α,挑取平板上长出的转化子重悬于10μl含氨苄青霉素的LB培养基中,恒温37°C振摇过夜,从中取1μl做模板进行菌落PCR鉴定。接种阳性克隆,取100μl送测序,测序结果完全正确后再接种进行质粒抽提。
1.2.2 慢病毒载体pLVX-EGFP-3FLAG-Puro及空载对照质粒pSB53-L.V的制备 取对数生长期的人胚肾上皮293T细胞常规消化重悬成单个细胞,提前1 d按照2×105个细胞/孔接种到6孔板中。按慢病毒包装试剂盒说明书对过表达质粒pLVX-EGFP-3FLAGPuro和空载对照质粒pSB53-L.V进行包装,常规培养48 h,收集上清液,置于4°C、1 200 r/min离心10min,过滤后,置于4°C、1 500 r/min离心4 h进行浓缩。药筛法测定慢病毒的滴度。
1.2.3 慢病毒转染肝癌MHCC97H细胞 实验前1 d将对数生长期的肝癌MHCC97H细胞按照5×104个细胞/孔铺在24孔板中,分别加入慢病毒载体pLVX-EGFP-3FLAG-Puro和空载对照质粒pSB53-L.V病毒液和终质量浓度为5μg/ml的聚凝胺。培养24 h后更换新鲜的10%FBSDMEM,传代扩大培养。21 d后拍摄荧光照片,不携带红色荧光标记的细胞命名为慢病毒Cat S-MHCC97H细胞组,携带少数红色荧光标记的细胞命名为空载对照Mock-MHCC97H细胞组。
1.2.4 RT-PCR法检测Cat SmRNA的表达情况 按invitrogene Trizol说明书提取 pLVX-EGFP-3FLAGPuro组和空载对照pSB53-L.V组细胞总 RNA,以cDNA逆转录试剂盒将RNA转化为cDNA,实时荧光定量PCR试剂盒进行RT-PCR检测。PCR引物:Cat S上游引物为5′-GCCTGATTCTGTGGACTGG-3′,下游引物为5′-GATGTACTGGAAAGCCGTTGT-3′;GAPDH上游引物为5′-GGAGTCCACTGGCGTCTTC-3′,下游引物为5′-GCTGATGATCTTGAGGCTGTTG-3′。qRT-PCR循环参数:预变性95℃15 s,每一步变性95℃5 s,退火延伸60℃30 s,共45个循环。每组重复实验3次,取其平均值,数据分析采用RT-PCR仪的Opticon-MonitorTMAnalysis软件完成。
1.2.5 Western blot法检测Cat S蛋白和MMP-2蛋白的表达情况 取对数生长期状态良好的Cat SMHCC97H细胞和对照Mock-MHCC97H细胞,按照4×105个细胞/孔接种于6孔板中,24 h后离心收集细胞、裂解,4°C、12 000 r/min离心10min,去沉淀收集上清液。BCA试剂盒测定细胞总蛋白浓度,制作蛋白样品。利用10%分离胶进行电泳,湿转法将目的蛋白转移至PVDF膜上,5%BSA室温下封闭1 h,然后分别加入Anti-Cat S抗体(1∶1 000)、Anti-MMP-2抗体(1∶1 000)和Anti-βactin抗体(1∶10 000),4°C过夜。用1×TBST洗膜3×10min后分别加入鼠二抗或者兔二抗(1∶2 000)室温下孵育1 h,1×TBST洗膜3×10min后加入适量发光液,ECL化学发光成像系统记录蛋白条带结果。
1.2.6 MTT实验观察CatS基因过表达对肝癌MHCC97H细胞生长的影响 分别消化Cat S-MHCC97H细胞和Mock-MHCC97H细胞,细胞计数后取1×103个细胞/孔接种到96孔板中,各接种8块板。每隔24 h随机取1块板,每孔加入10μlMTT溶液(10mg/ml),常规培养4 h后,每孔加入150μl的DMSO,振荡5 min,置于多功能酶标仪中进行检测,绘制细胞生长曲线。
1.2.7 划痕实验观察 Cat S基因过表达对肝癌MHCC97H细胞迁移的影响 取生长良好的Cat SMHCC97H细胞和Mock-MHCC97H细胞,分别以5×105个细胞/孔接种于6孔板,细胞长至饱和状态后,用无菌Tip头划出无细胞痕,然后加入含有8μg/ml的丝裂霉素C、无血清的DMEM培养基1 m l。常规培养24 h后显微镜下观察相同位置细胞的迁移情况。1.2.8 Transwell小室趋化实验观察Cat S基因过表达对肝癌MHCC97H细胞迁移的影响 取生长良好的Cat S-MHCC97H细胞和Mock-MHCC97H细胞,分别以2×104个细胞/孔接种于Transwell小室的上室,加入无血清的DMEM培养,下室加入500μl 20% FBS的DMEM培养基,常规培养24 h后,甲醇固定5 min,结晶紫染色5 min,小室在倒置显微镜下随机选择中央及四周8个视野(×100),计数每个视野穿过微孔膜的细胞数目。重复实验3次,每组设3个复孔。
1.3 统计学分析
使用SPSS 16.0统计学软件对数据进行分析。实验数据以均数和标准差(±S)表示,两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒载体pLVX-EGFP-3FLAG-Puro酶切鉴定
慢病毒载体pLVX-EGFP-3FLAG-Puro用EcoR和Xba I进行双酶切,切去EGFP-3FLAG片段(810 bp),酶切产物在1%琼脂糖凝胶电泳后回收约8.1 kb的载体片段,与预计结果符合,证明载体构建成功。见图1。
2.2 双酶切获得目的基因片段
化学合成的Cat S目的基因用EcoR I和Xba I对进行双酶切,酶切产物在1%琼脂糖凝胶电泳后回收约1 kb的目的基因片段。与预计结果符合,证明目的基因合成正确。酶切图谱见图2。
2.3 阳性克隆鉴定
挑取平板上长出的转化子,重悬于10μl LB培养液中,再从中取出1μl做模板进行菌落PCR鉴定,阳性克隆得到1 256 bp的片断,阴性克隆得到1 058 bp的片断。菌落PCR鉴定见图3。接种阳性克隆,取其中100μl送测序。阳性克隆测序结果和预期的序列完全一致。
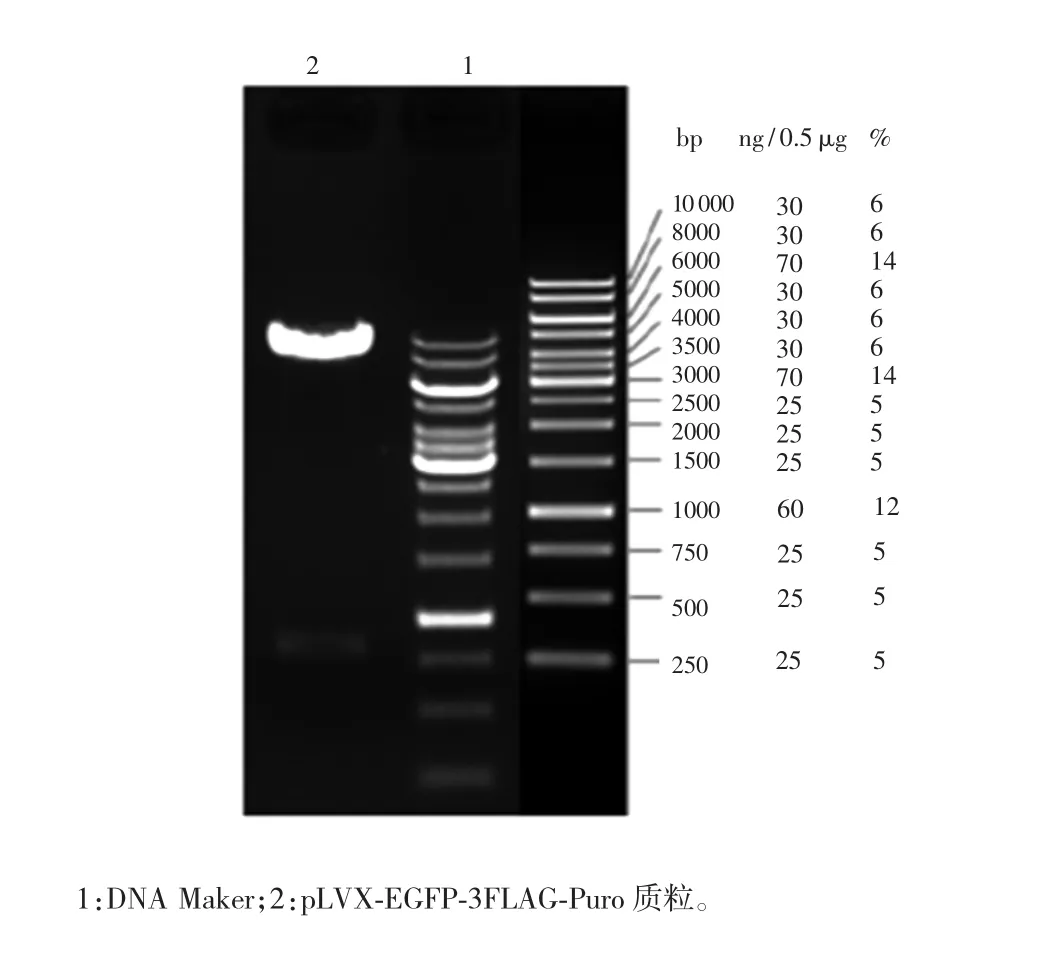
图1 慢病毒载体pLVX-EGFP-3FLAG-Puro的鉴定
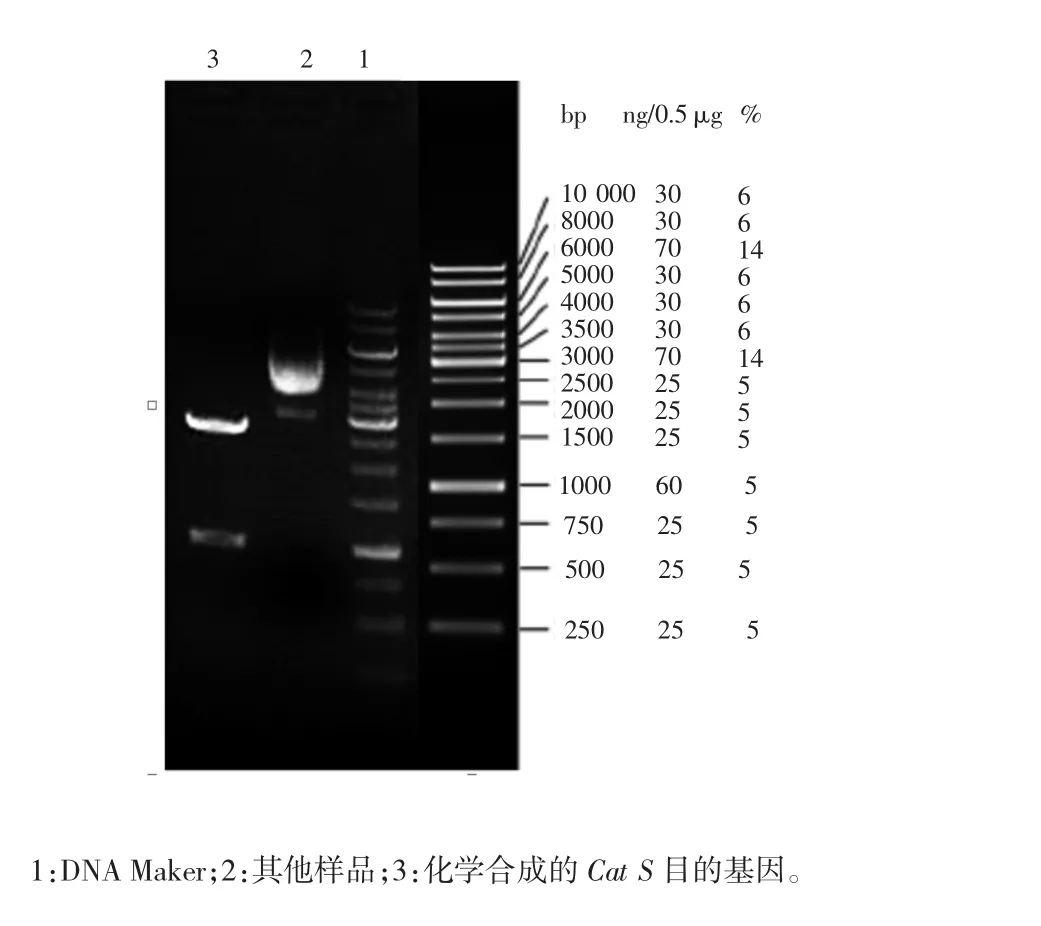
图2 酶切获得目的基因片段
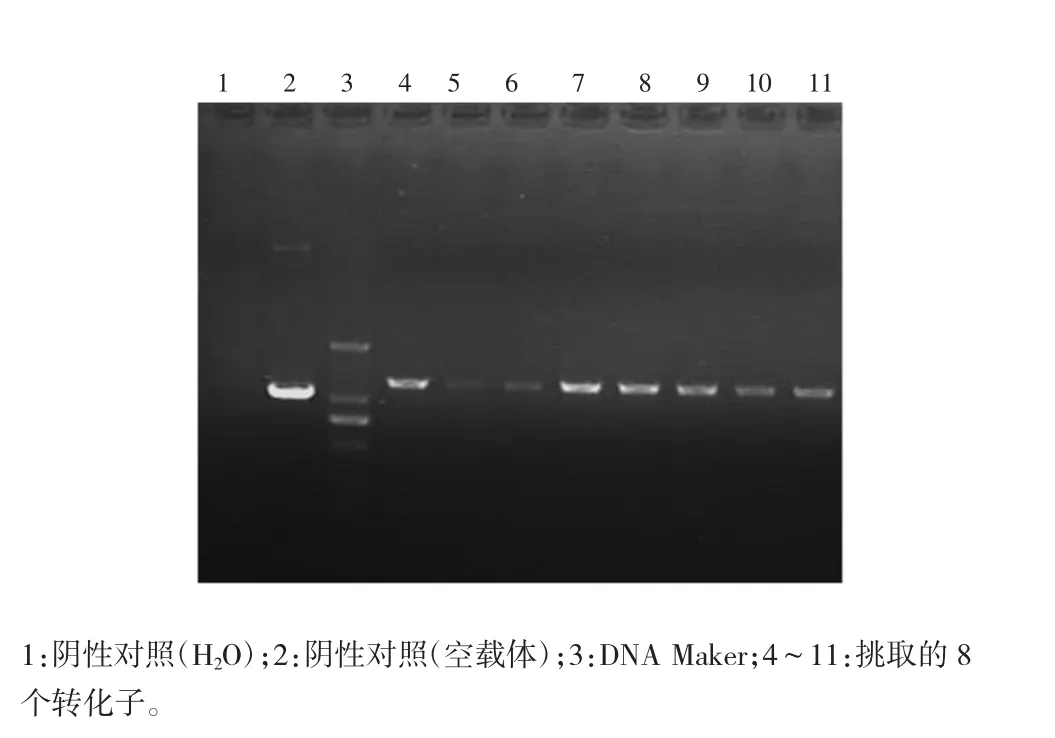
图3 阳性菌落PCR鉴定图
2.4 慢病毒感染肝癌MHCC97H细胞
药筛法测定慢病毒滴度为2×108(TU/ml),将慢病毒pLVX-EGFP-3FLAG-Puro和空载对照质粒pSB53-L.V感染肝癌MHCC97H细胞21 d后拍摄荧光照片。Cat S-MHCC97H细胞不携带红色荧光标记,空载对照Mock-MHCC97H细胞携带少量的荧光。见图4。
2.5 肝癌MHCC97H细胞中Cat SmRNA的表达
慢病毒转染肝癌MHCC97H细胞后,RT-PCR检测结果显示,Cat S-MHCC97H细胞中Cat SmRNA的表达量明显高于Mock-MHCC97H细胞,差异有统计学意义(P<0.05)。见图5。

图4 荧光显微镜观察慢病毒感染21d后的肝癌MHCC97H细胞(×200)
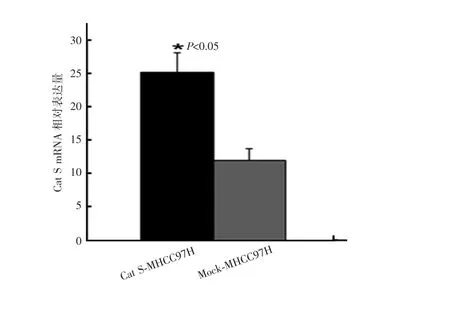
图5 肝癌MHCC97H细胞中Cat Sm RNA的相对表达量
2.6 肝癌MHCC97H细胞中Cat S蛋白的表达
慢病毒感染后,Western blot检测结果显示,Cat SMHCC97H细胞CatS蛋白的表达量较Mock-MHCC97H细胞增加,约为Mock-MHCC97H细胞的2倍。此外,Cat S-MHCC97H细胞中MMP-蛋白的表达量也明显高于Mock-MHCC97H细胞。见图6。
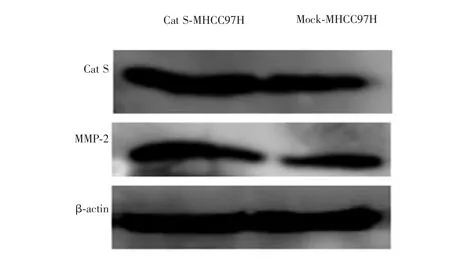
图6 肝癌MHCC97H细胞中Cat S蛋白和MMP-2蛋白的表达
2.7 Cat S基因对肝癌MHCC97H细胞增殖能力的影响
MTT实验结果显示,第4天Cat S-MHCC97H细胞的生长速度较Mock-MHCC97H细胞明显升高,差异有统计学意义(P<0.05)。提示过表达Cat S基因可增强肝癌MHCC97H细胞的生长活性。见图7。
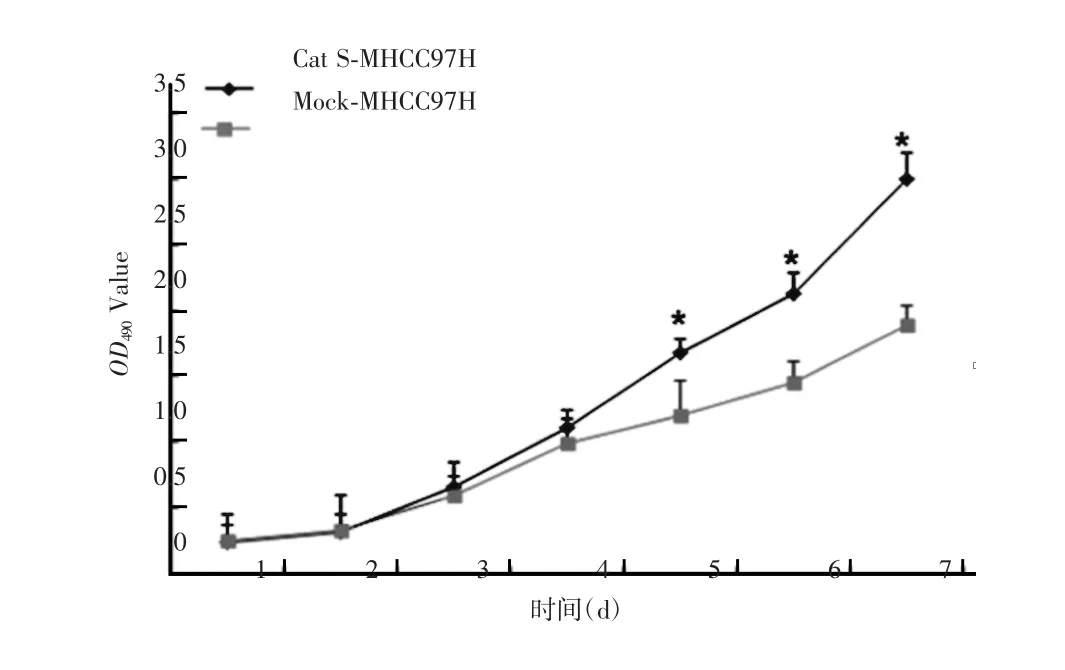
图7 过表达Cat S基因对肝癌MHCC97H细胞增殖能力的影响
2.8 CatS基因对肝癌MHCC97H细胞迁移能力的影响
常规培养24 h后进行划痕实验,结果显示,Cat S-MHCC97H细胞和Mock-MHCC97H细胞的迁移率分别为(22±1.1)%和(18±1.4)%,差异有统计学意义(P<0.05),提示Cat S基因过表达后能明显促进Cat S-MHCC97H细胞迁移。见图8。
2.9 Cat S基因对肝癌MHCC97H细胞侵袭能力的影响
Transwell小室趋化实验结果显示,Cat S-MHCC97H细胞和Mock-MHCC97H细胞穿过人工基底膜的细胞数分别为(87±5.9)个和(32±4.6)个,差异有统计学意义(P<0.05),提示过表达Cat S基因后肝癌MHCC97H细胞的运动侵袭能力增强。见图9。

图8 过表达CatS基因对肝癌MHCC97H细胞迁移能力的影响(×100)
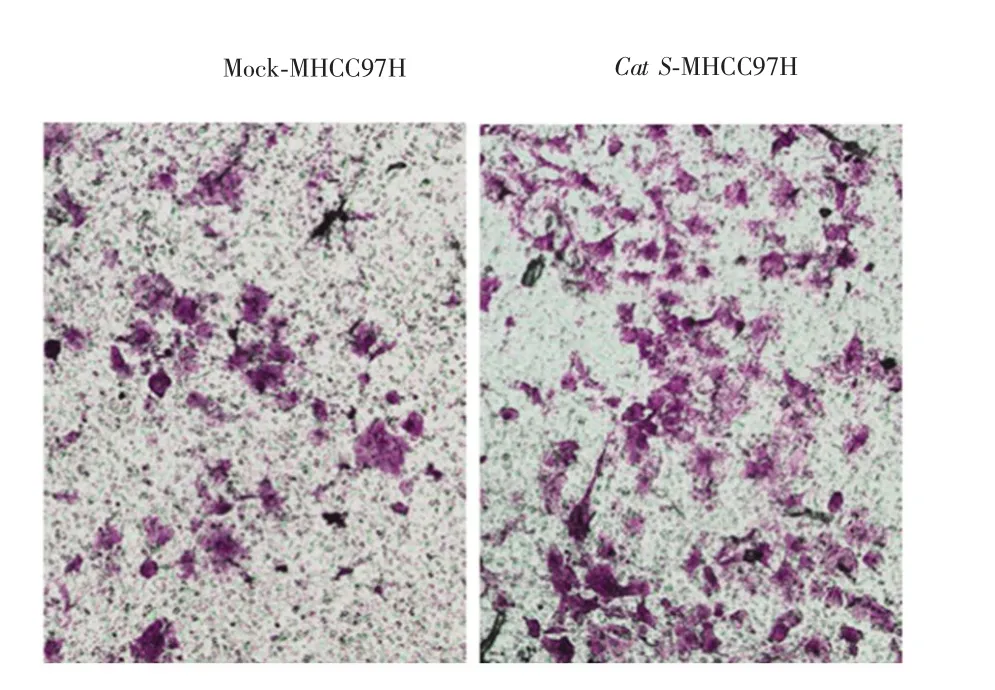
图9 过表达CatS基因对肝癌MHCC97H细胞迁移能力的影响(×100)
3 讨论
组织蛋白酶属于同源性蛋白酶,在多种细胞中均有表达[13]。Cat S基因作为组织蛋白酶家族(Cat B、C、F、H、K、L、O、S、V、W和X)的成员之一,通常位于溶酶体内,被激活后分泌到细胞表面,然后进入细胞外环境,发挥其生物学效应[14,15]。Flannery等[7]用免疫组化法研究发现,Cat S基因在人星形细胞瘤中高表达,而且与肿瘤的进展程度相关,在Ⅳ期肿瘤中表达量最高,但在正常星形细胞中未见表达。许多研究亦证实Cat S基因参与调控肿瘤细胞凋亡[16],诱导内皮生长因子释放,促进新生血管生成等[15],与肿瘤的发生、发展关系密切。然而,Cat S基因在肝癌发生、发展中的分子机制尚未清楚。慢病毒载体由于可稳定地将目的基因整合到宿主基因组中,并长期地表达该目的基因而被用于基因治疗。随着相关技术不断发展、进步,目前应用慢病毒技术不仅可上调基因表达,还可从基因组水平研究基因功能。为此,本研究利用慢病毒载体作基础,将Cat S基因的编码区域克隆于慢病毒载体,成功建立了过表达Cat S基因肝癌细胞,为后续研究Cat S基因功能奠定了实验基础。
肝癌是世界范围内死亡率较高的常见恶性肿瘤,但目前对其尚无有效的治疗措施,主要是因为各种疗法均未能很好地解决肿瘤的复发和转移问题,进而极大影响了其临床疗效。随着人们对肝癌机制的研究不断深入以及分子生物学及基因工程技术的快速发展,肝癌的基因治疗成为继手术、放化疗及介入治疗之后的一种新型治疗方法,因此,寻找肝癌治疗有效的靶点,尤其是与肝癌侵袭、转移相关的敏感靶基因对提高肝癌临床疗效至关重要。本研究发现,肝癌MHCC97H细胞过表达Cat S基因后,明显促进了癌细胞增殖和侵袭,与我们前期的研究结论一致。提示Cat S基因可能在肿瘤侵袭和转移中发挥了关键作用,可能是治疗肝癌的一个潜在靶点。
最近研究表明蛋白质组学对肿瘤诊断标志物和治疗靶点的选择具有重要作用[17]。Palermo等[18]认为基质金属蛋白酶(matrixmetalloproteinase,MMPs),包括基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)是肿瘤研究领域的重点内容之一。MMPs主要通过降解的细胞外基质(extracellularmatrix,ECM)促进肿瘤侵袭[19]。MMP-2可以降解肿瘤血管的基底膜,导致肿瘤细胞发生侵袭、迁移,与肝癌的侵袭、转移亦密切相关[20,21]。进一步研究显示,组织蛋白酶通过降解ECM促进癌细胞侵袭、转移和血管生成[22]。有报道称Cat S参与了降解细胞外基质蛋白,如弹性蛋白、纤维粘连蛋白、层粘连蛋白和胶原蛋白[15,23]及MMP-2[24]。本研究观察了肝癌MHCC97H细胞过表达Cat S基因后MMP-2蛋白的表达情况,结果发现,过表达Cat S基因能显著增加肝癌MHCC97H细胞中MMP-2蛋白的表达,推测Cat S基因过表达可使肝癌细胞MMP-2蛋白的表达量升高,从而促进肝癌MHCC97H细胞侵袭、转移,有关方面有待进一步深入研究。
随着对肝癌自然病程与生物学特性的认识不断深入以及目前临床上各种治疗方法的优化和联合应用,肝癌的治疗理念和策略将发生深刻转变,而分子靶向治疗异常改变的基因,将在肝癌临床治疗中具有良好的发展前景。本研究认为过表达Cat S基因对肝癌MHCC97H细胞增殖和侵袭具有促进作用,其分子生物学机制可能与MMP-2蛋白的表达有关,提示CatS基因可能成为治疗肝癌的一个潜在靶点,这为促进肝癌基因治疗及进一步阐明肝癌增殖和转移机制提供新的思路。
[1] Pa r k i n D M,B r a y F,F e r l a y J,et a l.G lob a l c an ce r st a t i st i cs,2002[J]. C A C an ce r J C l i n,2005,55(2):74-108.
[2] Jem a l A,Mu rr a y T,W a r d E,et a l.C an ce r st a t i st i cs,2005[J].C A C an ce r J C l i n,2005,55(1):10-30.
[3] S m i t h R A,C okk i n i des V,E y r e H.A me ri c an C an ce r S oc i ety g u i del i n es fo r t h e e a r ly detect i o n of c an ce r,2006[J].C A C an ce r J C l i n. 2006,56(1):11-25,49-50.
[4] C a b r e r a R,N elso n D R.R ev i ew a r t i cle:t h e m ana g eme n t of h ep a tocell u l a r c a r c i n om a[J].A l i me n t Pha r m a col T h e r,2010,31(4):461-476.
[5] L lovet J M,Bu rr o u g h s A,B r u i x J.H ep a tocell u l a r c a r c i n om a[J]. L an cet,2003,362(9399):1907-1917.
[6] B r u i x J,Llovet J M.Ma jo r a c h i eveme n ts i n h ep a tocell u l a r c a r c i n om a[J].L an cet,2009,373(9664):614-616.
[7] F l ann e r y T,Gi bso n D,M ir a k hu r M,et a l.T h e cl i n i c a l s ig n i f i c an ce of c a t h eps i n S exp r ess i o n i n hu m an a st r ocytom a s[J].A m J Pa t h ol,2003,163(1):175-182.
[8] K os J,S ek ir n i k A,K op i t a r G,et a l.C a t h eps i n S i n t u mo u r s,r e gi o na l lymp h n odes an d se r a of p a t i e n ts w i t h l un g c an ce r:r el a t i o n to p r o gn os i s[J].B r J C an ce r,2001,85(8):1193-1200.
[9] L i n d ah l C,Si mo n sso n M,B e rg h A,et a l.I n c r e a sed levels ofm a c r op ha g esec r eted c a t h eps i n S d u ri n g p r ost a te c an ce r p r o gr ess i o n i n T R A MP m i ce an d p a t i e n ts[J].C an ce r G e n om i cs P r oteom i cs,2009,6(3):149-159.
[10] Y an g Y,L i m S K,C h oo n g LY,et a l.C a t h eps i n S med i a tes g a st ri c c an ce r cellm igr a t i o n an d i n v a s i o n v i a a p u t a t i ve n etwo r k ofmet a st as i s-a ssoc i a ted p r ote i n s[J].J P r oteome R es,2010,9(9):4767-4778.
[11]G oc h ev a V,Z e n g W,K e D,et a l.D i st i n ct r oles fo r cyste i n e c a t h eps i n g e n es i n m u lt i st a g e t u mo rig e n es i s[J].G e n es D ev,2006,20(5):543-556.
[12] Xu J,L i D,K e Z,et a l.C a t h eps i n S i s a be rr an tly ove r exp r essed i n hu m an h ep a tocell u l a r c a r c i n om a[J].M ol M ed R ep,2009,2(5):713-718.
[13]C ha pm an H A,R i ese R J,S h iG P.E me rgi n g r oles fo r cyste i n e p r ote a ses i n hu m an b i olo g y[J].A nnu R ev Ph ys i ol,1997,5963-5988.
[14]Lev i c a r N,S t r oj n i k T,K os J,et a l.Lysosom a l e nz ymes,c a t h eps i n s i n b r a i n t u mo u r i n v a s i o n[J].J N e u r oo n col,2002,58(1):21-32.
[15]W an g B,S un J,K i t a moto S,et a l.C a t h eps i n S co n t r ols an gi o g e n es i s an d t u mo rgr owt h v i a m a t ri x-de ri ved an gi o g e n i c f a cto r s[J].J B i ol C h em,2006,281(9):6020-6029.
[16]T u r k B,S tok a V,R o z m an-Pun g e r c a r J,et a l.A poptot i c p a t h w a ys:i nvolveme n t of lysosom a l p r ote a ses[J].B i ol C h em,2002,383(7-8):1035-1044.
[17]L i m SO,Pa r k S J,K i m W,et a l.P r oteome ana lys i s of h ep a tocell u l a r c a r c i n om a[J].B i oc h em B i op h ys R es C omm un,2002,291(4):1031-1037.
[18]Pa le r mo C,Joyce J A.C yste i n e c a t h eps i n p r ote a ses a s p ha r m a colo gi c a l t a rg ets i n c an ce r[J].T r e n ds Pha r m a col S c i,2008,29(1):22-28.
[19] S p an o D,Z ollo M.T u mo r m i c r oe n v ir o n me n t:a m a i n a cto r i n t h e met a st a s i s p r ocess[J].C l i n E xp M et a st a s i s,2012,29(4):381-395.
[20] Bu W,Huan g X,T an g Z.T h e r ole of MMP-2 i n t h e i n v a s i o n an d met a st a s i s of h ep a tocell u l a r c a r c i n om a(H CC)[J].Zh o n g hua Y i Xu e Za Zh i,1997,77(9):661-664.
[21]Ye h H C,L i n S M,C h e n M F,et a l.E v a l ua t i o n of se r u m m a t ri xmet a llop r ote i na se MMP-9 to MMP-2 r a t i o a s a b i om a r ke r i n h ep a tocell u l a r c a r c i n om a[J].H ep a to g a st r oe n te r olo g y,2010,57(97):98-102.
[22]F u Y G,S un g JJ,W u KC,et a l.I nh i b i t i o n of g a st ri c c an ce r-a ssoc i a ted an gi o g e n es i sby an t i se n se C O X-2 t r an sfect an ts[J].C an ce r Lett,2005,224(2):243-252.
[23]Bu r de n R E,G o r mley J A,J a q u i n T J,et a l.A n t i body-med i a ted i nh i b it i o n ofc a t h eps i n S blockscolo r ect a l t u mo r i n v a s i o n an d an gi o g e n es i s[J]. C l i n C an ce r R es,2009,15(19):6042-6051.
[24]S eve n i c h L,S c hu rig t U,S a c h se K,et a l.S y n e rgi st i c an t i t u mo r effects ofcomb i n ed c a t h eps i n B an d c a t h eps i n Z def i c i e n c i eso n b r e a stc an ce r p r o gr ess i o nan dmet a st a s i s i n m i ce[J].P r oc N a tl A c a d S c i U SA,2010,107(6):2497-2502.
[2015-03-23收稿][2015-05-25修回][编辑 罗惠予]
Effects of lentivirus-mediated overexpression of Cat S gene on proliferation and m igration of hepatocellular carcinoma cellMHCC97H
ZHANG Zhi,ZHU Guangzhi,PENG Tao,ZHAO Guoliang,XU Jing(Department of Hepatobiliary Surgery,The First Affiliated Hospital of GuangxiMedical University,Nanning 530021,P.R.China)
XU Jing.E-mail:jxuapr@aliyun.com
Objective To construct a lentivirus expression vector to drive stable Cat S overexpression in the hepatocellular carcinoma(HCC)cell line MHCC97H,and to investigate the effects of overexpression on cell proliferation and migration.M ethods The Cat S gene was inserted into the lentiviral expression vector pLVX-EGFP-3FLAG-Puro using Age I and EcoR I restriction enzymes and transfected into 293T cells to generate recombinant lentivirus.This virus was used to infect MHCC97H cells,and positive cells were selected using puromycin.Real-time quantitative PCR,Western blots,MTT assay,the transwellmigration assay and the wound healing migration assay were used to assess the effects of Cat S overexpression on proliferation and migration of MHCC97H cells.Results A lentiviral vector containing the Cat S gene was constructed,and an MHCC97H cell line stably overexpressing Cat Swas established. Cat Soverexpression was associated with significantly shorter cell doubling time,aswell as significantly greater invasion and migration abilities.Conclusions Lentivirus-mediated Cat Soverexpression can increase MHCC97H proliferationand migration,opening the doorto future studies ofmolecularmechanisms of liver cancer invasion and metastasis.
Liver neoplasm;Cathepsin S;Overexpression;Lentivirus infections;Proliferation;Migration
R735.7
A
1674-5671(2015)04-07
10.3969/j.issn.1674-5671.2015.04.02
国家自然科学基金资助项目(81360372);广西自然科学基金资助项目(2011GXNSFA018284);广西卫生厅科研基金资助项目(GZKZ10-114)
徐静。E-mail:jxuapr@aliyun.com

