裸鼠肝包膜下输注DC-CIK细胞抑制脾内肿瘤和肝转移瘤生长的初步研究
徐兵吴林岚黄素钦杨晓梅吴开木
作者单位:350025 福州1福建医科大学孟超肝胆医院肝病研究所;350001 福州2福建省第二人民医院检验科专家组;3福州市菁华崇辉医院内科
基础研究
裸鼠肝包膜下输注DC-CIK细胞抑制脾内肿瘤和肝转移瘤生长的初步研究
徐兵1吴林岚2黄素钦1杨晓梅3吴开木2
作者单位:350025 福州1福建医科大学孟超肝胆医院肝病研究所;350001 福州2福建省第二人民医院检验科专家组;3福州市菁华崇辉医院内科
目的建立一种肝脏靶向输注免疫效应细胞法,用于抑制脾内肿瘤和肝转移瘤生长。方法 将一空心纤维垫置于接种SW480肿瘤模型裸鼠肝包膜下,形成肝包膜下人工囊腔;从人外周血单核细胞诱导出细胞因子诱导杀伤细胞(cytokine induced killer,CIK)和树突状细胞(dendritic cell,DC)。体外检测CIK对SW480细胞杀伤率,并使DC负载SW480细胞抗原。将共同培养的效应细胞(DC-CIK)注入模型裸鼠肝包膜下人工囊腔(A组,20只)和尾静脉(C组,20只),每只6×107个/0.3m l;同法对20只模型裸鼠分别注入生理盐水,0.3m l/只,并分为B组、D组各10只(作为A组、C组的对照)。每周注射2次,共注射4周。末次注射后48 h,检查比较A组和C组脾内原发肿瘤体积、抑瘤率和肝组织病理切片转移瘤灶均数。结果 效靶比为60∶1时CIK对SW480细胞杀伤率为(75.3±8.42)%。CIK的CD3/CD56表达率为(36.4±13.2)%。治疗后,A组和C组的抑瘤率分别为32.07%和16.54%(P<0.05);A组和C组肝组织切片转移瘤灶均数分别为(2.47±1.02)个和(5.05±1.06)个(P<0.01)。结论 裸鼠肝包膜下输注DC-CIK可明显抑制脾内肿瘤和肝转移瘤生长,抑瘤效果优于尾静脉注射DC-CIK。
肝肿瘤;脾脏肿瘤;细胞因子诱导杀伤细胞;树突状细胞;包膜;裸鼠
树突状细胞(dendritic cell,DC)联合细胞因子诱导的杀伤细胞(cytokine induced killer,CIK)是一种新兴的过继免疫疗法。用效应细胞(DC-CIK)防治肿瘤要求DC-CIK聚集在靶细胞(癌细胞)附近,且效靶细胞数比例要足够大。目前临床主要通过静脉输注DCCIK,使之广泛分布于全身大部分器官,但分布的多少与血运丰富程度、器官免疫属性和流经次序有关,难以靶向聚集在某一脏器。有报道将DC-CIK输注在肿瘤周围,其抑瘤效果优于静脉输注[1],但局部输注存在穿刺损伤、癌细胞播散等问题。本研究在裸鼠肝包膜下预构一人工囊腔,通过人工囊腔将DC-CIK输注到肝包膜下肝实质表面,建立一种微创肝脏靶向输注法,用以抑制脾内肿瘤细胞的生长和肝转移,证明本法的可行性和有效性。
1 材料与方法
1.1 实验动物和细胞
SPF级BALB/c-nu小鼠60只,雄性,鼠龄7~8周,体重(25±2)g,购自上海斯莱克实验动物公司(合格证号:SCXK沪2007-0005)。人结肠腺癌细胞株SW480购自中科院上海细胞研究所,细胞用含10%胎牛血清、100 U/ml青霉素、100μg/ml链霉素的RPMI 1640培养液,在37℃、5%CO2培养箱培养,隔日换液,4 d传代一次。
1.2 主要试剂、仪器和材料
RPMI 1640培养液、胎牛血清(美国Hyclone公司)。rh IL-2、rh IFN-γ(美国Pepro Tech公司)。人CD3单抗(美国ebioscience公司)。rhGM-CSF、rIL-4(美国R&D公司)。淋巴细胞分离液(上海生化试剂二厂)。异硫氰酸荧光素/藻红蛋白(FITC/PE)标记的鼠抗人CD单抗和流式细胞术仪(美国BD公司)。空心纤维垫(用威海威高血液净化制品公司WG-F50-PP空心纤维血浆分离器的聚丙烯空心纤维缠绕自制)。
1.3 CIK细胞的诱导和扩增
采集健康献血者抗凝外周血液50ml,用淋巴细胞分离液密度梯度离心,分离外周血单个核细胞(PBMC),用完全培养液(含10%胎牛血清的RPMI 1640培养液)调整细胞浓度为5×106个/m l,置37℃、5%CO2培养箱培养2 h。收集非贴壁细胞,用完全培养液调整细胞浓度为1×106个/ml,加入IFN-γ 1 000 U/ml,置37℃、5%CO2条件下培养24 h后,加入人CD3单抗(终浓度为100 ng/ml)和IL-2(终浓度为300 U/ml)继续培养,以后每3 d半量换液一次,补足细胞因子[2]。
1.4 DC细胞的诱导和扩增
取上述留有贴壁细胞的25ml培养瓶,加入DC培养液(含20%胎牛血清、1 000U/mlGM-CSF和500U/ml IL-4的RPMI 1640培养液)15 ml/瓶;置37℃、5%CO2条件下培养,隔日全量换液并补足细胞因子[2]。
1.5 用SW 480肿瘤抗原对DC体外冲击致敏
将SW480肿瘤细胞浓度调为2×107个/ml,经液氮和37℃反复冻融4次,离心取上清液过滤除菌,即为SW480肿瘤抗原溶液。收集上述诱导培养8 d的DC,以DC∶SW480肿瘤抗原=1∶10(细胞数比例)加入上述冻融抗原,继续培养16 h,即为负载SW480肿瘤抗原的DC[3]。
1.6 DC细胞和CIK细胞共培养
将上述负载SW480肿瘤细胞抗原的DC细胞和同期CIK细胞按1∶5比例混合,用CIK培养液(含10%胎牛血清、IFN-γ1 000 U/ml、人CD3单抗100 ng/m l、IL-2 300 U/ml的RPMI 1640培养液)共培养4 d,用于输注裸鼠[2]。
1.7 鼠尾胶原凝胶的制备
收集鼠尾置75%乙醇中浸泡30 min;无菌条件下撕下尾腱,剪碎。取1.5 g尾腱碎片浸入150ml 0.1%醋酸中,置4℃冰箱,用磁力搅拌器搅拌48 h,离心收集上清液干燥后称重,用0.1%醋酸溶解为20 g/L胶原溶液。临用前用1mol/LNaOH将胶原溶液pH值调为7.4,待成黏稠胶状即可使用[4]。
1.8 裸鼠荷瘤模型的建立及动物分组
将处于对数生长期的SW480瘤细胞用0.9%NaCl溶液配成1×107个/ml无菌细胞悬液(用台盼蓝拒染法测细胞活率>95%)。裸鼠用40 g/L水合氯醛(10ml/kg)腹腔注射麻醉。手术开腹,在脾脏下极的包膜下缓慢注入肿瘤细胞悬液0.1 ml(时间>2min)。提起肝包膜,用眼科镊刺入潜行分离出肝包膜下间隙,切开肝包膜将空心纤维垫塞进肝包膜下(形成肝包膜下人工囊腔),缝合肝包膜并用胶原凝胶涂封肝包膜全表面;将腹壁切口肌层缝合于两边皮下组织,使人工囊腔的肝包膜贴近皮下,缝合皮肤关腹。这样可在腹部只隔皮肤触及人工囊腔,便于向肝包膜下人工囊腔内注射。接种肿瘤细胞后的裸鼠在严格无菌条件下饲养。将60只荷瘤裸鼠模型随机分为4组:A组20只,B组10只,C组20只,D组10只。接种肿瘤细胞建模后2 d,经皮穿刺以肝包膜下人工囊腔中的空心纤维垫为引导,将DC-CIK(6×107个/0.3 ml)、生理盐水0.3 ml分别注入A组、B组人工囊腔(分布于肝实质表面);将DC-CIK(6×107个/0.3ml)、生理盐水0.3 ml分别注入C组、D组尾静脉。每周注射2次,共注射4周[5]。末次注射后48 h处死裸鼠,检测肿瘤情况。
1.9 CIK和DC细胞表型鉴定
用流式细胞术仪检测培养淋巴细胞的CD3/CD56、CD3/CD8表达率以鉴定 CIK。检测 CD1a、CD83、CD1a/CD83、CD86/HL-DR的表达率以鉴定DC。
1.10 CIK细胞体外杀瘤细胞活性的检测
以SW480肿瘤细胞为靶细胞接种于96孔板中,104个细胞/孔;以CIK细胞为效应细胞,按效靶比20∶1、40∶1、60∶1将CIK细胞加入各孔中,于37℃、5%CO2条件下培养48 h。在培养结束前4 h,加入四甲基偶氮唑蓝(MTT,5 mg/ml)20μl/孔,继续培养4 h,此为实验组。另设立单一效应细胞组、单一靶细胞组及空白对照组。每组设3个复孔。用酶标检测仪测定各孔492 nm的吸光度A值,按以下公式计算:细胞杀伤率(%)=[1-(实验组A值-效应细胞组A值)/靶细胞组A值]×100%。
1.11 脾内原发瘤和肝转移瘤灶检测
摘眼球取血颈椎脱臼处死裸鼠,切开脾脏完整取出肿瘤,用游标卡尺测量肿瘤最大径(a)和最小径(b),计算肿瘤体积(V)=ab2/2;以A组、C组为实验组,B组、D组为相应的对照组,计算抑瘤率。抑瘤率(%)=(对照组平均体积-治疗组平均体积)/对照组平均体积×100%。取裸鼠肝脏连续切片做病理检查,按4个等级计数肝转移瘤灶:0级(肝脏无转移灶),Ⅰ级(1~5个转移灶),Ⅱ级(6~10个转移灶),Ⅲ级(>10个转移灶)[5]。
1.12 统计学分析
采用SPSS 19.0统计学软件处理数据,计量数据以平均数±标准差(±s)表示,两组比较用t检验,两组百分率比较用χ2检验;以P<0.05为差异有统计学意义。
2 结果
2.1 CIK细胞表型
诱导13 d的CIK细胞CD3/CD56双阳性表达率为(36.4±13.2)%,未经诱导淋巴细胞的相应表达率为(6.7±3.2)%,两者比较差异有统计学意义(P<0.01),诱导后CD3/CD8双阳性表达率为(43.5±15.5)%,诱导前淋巴细胞为(28.5±2.6)%。诱导前后结果比较差异有统计学意义(P<0.05)。
2.2 DC细胞表型
诱导7 d的DC细胞CD1a(DC特异性指标)、CD83(DC成熟指标)、CD1a/CD83双阳性、CD86/HLDR双阳性表达率均比诱导前有较大升高。提示本实验培养出成熟的DC。见表1。
表1 诱导7 d的DC和诱导前淋巴细胞表面CD分子的表达率[(±s),%]

表1 诱导7 d的DC和诱导前淋巴细胞表面CD分子的表达率[(±s),%]
△与诱导前淋巴细胞比较,P均<0.05。
指标 n DC 诱导前淋巴细胞CD1a 10 57.62±7.16△1.79±0.57 CD83 10 80.70±8.31△2.78±0.42 CD1a/CD83 10 55.73±6.26△1.75±0.53 CD86/HL-DR 10 31.52±4.38△3.39±1.89
2.3 CIK细胞体外杀瘤细胞活性
CIK对SW480肿瘤细胞的杀伤率随效靶细胞比的增加而上升,以60∶1的杀伤效果最好,达(75.3±8.42)%,但与其他组比较无明显差异(P均>0.05)。见表2。
表2 不同效靶比CIK细胞对SW 480肿瘤细胞的杀伤率[(±s)%]

表2 不同效靶比CIK细胞对SW 480肿瘤细胞的杀伤率[(±s)%]
△与20∶1组或40∶1组比较,P均>0.05。
CIK:SW480 n 肿瘤细胞死亡率20∶1 6 60.4±4.43 40∶1 6 72.5±7.27 60∶1 6 75.3±8.42△
2.4 脾内原发肿瘤的检测
A组、B组、C组、D组都有1只裸鼠未成瘤,总成瘤率为93.3%。治疗后,A组肿瘤平均体积明显小于C组肿瘤平均体积(P<0.05)。A组抑瘤率明显高于C组抑瘤率(P<0.05)。见表3。

表3 治疗后各组裸鼠脾内原发肿瘤体积及抑瘤率
2.5 肝转移瘤检查
各组按肝组织切片转移瘤灶数量分成4级,A组的0级(无转移瘤)裸鼠数量明显多于其余组相应值;A组的转移瘤灶均数明显少于C组、B组和D组相应值(P均<0.05)。见表4。
表4 各组按肝组织切片转移瘤灶数量分级的裸鼠数量和瘤灶均数[(±s),个]
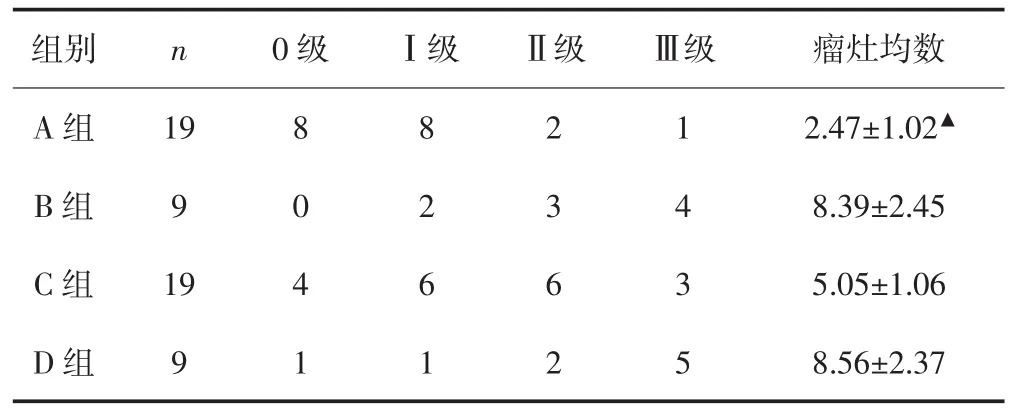
表4 各组按肝组织切片转移瘤灶数量分级的裸鼠数量和瘤灶均数[(±s),个]
▲分别与B组、C组或D组比较,P均<0.05。
组别 n 0级 Ⅰ级 Ⅱ级 Ⅲ级 瘤灶均数A组 19 8 8 2 1 2.47±1.02▲B组 9 0 2 3 4 8.39±2.45 C组 19 4 6 6 3 5.05±1.06 D组 9 1 1 2 5 8.56±2.37
3 讨论
肝癌患者常伴有肝功能损害和免疫功能低下,使化疗和放疗难以进行,故对中晚期肝癌患者目前主要采用物理或生物疗法辅助治疗。其中生物疗法对癌细胞靶向性强,可提高机体免疫功能,尤适用于清除手术后残余和早期转移的癌细胞。目前用免疫效应细胞(DC、CIK等)治疗肿瘤的主要途径有皮下和静脉注射,但二者均存在输注的细胞难以在肿瘤组织内大量聚集的缺点[6,7]。有报道将效应细胞直接注入瘤周,发现抑瘤效果优于静脉或腹腔输注[1]。但是瘤周或瘤内注射有可能引发医源性肿瘤细胞播散的危险。在动物实验中,穿刺实体瘤大约可引起1010个肿瘤细胞的种植,并可导致85%的肿瘤细胞种植性生长[8]。即使用细针穿刺进行原发性肝癌活检,穿刺道的种植转移发生率也在1%~5%之间[9,10]。这是所有肿瘤局部穿刺的固有缺点。为了实现脏器靶向给药,避免肿瘤局部穿刺,本研究将效应细胞输注于肝包膜下肝实质表面,用于防治肝内肿瘤。依据是,有文献证实腹腔内移植的同位素标记CIK细胞可迁移到肝、肠、胃、肺等脏器,而且在这些脏器的分布比值高于通过静脉途径的分布比值[1,11]。提示CIK细胞可穿过生物膜、组织细胞间隙而迁移。本研究将DC-CIK注于肝实质表面,使效应细胞直接与肝细胞接触。根据肝脏丰富的血供和免疫效应细胞的迁移特性,使移植的效应细胞生长并进入肝内血循环。
小鼠或人的肝包膜由较厚的纤维性内层(Glisson包膜)和浆膜外层(腹膜)构成,内层包膜完整包裹整个肝脏,而浆膜层则覆盖除肝裸区、肝门、胆囊附近外的肝脏。由于这两层结构,肝包膜比其他腹腔脏器包膜更厚实,也较易剥离。肝包膜与肝实质之间有潜在腔隙,外伤时可容纳大量血液、体液。作者曾报道将胶原溶液注入肝包膜下变成胶原凝胶,使肝包膜和肝实质之间形成一人工囊腔,由此将大鼠自体骨髓干细胞注入肝包膜下,用于治疗大鼠肝功能损伤[4]。提示肝包膜下环境接近于肝内环境。本实验将空心纤维垫置于肝包膜下,在肝包膜和肝实质表面间形成人工囊腔。将腹壁切口两边肌层缝接于皮下组织,使肝包膜(人工囊腔)贴近皮下(可在裸鼠腹部隆起处触及),便于经皮向肝包膜下注射(可借助B超引导),使DCCIK细胞直达肝实质表面,并沿着肝包膜下间隙扩散到大部分肝实质表面,从而使更多DC-CIK细胞进入肝组织。本研究输注于肝包膜下的DC-CIK细胞,可明显抑制脾内原发瘤生长,且抑制瘤细胞向肝转移。提示输注于肝包膜下的DC-CIK已进入肝内和脾脏并发挥抑瘤作用。本研究A组肝包膜下输注的DC-CIK理论上可全部进入肝脏,然后再分布到其他脏器。而C组尾静脉输注的DC-CIK仅约1/6分布于肝脏[1]。故推测A组肝内DC-CIK细胞密度应远高于C组,使A组肝转移瘤数量明显少于C组。由于脾脏与肝脏邻近,血供也密切相关,故A组脾内DC-CIK密度也会高于C组,使A组脾内原发瘤体积也明显小于C组。人工囊腔中纤维垫所用的聚丙烯为生物惰性材料,对组织刺激性小。也可用生物可降解材料制成纤维垫,或用可注射凝胶(如胶原溶液)经腹腔镜注入肝包膜下形成人工囊腔。
目前认为DC是功能最强的抗原提呈细胞。GMCSF是维持DC生长和分化的基本细胞因子。IL-4可促使单核细胞转化为成熟DC。本研究在DC成熟过程中,用SW480肿瘤细胞冻融抗原冲击致敏,致敏成熟DC可将肿瘤细胞抗原提呈给CIK,帮助CIK通过黏附因子LFA/ICAM-1与肿瘤细胞特异结合,引发细胞毒和免疫调理功能(本实验所用的CIK中CD3+/CD56+细胞为36.4%,大于20%的成熟标准)。CIK同时表达CD3+/CD8+,提示CIK具有NK细胞和T细胞的标志,兼有这两种细胞杀瘤活性。
总之,本实验提示肝包膜下输注DC-CIK细胞对肝脏创伤较小,且不易使肿瘤细胞扩散,并可使DCCIK浓集于肝脏。但多次注射易损伤肝包膜,可预将一硅化管道插入人工囊腔,管道外端与埋于皮下的注射接头接通,使用时经皮通过皮下接头和管道向人工囊腔注射[12]。有关方面有待进一步研究。
[1] 李慧,岳欣,安秀梅,等.不同输注途径对CIK细胞体内分布和抑瘤作用的影响[J].免疫学杂志,2007,23(4):416-420.
[2] 脱帅,张宁苏,张宁.树突状细胞联合细胞因子诱导的杀伤细胞对原发性小肠恶性黑色素瘤生长及肝转移的抑制作用[J].中华消化外科杂志,2010,9(6):426-429.
[3] 匡志鹏,吴继宁,罗小玲,等.I L-2基因转染的CIK细胞联合DC对肝癌细胞的杀伤作用[J].中国癌症防治杂志,2009,1(1):10-13.
[4] 徐兵,吴林岚,杨晓梅,等.B型超声引导下肝包膜下骨髓间充质干细胞移植治疗大鼠肝损伤[J].肝脏,2014,19(8):604-606.
[5] 李雄兵,刘汉锋,蔡正文,等.卡介苗联合DC-CIK细胞对裸鼠结肠癌生长及肝转移的抑制作用[J].广西医学,2014,36(4):424-427.
[6] 吕海燕,王瑶,黄建华,等.树突状细胞瘤内注射联合放疗对小鼠肾癌细胞因子的影响[J].实验动物科学,2008,25(6):1-5.
[7] C an d i do K A,S h i m i zu K,M cL au g h l i n J C,et a l.Loc a l a dm i n i st r a t i o n of de n d ri t i c cells i nh i b i ts est a bl i s h ed b r e a st t u mo r gr owt h:i mpl i c a t i o n s fo r a poptos i s-i n d u c i n g a g e n ts[J].C an ce r R es,2001,61(1):228-236.
[8] 贾中芝,田丰,王凯,等.医源性肿瘤腹壁种植转移五例分析[J].介入放射学杂志,2012,21(11):942-944.
[9] 马莹,白萍.医源性肿瘤种植[J].中国肿瘤临床,2008,35(2):117-119.
[10] Si lv a M A,H e g a b B,H yde C,et a l.N eedle t r a ck seed i n g follow i n g b i opsy of l i ve r les i o n s i n t h e d i a g n os i s of h ep a tocell u l a r c an ce r:a system a t i c r ev i ew an dmet a-ana lys i s[J].G u t,2008,57(11):1592-1596.
[11]艾军,白引苗,张超,等.CIK细胞的生物学特性及荷瘤鼠体内分布特点研究[J].中国免疫学杂志,2010,26(7):606-610.
[12]徐兵,吴林岚,黄素钦,等.穿刺植入细管注射阿霉素脂质体治疗大鼠脑胶质瘤的初步研究[J].中国癌症防治杂志,2015,7(2):90-93.
[2015-01-15收稿][2015-05-03修回][编辑 江德吉]
Prelim inary analysis of the effects of injecting DC-CIK cells into the liver subcapsule to suppressgrow th of primary sp leen tumorsand metastatic liver tumors in a nu-mousemodel
XU Bing1,WU Linlan2,HUANG Suqing1,YANG Xiaomei3,WU Kaimu2(1Institute of Liver Diseases,Mengchao Hepatobiliary Hospital of Fujian Medical University,Fuzhou 350025,P.R.China;2The Second People′s Hospital of Fujian Province;3Fuzhou Jing-hua Chonghui Hospital,Fuzhou 350001,P.R.China)
Xu Bing.E-mail:xubing1228@163.com
Objective To develop amethod for injecting immune cells that target the liver and suppress tumor growth there.M ethod A hollow fiber pad was placed into the liver subcapsule of nu-mice bearing SW480 tumors,leading to cyst formation in the subcapsule.Dendritic cells(DCs)and cytokine-induced killer cells(CIKs)were induced from human peripheral blood monocytes.The ability of CIKs to inhibit SW480 cell proliferation wasmeasured.DCs were loaded with antigens from SW480 cells,and co-cultured with CIKs.DC-CIK co-cultureswere injected into the subcapsule cyst or into the caudal vein(6×107cells in 0.3mL),while the same volume of saline was injected into the cyst or caudal vein in control groups.Each group received injections twice a week for 4 weeks.At 48 h after the last injection,growth inhibition of the primary tumors in spleen and mean numbers ofmetastic tumors in liver were determined.Results Mixing CIKs and SW480 cells in the ratio of 60:1 inhibited SW480 proliferation by(75.3±8.42)%.CD3/CD56 were expressed on(36.4±13.2)%of CIK cells.Tumor inhibition was 32.07%in the animals injected in the cyst and 16.54%in the animals injected in the caudal vein(P<0.05);mean numbers ofmetastic liver tumorswere 2.47±1.02 in the group injected in the cyst and 5.05±1.06 in the group injected in the caudal vein(P<0.01).Conclusion Injecting DC-CIKs into nu-micemay significantly inhibit the growth of primary tumors in spleen and metastic tumors in liver,and the effects are greater when the cells are injected into the liver subcapsule than into the caudal vein.
Liver neoplasm;Splenic neoplasm;Cytokine-induced killer cell;Dendritic cell;Subcapsule;Nudemouse
R735.7,733.2
A
1674-5671(2015)04-05
10.3969/j.issn.1674-5671.2015.04.03
徐兵。E-mail:xubing1228@163.com

