猪脑微血管内细胞的原代分离培养与鉴定
赵春雨,孔志伟,张天芮,杨文艳,杨连玉
(1.吉林农业大学动物科技学院,吉林长春130118;2.吉林省动物营养与饲料科学重点实验室,吉林长春130118;3.中国科学院亚热带农业生态研究所,湖南长沙410125)
猪脑微血管内细胞的原代分离培养与鉴定
赵春雨1,2,孔志伟3,张天芮1,2,杨文艳1,2,杨连玉1,2
(1.吉林农业大学动物科技学院,吉林长春130118;2.吉林省动物营养与饲料科学重点实验室,吉林长春130118;3.中国科学院亚热带农业生态研究所,湖南长沙410125)
探讨获取纯度较高的原代猪脑微血管内皮细胞的分离和培养方法。采用1月龄的三元杂交猪,通过两次酶消化、BSA和Percoll非连续梯度离心获得较纯的脑微血管段后,接种于涂布有鼠尾胶的培养瓶进行原代培养;相差显微镜观察细胞并进行纯化和传代,采用Ⅷ因子相关抗原免疫荧光检测法对培养的细胞进行鉴定。结果表明,培养24 h即可见细胞从贴壁的脑微血管段周围爬出,细胞呈短梭形,集落呈典型的“鹅卵石样”,区域性单层生长,6~7 d内皮细胞开始融合,血管内皮细胞特异性标志物Ⅷ因子相关抗原表达阳性。说明本试验成功的培养出了纯度较高的脑微血管内皮细胞,为后续的体外血脑屏障模型的建立奠定了基础。
猪;脑微血管内皮细胞;分离培养;免疫荧光
脑微血管内皮细胞(Brain Microvascular Endo⁃thelial Cells,BMECs)是构成血脑屏障的主要成分,具有特殊的形态结构和功能[1-2]。新近研究发现,脑微血管内皮细胞不仅具有重要的屏障保护和半透膜的营养运送作用,同时能分泌一些信号分子,这些信号分子在组织、细胞的生长发育中具有重要作用[3-5]。由于原代分离的BMECs保留了在体环境下较多的特点,因此,体外培养的BMECs已被广泛用于血脑屏障(Blood Brain Barri⁃er,BBB)功能研究、药物筛选以及脑血管疾病研究等领域。
本研究利用两次酶解法和非连续梯度离心法自仔猪脑皮质分离BMECs,然后在涂布鼠尾胶的培养瓶中进行体外培养,得到较高纯度和产量的BMECs,为进一步研究BMECs的生物学行为和功能提供有用的方法。
1 材料与方法
1.1 试验动物试验采用1月龄左右的仔猪,购自吉林省天惠牧业有限公司。
1.2 主要试剂鼠尾胶BD(Biosciences,USA),Ⅱ型胶原酶、Triton X-100和DNA酶I(DNaseI),购自Sigma公司;DMEM(高糖),购自Gibco公司;胎牛血清(FBS),购自PAA公司;碱性成纤维细胞生长因子(bFGF)和表皮生长因子(EGF),购自Pe⁃protech公司;牛血清白蛋白(BSA)和胶原酶/分散酶(collagenase/dispase),购自Roche公司;Percoll原液,购自Pharmacia公司;Hepes,购自广州博理生物科技有限公司;肝素钠,购自上海虹光化工厂;Ⅷ因子兔抗体,购自DakoCytomation公司;TRITC标记的羊抗兔抗体,购自上海沪峰化工有限公司;GFAP兔抗体,购自Sino Biological Inc公司;FITC标记的羊抗兔抗体,购自百浩生物科技有限公司。
1.3 主要试剂的配制非连续梯度Percoll液配制参照梁朝峰方法[6]。
1.4 培养瓶和培养皿的处理接种前4 h,加入鼠尾胶浓度为6~10mg/cm2,在密闭的器皿里用氨气熏5~10min后,置于室温1~2 h晾干后,用D-Hank′s液漂洗2次。
1.5 脑微血管段的分离与脑微血管内皮细胞原代培养仔猪前腔静脉放血致死后,取下头颅,浸泡于75%乙醇中消毒3~5min,然后放入操净台中紫外照射3~5min,后打开颅腔取出大脑,将大脑半球在干滤纸上缓慢滚动以吸除软脑膜及脑膜大血管,置于含冷D-Hank′s液玻璃培养皿中,用细解剖镊去除大脑白质、残余大血管和软脑膜,保留大脑皮质,用D-Hank′s液漂洗3~5次后,加入1mL DMEM培养液,用虹膜剪将其剪碎成1mm3大小,加入少许D-Hank′s液冲洗,匀浆,将匀浆液通过200目滤网,用D-Hank′s液洗脱并收集滤网上的成分,1 500 r/min(4℃)离心5min,弃上清。将沉淀加入配制好的20%BSA溶液中混匀后4 000 r/min(4℃)离心20 min,离心后可见离心物分为3层,去除中上层神经组织及大血管,保留底部黄褐色沉淀。为了增加微血管的数量,可将离心后的中上层组织二次离心,取底部沉淀后,与第一次沉淀混合再进行1次密度梯度离心后弃上清。将取得的最终沉淀物PBS洗1次,1 500 r/min(4℃)离心5 min,加入2 mL 0.1%Ⅱ型胶原酶(内含20μmol/mL D-NaseI)悬浮混匀后,37℃水浴震荡消化30 min后,1 500 r/min(4℃)离心5min。沉淀加入2mLDMEM培养液,悬浮后铺于配制好的非连续梯度的Percoll液的离心管中,1 500 r/min(4℃)离心25 min,位于最底层的为红细胞层,其上富含微血管内皮细胞的微血管段的黄白色层主要位于中间界面内。
吸出纯化的微血管段,用DMEM培养液漂洗二次,1 500 r/min(室温)离心5min,去上清液,加入DMEM完全培养液,吹打均匀后接种于包被鼠尾胶的培养瓶和培养皿中,置于37℃、5%CO2培养箱内静置培养,16 h后吸出未黏附的细胞杂质及陈旧培养液,换新鲜培养液,随后每2~3 d换液。
1.6 脑微血管内皮细胞的鉴定
1.6.1 细胞形态观察将培养有原代和传代细胞的培养瓶置于倒置显微镜下观察其形态,观测其生长规律。
1.6.2 内皮细胞的第Ⅷ因子相关抗原免疫荧光鉴定鉴定方法参考Hoyer等的方法[7],稍作改动。具体方法为:取已纯化好的细胞,消化传代接种于放有细胞培养专用盖玻片的6孔培养板中,待细胞生长至80%~90%汇合状态时,取出培养板,弃掉培养基,用37℃预热的PBS漂洗3 min/次-1×3次;向培养孔内加入95%乙醇,加入量以覆盖住细胞培养层即可,-20℃固定45min;PBS漂洗5min/次-1×3次;滴加兔抗鼠第Ⅷ因子相关抗原抗血清(1∶100稀释,阴性对照不加),37℃孵育60min;PBS漂洗5min/次-1×3次;滴加FITC标记的羊抗兔IgG(1∶100稀释)37℃孵育45min;PBS漂洗3 min/次-1×3次,然后用去离子水洗涤1次;甘油封片,并用洁净盖玻片覆盖细胞层,于荧光显微镜下观察并拍照记录(显微镜预热2 h)。
1.6.3 MTT法测定脑微血管内皮细胞生长曲线
将细胞按1×104/mL密度同时接种于10块96孔板,每孔接种200μL,共设8个平行孔,每天收集1块96孔板,将培养液吸去,每孔加入无血清的200μLM199,20μL MTT继续培养4 h,2 000 r/min离心5min,弃上清,每孔加入200μL DMSO溶解紫色结晶,振荡10 min,用自动酶标仪测定在570 nm波长处的吸光度值(A),可间接反映活细胞数量,并做生长曲线。
2 结果
2.1 形态学观察结果接种当时可见串珠状的微血管段,或者是单支状和多支状的微血管段。培养16 h后,绝大部分细胞已经完成贴壁,24 h后,组织碎片或者微血管段周围有细胞长出(图1),呈短梭型,3 d后可见细胞大量增殖(图2),5 d后细胞单层区域性生长(图3),7 d后细胞基本上达到融合(图4)。融合的细胞呈典型的“铺路石状”。

图1 细胞少量迁出
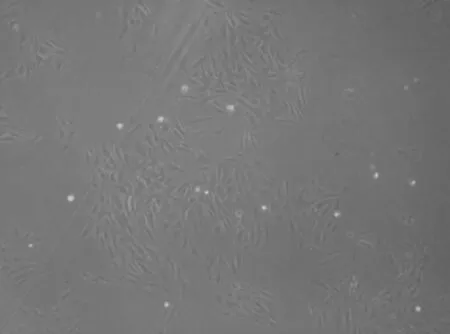
图2 细胞大量增殖

图3 细胞单层区域生长

图4 细胞汇合成片
2.2 第Ⅷ因子相关抗原免疫荧光鉴定内皮细胞的结果第Ⅷ因子相关抗原染色为阳性,细胞核空染,而细胞质呈现出黄绿色荧光,细胞核与细胞质之间具有明显的界限(图5)。由此可见,本研究所采用的方法成功培养出BMECs。

图5 细胞Ⅷ因子抗体鉴定结果(A)×200,(B)×400
2.3 MTT法测定脑微血管内皮细胞生长曲线用MTT法测定脑微血管内皮细胞的生长状况,发现在第4天时达到对数生长期,第7天时达到生长高峰期,第8天时进入平台期。

图6 脑微血管内皮细胞的生长曲线
3 讨论
BMECs的培养始于20世纪70年代末,其培养的关键在于脑微血管段的分离,主要表现在分离步骤较为繁杂[8]。本试验主要是为了探索一种更好的分离培养猪脑微血管内皮细胞的方法,为建立一种良好的体外血脑屏障模型奠定基础。
脑微血管内皮细胞的的分离培养已经有很多报道。大部分都是运用的新生的大鼠脑皮质[6,9-11]或者是人脐静脉[13-16]作为材料。也有用猪[17]作为试验材料的,但是分离培养出高纯度、高产量的微血管内皮细胞(BMECs)仍然面临许多困难。
猪BMECs的分离,不仅会因为软脑膜、脑膜大血管等去除不净而受到神经细胞和成纤维细胞的污染,而且也会因日龄的差异而受到影响。本试验参考国内外文献[17-20],并进行一些改进。主要概括如下:(1)取材选用1月龄大小的仔猪在低温下尽量去除软脑膜、大血管及大脑白质,收集大脑皮质;(2)由于BMECs娇嫰易损,分离细胞时采用两次酶消化法代替传统的组织匀浆法,避免组织匀浆对内皮细胞的机械性损伤,以利于提高细胞的活力;(3)由于采用酶消化法,分离的内皮细胞常被成纤维细胞等污染,为了去除更多的杂细胞,我们根据Percoll细胞分离液不同浓度对应不同比重值的细胞,用非连续梯度的Percoll分离液进行分离,从而得到纯度更高的微血管段;(4)为提高原代培养的BMECs贴壁速度,在原代培养的培养瓶尚涂布鼠尾胶等基质能促进脑微血管段的贴壁和内皮细胞的生长,从而提高了传代的BMECs的纯度;(5)选择合适的种植密度。我们发现种植的微血管片断密度在20条/cm2以上效果较好;(6)为促进内皮细胞的增殖并抑制杂细胞的生长,我们采用含有bFGF,EGF,以及20% FBS血清的高糖培养液,以促进内皮细胞的生长,同时添加100mg/L肝素钠协同bFGF的作用可抑制平滑肌细胞的生长。
本试验在传统培养方法基础上进行了改进,培养出了纯度较高的脑微血管内皮细胞,可以为后续的与星形胶质细胞培养建立体外血脑屏障模型服务,更好的模拟体内的环境,进一步为筛选促生长的天然生物活性物质提供简便快捷的方法。
[1]Ross lerK.Expression of leukocyte adhesion molecules at the hu⁃man blood-brain barrier(BBB)[J].JNeuro sci Res,1992,31:365-374.
[2]Chi O Z,Wei N M,Sin ha A K,et al.Effects of inhibition of ni⁃tric oxide synthase on blood-brain barrier transport in focal cere⁃bral ischemia[J].Pharmacoloy,1994,48:367-373.
[3]Chi JT,Chang H Y,Haraldsen C,et al.Endothelial cell diversity revealed by global expression profiling[J].PNAS,2003,100(19):10623-10628.
[4]Bahary N,Zon L I.Endothelium-chicken soupfor the endoderm[J].Science,2001,294(5542):530-531.
[5]Wurmser A E,Palmer TD,Gage FH.Cellular interactions in the stem cell niche[J].Science,2004,304(5675):1253-1255.
[6]梁朝峰,郭英,石德金,等.大鼠脑皮质微血管内皮细胞的分离和培养[J].中国病理生理杂志,2008,24(5):1038-1040.
[7]Hoyer LW,de los Santos R P,Hoyer JR.Antihemophilic factor antigen.Localization in endothelial cells by immurofluorescentmi⁃croscopy[J].JClin Invest,1973,52:2737-2744.
[8]Spatz M,Bembry J,Dodson R F,et al.Endothelial cell cultures derived from isolated cerebral icrovessels[J].Brain Res,1980,191(2):577-582.
[9]许熊飞,李润平,李泉,等.大鼠脑微血管内皮细胞的分离与原代培养[J].细胞生物学杂志,2005,27:84-88.
[10]张磊,胡格,张涛,等.大鼠脑皮质微血管内皮细胞的分离培养及鉴定[J].畜牧与兽医,2008,40(10):70-73.
[11]智屹惠,黎杏群,罗云,等.大鼠脑微血管内皮细胞的体外培养方法[J].中国现代医学杂志,2004,14(5):24-28.
[12]钱志远,黄强,周丽英,等.鼠脑微血管内皮细胞的分离与长期培养[J].细胞生物学杂志,1999,12(1):42-46.
[13]徐燕,訾自强,苏琦华,等.人脐静脉内皮细胞的分离培养与鉴定[J].天津医科大学学报,2000,6(4):374.
[14]王立岩,佟晓红,宫桂兰,等.人脐静脉内皮细胞的体外培养、鉴定及形态学观察[J].白求恩医科大学学报,2000,26(1):28.
[15]秦明春,王若光,秦莉花,等.人脐静脉内皮细胞的体外分离培养及鉴定[J].湖南中医药大学学报,2007,27(4):12-15.
[16]莫薇,王颖智,刘鷖雯,等.原代人脐静脉内皮细胞分离和培养方法的改进[J].热带医学杂志,2007,11(7):737-739.
[17]Bobilya D J,Amour K D,Palmer A,etal.Isolation and cultivation of porcine brain capillary endothelial cells as an in vitromodel of the blood-brain barrier[J].Methods Cell Sci,17(1995):25-32.
[18]Ge S,Pachter J.Isolation and culture ofmicrovascular endothelial cells from murine spinal cord[J].JNeuroimmunol,2006,177(1):209-214.
[19]Wu Z,Hofman FM,Zlokovic B V.A simplemethod for isolation and characterization ofmouse brain microvascular endothelial cells[J].J NeurosciMethods,2003,130(1):53-63.
[20]Parkinson F E,Hacking C.Pericyte abundance affects sucrose permeability in cultures of ratbrainmicrovascular endothelial cells[J].Brain Res,2005,1049(1):8-14.
Primary Isolation,Culture and Idendtification of Pig CerebralM icrovascular Endothelial Cells
ZHAOChun-yu1,2,KONG Zhi-wei3,ZHANG Tian-rui1,2,YANGWen-yan1,2,YANG Lian-yu1,2
(1.College of Animal Science and Technology.Jilin Agriculatural University.Changchun 130118,China;2.Key Laboratory of,Animal Nutrition and Feed science of Jilin Province,Changchun 130118,China;3.Key Laboratory of Processes of Agro-eco-system,Institute of Subtropical Agriculture,the Chinese Academy of Sciences,Changsha 410125,China)
This study was designed to developan isolation and culturemethod to get higher purity of pig brainmicrovascular endothelial cells(BMEC).After relatively pure cerebralmicrovessel fragmentswere obtained from 1month old Landrace by careful dissection,and two steps of enzyme digestions and gradient centrifugation with BSA and Percoll were performed,the fragments were seeded on dishes coated with rattail collagen.PBMECwere identified according to themorphology of the cultured cells and im⁃munocytochemistry of factor VIII-associated antigen.We found that the cultured cells began tomigrate from microvessel fragments after 24 hours cells showed the spindle-shapedmorphology and looked like"slabstone",ar typical appearance of cultured endotheli⁃al cells under inverted microscope and reached themonolayer confluence after 6~7 days.Our cultured cells had factor VIII-asso⁃ciated antigen.The results indicated that relatively pure primary culture of PBMEC was successfully established.
Pig;BMEC;Isolation and culture Corresponding author:YANG Lian-yu
S858.28
A
0529-6005(2015)12-0023-04
2014-07-15
国家自然科学基金青年科学基金(31302002);吉林省教育厅项目(201252)
赵春雨(1989-),男,硕士生,从事动物营养与饲料科学研究,E-mail:chunyu198911@163.com
杨连玉,E-mail:yangly2004@126.com

