下调miR-21对PDCD4表达及结肠癌HT-29细胞功能的影响研究
辽宁省肿瘤医院大肠外科,辽宁 沈阳 110042
下调miR-21对PDCD4表达及结肠癌HT-29细胞功能的影响研究
任宇鹏,宋纯,张昊
辽宁省肿瘤医院大肠外科,辽宁 沈阳 110042
背景与目的:miR-21可能通过抑制PDCD4表达调控结肠癌浸润及转移等恶性行为。本研究通过下调miR-21表达后,检测结肠癌HT-29细胞功能的变化,并观察PDCD4在蛋白及mRNA表达水平的改变,探讨miR-21及PDCD4的表达在结肠癌恶性行为中的关系及机制。方法:构建靶向miR-21的干扰质粒simiR-21,转染HT-29细胞后,以实时定量PCR(qRT-PCR)法检测转染效率,MTT法检测转染后细胞增殖变化,流式细胞术检测转染后细胞调亡变化,Transwell检测迁移及浸润能力改变,蛋白质印迹法(Western blot)及qRT-PCR法检测干扰后PDCD4表达水平变化。结果:经qRT-PCR检测simiR-21在HT-29细胞转染效率为60%~65%,转染效率佳;MTT显示转染后72、96和120 h,HT-29增殖能力减弱(t=1.276,P<0.05;t=3.276,P<0.01;t=4.523,P<0.01);流式细胞术结果显示,与si-negative control及miR-21组对比转染后HT-29调亡率明显增加(t=2.132,P<0.05;t=3.524,P<0.05);Transwell结果显示,simiR-21转染细胞迁移能力降低(t=2.423,P<0.05;t=3.153,P<0.05),侵袭能力降低(t=3.245,P<0.05;t=5.236,P<0.05);Western blot检测结果显示,PDCD4蛋白在simiR-21细胞的表达水平明显上调(t=2.342,P<0.05;t=4.215,P<0.05);qRT-PCR检测结果显示,PDCD4 mRNA在simiR-21细胞的表达水平明显上调(t=2.261,P<0.05;t=3.492,P<0.05)。结论:simiR-21下调miR-21表达后,结肠癌HT-29细胞增殖能力受抑制,并促进其调亡,抑制迁移及浸润能力,PDCD4上调。miR-21可能通过下调PDCD4表达促进肿瘤细胞恶性行为,可作为结肠癌治疗新的靶向候选基因。
结肠癌;增殖;调亡;miR-21;HT-29
结肠癌发病率高,在恶性肿瘤中的发病率呈现逐年快速上升趋势,在发达国家及发展中国家更为明显,发病越来越年轻化,在我国位居消化道恶性肿瘤致死率的第4位[1]。结肠癌的发生、发展是多基因参与的过程。miR-21是miRNAs家族成员之一,在胃癌、食管癌、卵巢癌及乳腺癌等多种肿瘤中高表达[2],miR-21高表达与结肠癌TNM分期、淋巴结转移、凋亡、迁移及浸润等恶性行为具有正相关性[3],但是对其分子生物学的研究相对较少。有研究认为,miR-21通过下调抑癌基因程序性死亡因子4(programmed cell death 4,PDCD4)的表达促进恶性肿瘤细胞的迁移及浸润等恶性行为。PDCD4可能是miR-21直接和功能的靶分子[4]。本研究采用小干扰RNA(small interfering RNA,siRNA)对结肠癌HT-29细胞株中miR-21基因表达进行干扰下调,旨在观察miR-21基因表达在结肠癌细胞增殖及调亡中所起的作用,为进一步研究其功能及基因治疗靶点提供试验依据。
1 材料和方法
1.1 材料
HT-29细胞株购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库,所有细胞采用贴壁细胞法培养、传代及保留,取对数生长期细胞进行试验。MTT试剂盒购自美国Sigma公司,miRNA isolation提取分离试剂盒、RPMI-1640、LipofectamineTM2000及TRIzol购自美国Invitrogen公司,All-in-OneTMqPCR Mix试剂盒购自美国GeneCopoeia公司,Annexin V-FITC/PI试剂盒购自南京凯基生物科技发展有限公司。兔抗人PDCD4单克隆抗体购自北京中杉金桥生物制品有限公司。引物由上海吉玛制药技术有限公司设计并合成,simiR-21及si-negative control均由上海吉玛制药技术有限公司合成。simiR-21上游引物:5’-GATCCAUCUTCGAAGUGACTT-3’,下游引物:5’-UGCUCUTUGACGUAUGGAGTT-3’;sinegative control上游引物:5’-UUCACCGUACGU CUCACCUGT-3’,下游引物:5’-ACUGGAACC UCUCGCGGAATT-3’;PDCD4上游引物:5’-CAGTCGCATCTCGGTATCA-3’,下游引物:5’-CCGGCCGTGATGAGCGTA-3’。
1.2 研究方法
1.2.1 simiR-21及si-negative control转染HT-29细胞
将对数生长期细胞分为3组:miR-21组、simiR-21组及si-negative control组。对simiR-21组及si-negative control组对24 h内细胞融合达到70%~90%的细胞株依照LipofectamineTM2000试剂说明书进行转染,转染48 h后按照miRNA isolation提取及分离试剂盒说明书提取miRNA进行总RNA完整性检测,应用紫外线分光光度仪进行RNA溶解吸光度(A)值检测(介于260~280 nm处比值),计算RNA浓度及纯度,比值为1.8~2.1者用于进一步实验,采用实时定量PCR(qRT-PCR)对转染后HT-29中miR-21 mRNA表达与miR-21组及si-negative control组进行对比分析,检测转染效率。
1.2.2 qRT-PCR测定转染效率及转染后PDCD4水平
按照TRIzol试剂盒说明书步骤进行提取纯化各细胞株总RNA;所有RNA样本浓度均稀释至1 g/L,根据逆转录-扩增试剂盒说明书进行逆转录及扩增。RT-PCR反应体系(2×All-in-One qPCR Mix 10 μL,引物正义链1 μL,50×Syber Green 2 μL,cDNA 2 μL,引物反义链1 μL,ddH2O 4 μL),反应的条件:95 ℃预变性10 min;95 ℃变性10 s、60 ℃退火20 s、72 ℃延伸10 s,共30个循环。所有反应均设立复孔,并以DEPC水代替模板,cDNA作为阴性对照,GAPDH为内参照。反应结束后进行溶解曲线分析。
1.2.3 MTT(methyl-thiazolyl-tetrazolium)法检测转染后HT-29细胞增殖
取各组细胞,按MTT试剂盒说明操作,以5×103细胞/孔密度于96孔细胞培养板内进行接种,设3个复孔,培养24、48、72、96及120 h后,每孔加5 mg/mL MTT 2μL,继续温育4 h,弃去上清液,加入DMSO 150 μL,振荡溶解结晶,比色选择570 nm波长,在酶联免疫检测仪上测定各孔A值,重复3次试验。
1.2.4 流式细胞仪检测转染后HT-29细胞调亡
转染48 h后,取各组细胞,按照Annexin V-FITC/PI试剂盒说明书进行操作,上流式细胞仪,Alexa FITC最大激发波长为488 nm,最大发射波长为509 nm,PI-DNA复合物最大激发波长为535 nm,最大发射波长为615 nm,用Cell Quest进行分析。Alexa FITC为X轴,PI为Y轴,每个样本采集10 000例,可将早期调亡细胞、晚期调亡细胞及继发坏死细胞区分开,计算出阳性细胞百分比,重复3次试验。
1.2.5 细胞迁移能力检测
按TranswellRPolycarbonate Membrane Inserts试剂盒的操作步骤试验,检测转染前、后HT-29细胞迁移能力的变化。在显微镜下取8个不同的视野(×100)进行计数,重复3次,计算每次迁移细胞减少百分比。
1.2.6 细胞侵袭能力检测
按BioCoat Matrigel invasion chamber试剂盒说明书进行试验,显微镜下取8个不同的视野(×100)进行计数,重复3次,计算侵袭细胞减少的百分比。
1.2.7 蛋白质印迹法(Western blot)检测simiR-21转染后PDCD4在蛋白水平表达
按说明书提取HT-29总蛋白,BCA定量试剂盒测蛋白浓度,样本均定量为5 g/L,每条泳道上样10 μg 蛋白,采用12%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,70 V 80 min电转移至PVDF膜。5%脱脂奶粉封闭2 h,加入一抗,4 ℃温育过夜。TBST洗膜,加入二抗室温温育1.5 h,TBST清洗后ECL发光,凝胶显像仪显像。
1.3 统计学处理
采用PASW Statistics 18.0软件进行作图及统计分析,计量资料采用±s表示,率的比较采用χ2检验,qRT-PCR结果采用GraphPad Prism 6.0进行ONE WAY ANOVA分析及作图,P<0.05为差异有统计学意义。
2 结 果
2.1 qRT-PCR检测转染效率
2.1.1 总RNA浓度测定
用DEPC水调零后,取1.5 μL样本在ND-1000全波长紫外/可见光扫描分光光度计测样台上进行测量,记录A260/A280值及浓度,结果显示,总RNA样本A260/A280值为1.8~2.0,RNA纯度较高,无DNA、蛋白质等污染,浓度在100~1 458.2 μg/μL。
2.1.2 总RNA完整性检测
取RNA样本1 μL,1%琼脂凝胶电泳80 V 20 min,EB染色10 min,用凝胶成像系统观察并拍照。结果显示,总RNA 5sRNA、18sRNA及28sRNA条带完整,总RNA抽取比较完整(图1)。

图1 总RNA完整性检测Fig. 1 Detecting the integrity of total RNA
2.1.3 qRT-PCR检测转染效率
qRT-PCR检测结果显示,simiR-21转染后与si-negative control组及miR-21组对比,HT-29细胞miR-21在mRNA水平表达量明显降低(t=2.542,P<0.05),干扰效果明显,沉默效率为60%~65%(图2)。

图2 qRT-PCR检测转染后miR-21在mRNA水平表达Fig. 2 miR-21 mRNA expression detecting by qRT-PCR
2.2 simiR-21转染后PDCD4在mRNA水平及蛋白水平的表达
Western blot检测结果显示,在52×103处有灰色调带显示,PDCD4蛋白在simiR-21细胞的表达量明显高于miR-21细胞及si-negative control细胞(t=2.342,P<0.05;t=4.215,P<0.05,图3A);qRT-PCR结果显示,PDCD4 mRNA在simiR-21细胞的表达水平明显高于miR-21细胞及si-negative control细胞(t=2.261,P<0.05;t=3.492,P<0.05,图3B)。
2.3 MTT检测simiR-21干扰后HT-29细胞的增殖改变
通过采集0、24、48、72、96、120 h时间点的数据,simiR-21、miR-21与si-negative control细胞增殖率,72 h分别为:(41.7±14.6)%、(59.3±6.3)%、(58.3±3.2)%;96 h分别为:(43.6±15.4)%、(77.2±8.2)%、(78.5±7.3)%;120 h分别为:(49.6±16.4)%、(81.9±4.6)%、(85.2±3.8)%。simiR-21干扰后HT-29细胞增殖能力受到抑制,在72、96及120 h差异均具有统计学意义(t=1.276,P<0.05;t=3.276,P<0.01;t=4.523,P<0.01,图4)。
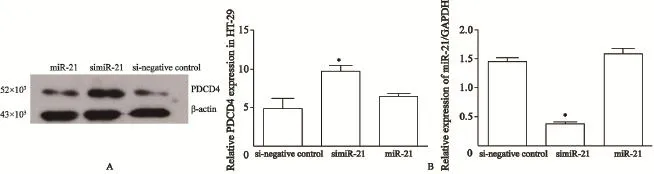
图3 simiR-21转染前、后PDCD4在蛋白水平(A)及mRNA水平的变化(B)Fig. 3 PDCD4 expression at protein level (A) and mRNA level(B) after simiR-21 transfection

图4 MTT检测转染后HT-29细胞增殖Fig. 4 HT-29 proliferation after transfection detecting by MTT
2.4 流式细胞仪检测simiR-21干扰后HT-29细胞调亡改变
simiR-21、miR-21与si-negative control各组细胞凋亡率分别为32.74%、10.16%及14.98%,simiR-21与si-negative control及miR-21组对比,HT-29细胞调亡率增高,差异有统计学意义(t=2.132,P<0.05;t=3.524,P<0.05,图5)。
2.5 simiR-21转染后细胞迁移能力检测
Transwell结果显示,simiR-21转染细胞与si-negative control转染细胞及miR-21细胞迁移减少百分比对比,明显降低HT-29细胞的迁移能力(t=2.423,P<0.05;t=3.153,P<0.05,图6A)。
2.6 simiR-21转染后细胞侵袭能力检测
与si-negative control及miR-21组对比,HT-29细胞的侵袭能力在simiR-21转染后明显降低(t=3.245,P<0.05;t=5.236,P<0.05,图6B)。

图5 流式细胞仪检测转染后HT-29细胞调亡Fig. 5 HT-29 apoptosis after transfection detected si-negative control by flowcytometry
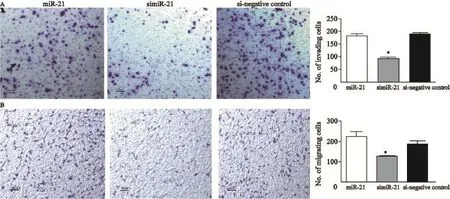
图6 转染后迁移及侵袭检测Fig. 6 Migration and invasion after transfection
3 讨 论
结肠癌至发现时瘤体一般较大,因此多以贫血或急性肠梗阻为首发症状,首诊时肿瘤已发展较晚,也是较容易被忽略的肿瘤之一[5]。对于结肠癌恶性生长行为的研究一直是热点,微小RNAs(miRNAs)是一类内源性小片段的非编码RNA的调控因子,长度21个核苷酸左右,定位于17p23.2染色体,由72nt茎环样结构前体剪切加工成熟的具有自主转录单位的miRNA组成,其在肿瘤发展中的作用为癌基因或抑癌基因样作用[6]。miR-21是miRNAs家族成员之一,在胃癌、乳腺癌及卵巢癌等肿瘤中高表达,并作为肺癌判断预后的标志物[7-8]。
miR-21在结肠癌细胞中的研究目前报道较少[4]。有研究认为,miR-21过表达会下调PDCD4表达,PDCD4是抑癌基因,PDCD4蛋白在细胞凋亡所需新生大分子复合物之一,在细胞凋亡中增量调节。PDCD4及miR-21在胃癌及乳腺癌中具有相关性。
本研究采用siRNA技术成功构建simiR-21,并转染结肠癌HT-29细胞,经qRT-PCR证明沉默效率达到60%以上,siRNA干扰技术在肿瘤细胞功能研究方面是成熟、便捷、有效及低成本的[9-10]。MTT显示,miR-21下调表达72 h以后,HT-29细胞增殖能力明显下降,在96及120 h时,simiR-21对HT-29细胞增殖的抑制更为明显,与未下调组相比,差异具有统计学意义,miR-21基因编码的蛋白产物可以造成DNA受损,促进细胞周期停滞于G1期,具有重要的促癌功能[11]。有研究显示,miR-21基因高表达的结直肠癌中,紧密连接蛋白(ZO-1)及上皮钙黏蛋白(E-cad)表达降低、神经钙黏蛋白(N-cad)及转录因子Slug的表达升高,第10号染色体上同源缺失性磷酸酶-张力蛋白(PTEN)表达量显著降低、磷酸化蛋白激酶B(p-Akt)表达升高,提示miR-21对人结直肠癌细胞EMT的发生有促进作用,并诱发细胞迁移和侵袭,其机制可能与下调PTEN蛋白表达、激活PI3K/Akt通路,从而促进EMT有关[12-13]。PTEN是PI3K/Akt信号通路中重要靶基因之一,miR-21可能通过下调PDCA4表达,从而抑制PTEN信号传递实现对结肠癌恶性行为的调控。
本研究显示,通过流式细胞仪检测,simiR-21干扰后,HT-29细胞株凋亡率明显升高,并以早期凋亡为主,miR-21高表达可能抑制肿瘤细胞凋亡,对其基因进行敲除后结肠癌细胞凋亡增加。miR-21高表达会下调PDCD4表达,通过PI3K/Akt信号通路抑制结肠癌细胞凋亡,PDCD4高表达会加速结肠癌细胞凋亡,miR-21基因敲除后PDCD4表达上调,说明miR-21对PDCD4表达具有调控作用。miR-21通过与靶基因3’端非翻译区的不完全配对抑制靶基因mRNA的翻译或降解,从而参与细胞分化、增殖、发育、凋亡及代谢等生物过程[14]。遗传或表观遗传改变、miRNA加工相关基因及相关蛋白异常变化是miRNA表达异常的主要原因[15]。遗传改变是指染色体的异常,大部分miR-21位于脆性位点,因此,常常与癌变相关[16]。miR-21可能通过抑制人10号染色体缺失磷酸酶或PTEN、PDCD4及TPMI等抑癌基因作用而促进肿瘤发生、发展,因此miR-21可能具有原癌基因的作用[17]。一部分肿瘤中的miR-21具有诱导细胞凋亡,抑制细胞转移及浸润的作用,在不同肿瘤中,miR-21可能扮演着抑癌基因及促癌基因的双重作用。miR-21下调后,PDCD4明显上调,PDCD4可能接受miR-21作用,如果miR-21高表达,PDCD4表达水平下降,癌细胞迁移及浸润能力提高[18]。
与miR-21促进结肠癌细胞增殖,抑制其凋亡相关的基因及通道蛋白有抑制或促进细胞分裂、增殖、迁移及凋亡等功能[19]。本研究显示,通过对miR-21基因的敲除,对结肠癌细胞的恶性行为具有抑制作用,这种抑制作用可能是由于对PDCD4表达水平的上调而引起的,miR-21可以作为结肠癌诊断及预后分析的标志物,也可能成为治疗的靶点[20-21]。
[1] WANG Z, CAI Q, JIANG Z, et al. Prognostic role of MicroRNA-21 in gastric cancer: a meta-analysis [J]. Med Sci Monit, 2014, 18(20): 1668-1674.
[2] 周克兵, 谷刚. 下调miR-21表达抑制鼻咽癌CNE2细胞增殖和侵袭[J]. 中国癌症杂志, 2013, 23(11): 863-867.
[3] 熊兵红, 马利, 程勇, 等. 抑制miR-21表达对结肠癌HCT116细胞生物学行为的影响[J]. 中国肿瘤生物治疗杂志, 2014, 21(1): 40-54.
[4] PEACOCK O, LEE A C, CAMERON F, et al. Inflammation and miR-21 pathways functionally interact to downregulate PDCD4 in colorectal cancer[J]. 2014, 13, 9(10): e110267.
[5] MENG X R, LU P, MEI J Z, et al. Expression analysis of miRNA and target mRNAs in esophageal cancer[J]. Braz J Med Biol Res, 2014, 47(9): 811-817.
[6] YU Y, KANWAR S S, PATEL B B, et al. MicroRNA-21 induces stemness by downregulating transforming growth factor beta receptor 2 (TGFβR2) in colon cancer cells[J]. Carcinogenesis, 2012, 33(1): 68-76.
[7] REN Q, LIANG J, WEI J, et al. Epithelial and stromal expression of miRNAs during prostate cancer progression[J]. Am J Transl Res, 2014, 6(4): 329-339.
[8] 潘文征, 唐万燕, 袁伟, 等. 微小RNA在胰腺癌患者血浆中的表达情况及临床意义[J]. 中华肿瘤杂志, 2014, 36(5): 351-354.
[9] FALTEJSKOVA P, BESSE A, SEVCIKOVA S, et al. Clinical correlations of miR-21 expression in colorectal cancer patients and effects of its inhibition on DLD1 colon cancer cells[J]. Int J Colorectal Dis, 2012, 27(11): 1401-1408.
[10] YE T T, YANG Y L, LIU X Y, et al. Prognostic value of circulating microRNA-21 in digestive system cancers: a meta-analysis[J]. Int J Clin Exp Med, 2014, 7(4): 873-878.
[11] XIONG B, CHENG Y, MA L, et al. miR-21 regulates biological behavior through the PTEN/PI-3 K/Akt signalingpathway in human colorectal cancer cells[J]. Int J Oncol, 2013, 42(1): 219-228.
[12] SHRESTHA S, HSU S D, HUANG W Y, et al. A systematic review of microRNA expression profiling studies in human gastric cancer[J]. Cancer Med, 2014, 3(4): 878-888.
[13] DENG J, LEI W, FU J C, et al. Targeting miR-21 enhances the sensitivity of human colon cancer HT-29 cells to chemoradiotherapy in vitro[J]. Biochem Biophys Res Commun, 2014, 443(3): 789-795.
[14] CHEN J, WANG X. MicroRNA-21 in breast cancer: diagnostic and prognostic potential[J]. Clin Transl Oncol, 2014, 16(3): 225-233.
[15] NIELSEN B S, JØRGENSEN S, FOG J U, et al. High levels of microRNA-21 in the stroma of colorectal cancers predict short disease-free survival in stage Ⅱ colon cancer patients[J]. Clin Exp Metastasis, 2011, 28(1): 27-38.
[16] 徐登诚, 刘宝瑞, 沈洁. 胃癌组织和循环miR-21与胃癌伊立替康敏感性关系的初步研究[J]. 中国癌症杂志, 2013, 23(9): 744-750.
[17] LI X, HUANG K, YU J. Inhibition of microRNA-21 upregulates the expression of programmed cell death 4 and phosphatase tensin homologue in the A431 squamous cell carcinoma cell line[J]. Oncol Lett, 2014, 8(1): 203-207.
[18] LIN P L, WU D W, HUANG C C, et al. MicroRNA-21 promotes tumour malignancy via increased nuclear translocation of β-catenin and predicts poor outcome in APC-mutated but not in APC-wild-type colorectal cancer[J]. Carcinogenesis, 2014, 35(10): 2175-2182.
[19] 赵文健, 杨亮, 唐伟军. miR-216a通过靶向调控蛋白激酶Cα抑制胶质瘤细胞增殖和侵袭[J]. 中国癌症杂志, 2013, 23(6): 420-424.
[20] FERRARO A, KONTOS CK, BONI T, et al. Epigenetic regulation of miR-21 in colorectal cancer: ITGB4 as a novel miR-21 target and a three-gene network (miR-21-ITGΒ4-PDCD4) as predictor of metastatic tumor potential[J]. Epigenetics, 2014, 9(1): 129-141.
[21] BAE S, SHIM S H, PARK C W, et al. Combined omics analysis identifies transmembrane 4 L6 family member 1 as a surface protein marker specific to human mesenchymal stem cells[J]. Stem Cells Dev, 2011, 20(2): 197-203.
[22] SAXENA A, TAMMALI R, RAMANA K V, et al. Aldose reductase inhibition prevents colon cancer growth by restoring phosphatase and tensin homolog through modulation of miR-21 and FOXO3a[J]. Antioxid Redox Signal, 2013, 18(11): 1249-1262.
Silencing of miR-21 influences the function of colon cancer cell line HT-29 and the expression of PDCD4
REN Yupeng, SONG Chun, ZHANG Hao (Department of Colorectal Surgery, Liaoning Cancer Hospital and Institute, Shenyang Liaoning 110042, China)
REN Yupeng E-mail: pangheshangmomo@163.com
Background and purpose:PDCD4 may be inhibited by miR-21 to regulate the malignant behaviors of colon cancer such as invasion and migration. This study aimed to explore the function of colon cancer HT-29 cell lines by downregulating miR-21 expression and discuss the mechanisms and relationship between miR-21 and PDCD4 in colon cancer malignant behaviors.Methods:simiR-21 was transfected into colon cancer cell line HT-29 to downregulate the expression of miR-21. Proliferation, apoptosis, migration and invasion were detected by MTT, flow cytometry and Transwell assay after transfection. PDCD4 expression was detected by Western blot and qRTPCR.Results:The qRT-PCR analysis result proved that the transfection efficiency was 60%-65%. MTT analysis result showed that the proliferations of HT-29 cells were inhibited after the transfection of miR-21 for 72, 96, 120 h (t=1.276, P<0.05; t=3.276, P<0.01; t=4.523, P<0.01). Comparing with si-negative control and miR-21 groups, flow cytometry result showed that the apoptosis rate was increased after miR-21 expression downregulated (t=2.132, P<0.05; t=3.524, P<0.05). Transwell assay result showed that migration (t=2.423, P<0.05; t=3.153, P<0.05) and invasion(t=3.245, P<0.05; t=5.236, P<0.05) were inhibited; Western blot result showed that PDCD4 expression was up-regulated at protein level(t=2.342, P<0.05; t=4.215, P<0.05); qRT-PCR result showed that PDCD4 expression was up-regulated at mRNA level(t=2.261, P<0.05; t=3.492, P<0.05).Conclusion:The proliferation, migration and invasion are the inhibited, and apoptosis is attenuated after miR-21 downregulated by simiR-21 transfection, PDCD4 expression is up-regulated. miR-21 may enhance the malignant behavior of cancer cells by downregulating the PDCD4 expression, miR-21 might be a target gene for colon cancer therapy.
Colon cancer; Proliferation; Apoptosis; miR-21; HT-29
10.3969/j.issn.1007-3969.2015.01.002
R735.53+
A
1007-3639(2015)01-0006-07
2014-10-07
2014-11-25)
任宇鹏 E-mail:pangheshangmomo@163.com

