白头翁皂苷B4、粉防己碱对奥沙利铂耐药的结肠癌细胞的耐药逆转作用及其机制
南京市中医院肿瘤科, 江苏 南京 210001
白头翁皂苷B4、粉防己碱对奥沙利铂耐药的结肠癌细胞的耐药逆转作用及其机制
李敏,方明治
南京市中医院肿瘤科, 江苏 南京 210001
背景与目的:奥沙利铂(oraliplatin,L-OHP)是结直肠癌最常用的化疗药物之一,但临床上常见结直肠癌L-OHP化疗耐药。本研究旨在探讨中药单体白头翁皂苷B4(anemoside B4,AB4)以及粉防己碱(Tetrandrine,Tet)对人结肠癌L-OHP耐药细胞LoVo/L-OHP耐药的逆转作用,并初步研究其机制。方法:采用浓度梯度实验筛选无毒剂量的AB4、Tet,无毒剂量的AB4、Tet作用于LoVo/L-OHP细胞48 h后,检测LoVo/ L-OHP细胞对L-OHP耐药的变化,检测处理后细胞凋亡、细胞周期变化情况,通过RT-PCR及Western blot检测相关基因P-gp、zDHHC9和SMAD4的mRNA及蛋白的表达水平。结果:AB4及Tet作用48 h后对LoVo/L-OHP细胞的5%抑制率浓度分别为0.71及0.45 µg/mL,以此作为无毒剂量。L-OHP对LoVo/L-OHP细胞IC50为(112.5±23.6) µg/mL,分别加入0.71 µg/mL AB4及0.45 µg/mL Tet后,L-OHP对LoVo/L-OHP细胞的IC50值分别为 (62.8±21.4)及(58.9±26.3) µg/mL,IC50值均显著下降(P值均<0.05)。细胞周期检测发现,AB4及Tet处理后G1期细胞略有减少,S期细胞略有增加,但差异无统计学意义(P>0.05)。细胞凋亡检测发现AB4及Tet处理后凋亡率略有上升,但差异均无统计学意义(P>0.05)。RT-PCR检测显示耐药细胞相对于亲本细胞,P-gp及zDHHC9基因表达升高,SMAD4表达降低(P值均<0.05),经过AB4处理后,耐药细胞P-gp基因表达下降。Western blot检测相关蛋白水平后发现,耐药细胞经过AB4处理后,P-gp蛋白表达下降,经过Tet处理后zDHHC9蛋白表达下调。结论:AB4及Tet能逆转LoVo/L-OHP耐药细胞对L-OHP的耐药,AB4逆转机制可能与降低P-gp表达有关,Tet逆转机制与降低zDHHC9表达水平有关。
结直肠癌;化疗耐药;奥沙利铂;白头翁皂苷B4;粉防己碱
结直肠癌为最常见的恶性肿瘤之一。目前发病率逐年上升,化疗是晚期结直肠癌患者最为重要的治疗手段,但化疗耐药是导致治疗失败的重要原因,如何逆转耐药,提高疗效,延长生存期是近年来研究的热点。中药及其提取物具有丰富的资源,从中寻找逆转化疗耐药的小分子逆转剂是一个比较有前景的研究方向,该研究通过筛选发现白头翁皂苷B4(anemoside B4,AB4)及粉防己碱(tetrandrine,Tet)对于奥沙利铂(oxaliplatin,L-OHP)耐药的结直肠癌具有一定耐药逆转作用。
1 材料和方法
1.1 实验材料
AB4、Tet购自浙江玛雅试剂有限公司。TRIzol溶液、cDNA合成试剂盒为美国Invitrogen公司产品。细胞周期检测试剂盒、Hoechst33258试剂盒,P-gp、SMAD4抗体以及二抗均购自南京凯基生物科技发展有限公司。zDHHC9抗体购自美国Sigma公司。RT-PCR扩增试剂盒购自宝生物工程(大连)有限公司,RTPCR引物均由南京凯基生物公司合成。DMEM培养液购自美国Gibco公司,小牛血清购自兰州民海生物工程有限公司,DMSO购自上海久亿化学试剂有限公司,L-OHP购自恒瑞医药股份有限公司,噻唑蓝(MTT)购自美国Sigma公司,Gel DocTM XR凝胶成像系统购自美国BIO-RAD公司产品。
1.2 LoVo/L-OHP细胞的培养及其药物处理
人结肠癌耐药细胞株LoVo/L-OHP在前期研究的基础上继续诱导而成[1]。完全培养基为90%DMEM+10%小牛血清,于37 ℃、CO2体积分数为5%、饱和湿度的培养箱中培养。每2~3 d换液1次,用0.25%胰蛋白酶常规消化传代,取对数生长期细胞实验。细胞消化、计数、配制成浓度为5×104个/mL的细胞悬液,置于96孔细胞培养板中,每孔加入100 μL细胞悬液;将96孔细胞培养板置于37 ℃、CO2体积分数为5%的培养箱中培养24 h;弃去培养基,PBS清洗2次,用完全培养基将AB4、Tet倍比稀释至浓度为4、2、1、0.5、0.25和0.125 µg/mL,每孔加入200 μL相应的含药培养基,同时设立阴性对照组和阳性对照组;将96孔细胞培养板置于37 ℃、CO2体积分数为5%的培养箱中培养48 h;将96孔细胞培养板进行MTT染色,测定490 nm处吸光度(A)值,计算抑制率,绘制浓度-抑制率曲线,采用SPSS 16.0软件计算AB4及Tet作用48 h后对LoVo/L-OHP 5%抑制率的浓度,作为逆转耐药的无毒剂量。无毒剂量AB4、Tet分别与不同浓度的L-OHP作用LoVo/ L-OHP 48 h后,SPSS 16.0软件计算出AB4、Tet处理后L-OHP对LoVo/L-OHP的IC50值,并与L-OHP对未使用AB4、Tet处理的LoVo/L-OHP的IC50值进行比较,计算耐药逆转倍数,逆转倍数=未逆转IC50值/逆转后IC50值。
1.3 Hoechst33258染色检测细胞凋亡
细胞爬片后,自然晾干细胞样本,浸入4%多聚甲醛固定液中过夜,加入适当量Hoechst 33258染色液,充分覆盖住待染色的细胞,室温放置10 min。PBS浸泡5 min,清洗3次。用抗荧光淬灭封片液封片,封片后置于荧光显微镜下观察。
1.4 PI单染法检测细胞周期
将对数生长期的细胞消化接种到6孔细胞培养板中,细胞贴壁后,根据组别设置加入相应的含药培养基,同时设立阴性对照组,药物作用48 h后,用0.25%胰酶(不含EDTA)消化收集细胞;制备的单细胞悬液用体积分数为70%乙醇固定2 h,4 ℃保存;加100 μL RNase A 37 ℃水浴30 min;再加入400 μL PI染色混匀,4 ℃避光30 min;上机检测,记录激发波长488 nm 处红色荧光。
1.5 RT-PCR检测用药前、后耐药基因的mRNA表达情况
采用TRIzol试剂提取总RNA,测定总R N A浓度和纯度,按照试剂盒步骤进行cDNA合成(20 μL体系),对反转录好的cDNA稀释至5倍后,进行PCR检测。在冰上依次加入如下组份:10×Taq缓冲度5 μL ,MgCl2(25 mmol/L)4 μL,dNTPs(10 mmol/L)1 μL,引物顺义链(10 μmol/L)1 μL,引物反义链(10 μmol/L)1 μL,cDNA 1 μL,Taq DNA聚合酶0.5 μL,灭菌双蒸水至总体积50 μL。PCR程序:95 ℃预变性5 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸45 s;共32个循环;72 ℃终延伸10 min;上述产物立即进行琼脂糖凝胶电泳,在凝胶成像系统中观察。各基因引物如下:GAPDH(内参)顺义链:5’-AAGGTCGGAGTCAACGGATTT-3’,反义链:5’-AGATGATGACCCTTTTGGCTC-3’;P-gp正义链:5’-TCGTAGGAGTGTCCGTGG AT-3’,反义链:5’-CATTGGCGAGCCTGG TAG-3’;SMAD4正义链:5’-TTTGCTCCCTT CGTTAT-3’,反义链:5’-GATGGATTCT GCCTTTAC-3’;zDHHC9正义链:5’-GTCTTC GCCTTCAACATCGT -3’,反义链:5’-AATCCA GTCAGTCCCACGAC-3’。
1.6 Western blot检测蛋白表达
将细胞用胰酶消化后,冰预冷裂解缓冲液充分裂解。采用BCA检测各组样本的蛋白浓度。然后采用10% SDS-PAGE胶进行电泳,待目的条带进入凝胶最佳分离区(大约为凝胶的2/3)时,停止电泳。进行转膜90 min, 转膜结束后,取出NC膜并作好标记,加入含5%脱脂奶粉的封闭液,摇床振荡2 h进行封闭。TBST洗膜后放入含一抗(GAPDH 1:1 000;SMAD4 1∶1 000;zDHHC9 1∶400;P-gp 1∶250)的平皿中,4 ℃摇床振荡温育过夜。第2天取出,用5%脱脂奶粉封闭液稀释二抗(1:5 000),室温摇床振荡反应2 h。将ECL化学发光试剂盒中的A、B两种液体按1:1等体积混合,配制成工作液。将NC膜上滴加适量工作液,用保鲜膜覆盖,置于显影夹内,关闭显影夹,使胶片显影和定影。
1.7 统计学处理
2 结 果
2.1 AB4、Tet对LoVo/L-OHP细胞的抑制作用
将AB4、Tet倍比稀释至4、2、1、0.5、0.25和0.125 µg/mL,分别作用于LoVo/L-OHP细胞,图1可见细胞抑制率随浓度降低而逐渐下降,抑制作用与浓度呈正相关性。采用SPSS 16.0软件计算出AB4及Tet作用48 h后对LoVo/L-OHP细胞的5%抑制率浓度分别为0.71及0.45 µg/mL,采用该浓度作为逆转耐药实验的无毒剂量。

图1 AB4、Tet对LoVo/L-OHP细胞的抑制作用Fig. 1 The inhibitory effect of AB4 and Tet on the cell proliferation of LoVo/L-OHP
2.2 AB4、Tet对LoVo/L-OHP耐药逆转作用
L-O H P对L o Vo/L-O H P细胞I C50为(112.5±23.6) µg/mL,分别加入无毒剂量的AB4 (0.71 µg/mL)以及Tet (0.45 µg/mL)后,L-OHP对LoVo/L-OHP细胞的IC50值分别为(62.8±21.4)及(58.9±26.3)µg/mL,IC50值均明显下降(P值均<0.05),逆转耐药倍数分别为1.79及1.91。表明AB4、Tet对LoVo/L-OHP均具有一定的耐药逆转作用。
2.3 AB4、Tet对LoVo/L-OHP细胞周期的影响
将LoVo/L-OHP不加药物干预细胞作为对照,细胞周期检测发现,AB4及Tet处理后G1期细胞略有减少,S期细胞略有增加,但差异无统计学意义(P>0.05,图2、表1)。
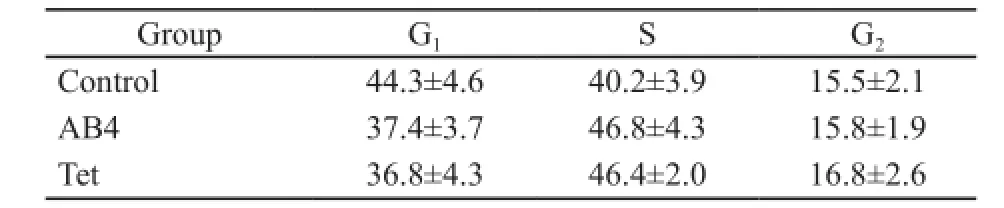
表1 AB4、Tet对LoVo/L-OHP细胞周期的影响Tab. 1 The effect of AB4 and Tet on cell cycle of LoVo/L-OHP (%)
2.4 AB4、Tet对LoVo/L-OHP细胞凋亡的影响
将LoVo/L-OHP不加药物干预细胞作为对照,细胞凋亡检测发现,AB4及Tet处理后细胞凋亡率略有增加[(5.73±0.41)% v s (6.3 9±0.8 2)%,(5.7 3±0.4 1)% v s (6.82±0.90)%],但差异均无统计学意义(P>0.05,图3)。
2.5 AB4、Tet对LoVo/L-OHP相关基因mRNA水平表达的影响
从图4中可以看出,耐药细胞相对于亲本细胞,P-gp mRNA及zDHHC9 mRNA表达升高(P<0.05),SMAD4表达降低(P<0.05);AB4处理耐药细胞后,P-gp mRNA表达显著下降(P<0.05),zDHHC9 mRNA以及SMAD4 mRNA表达无显著变化;Tet对耐药细胞的P-gp mRNA、zDHHC9 mRNA以及SMAD4 mRNA表达均无显著影响。
2.6 AB4、Tet用药后对LoVo/L-OHP相关蛋白水平表达的影响
通过Western blot检测相关蛋白表达水平发现,LoVo/L-OHP耐药细胞的P-gp及zDHHC9蛋白表达水平上升(P<0.05),SMAD4蛋白表达水平下降(P<0.05);LoVo/L-OHP耐药细胞经过AB4处理后,P-gp蛋白表达下降(图5)。

图2 AB4、Tet对LoVo/L-OHP细胞周期的影响Fig. 2 The effect of AB4 and Tet on cell cycle of LoVo/L-OHP cells
图3 AB4、Tet对LoVo/L-OHP细胞凋亡的影响Fig. 3 The effect of AB4 and Tet on cell apoptosis of LoVo/L-OHP cells

图4 AB4、Tet用药后对LoVo/L-OHP相关基因mRNA表达的影响Fig. 4 The effect of AB4 and Tet on mRNA levels of the genes in LoVo/L-OHP cells

图5 AB4、Tet用药后对LoVo/L-OHP相关蛋白表达的影响Fig. 5 The effect of AB4 and Tet on protein level of the genes in LoVo/L-OHP cells
zDHHC9及SMAD4蛋白表达均无显著变化;LoVo/L-OHP耐药细胞经过Tet处理后,zDHHC9蛋白表达下降,P-gp和 SMAD4蛋白表达均无显著变化。
3 讨 论
结直肠癌是人类主要恶性肿瘤之一,其全球发病率和死亡率分别位于第3位和第4位,每年有120万新确诊的患者,并且有超过60万例患者死于结直肠癌[2]。化疗是结直肠癌重要的治疗手段,但出现化疗耐药是化疗失败的主要原因。结直肠癌化疗耐药现象非常普遍[3],但结直肠癌化疗耐药的机制很复杂,He等[4]通过研究发现整合素alphaⅤ与结肠癌细胞HT-29耐药有关,而下调整合素alphaⅤ的表达可降低HT-29对L-OHP的耐药性。Ebert等[5]研究发现TFAP2E基因高甲基化与结直肠癌化疗耐药相关,TFAP2E基因导致的耐药性通过DKK4介导。Zhou等[6]报道miR-203通过抑制ATM激酶导致结直肠癌细胞L-OHP耐药。有研究者通过长时间L-OHP诱导产生2种结直肠癌细胞株HT-29R和 Colo320R,通过基因芯片分析,2组耐药机制完全不一样[7],说明不同患者耐药情况亦有个体差异。本研究通过预实验筛选了部分中药单体的逆转结肠癌耐药细胞L-OHP耐药的作用,发现中药单体AB4及Tet具有一定的逆转耐药作用。AB4是中药白头翁的主要成分,AB4能够调控肝癌细胞周期,阻滞G2/M期更替,诱导细胞凋亡[8]。Tet是从粉防己中提取的一种双苄基异喹啉生物碱,文献报道[9-10]Tet能够通过调控caspase通路诱导细胞凋亡。也有文献研究证实Tet具有一定的逆转化疗多药耐药作用,其机制与抑制耐药蛋白P-gp的表达有关[11]。本研究结果显示,L-OHP对LoVo/ L-OHP细胞IC50为(112.5±23.6) µg/mL,分别加入无毒剂量的AB4以及Tet后,L-OHP对LoVo/L-OHP细胞的IC50值分别为(62.8±21.4)及(58.9±26.3)µg/mL,IC50值均明显下降(P值均<0.05),逆转耐药倍数分别为1.79及1.91,表明AB4、Tet对LoVo/L-OHP均具有一定的耐药逆转作用。通过细胞凋亡及细胞周期检测,无毒剂量的AB4以及Tet处理后G1期细胞略有减少,S期细胞略有增加,AB4及Tet处理后凋亡率略有上升,但差异无统计学意义。相关耐药基因参与是耐药发生的重要原因,P-gp是最为常见的一种耐药蛋白,它是位于细胞膜的ATP依赖性膜转运蛋白,可将肿瘤细胞内的药物主动泵出细胞外,从而导致细胞内化疗药物的有效浓度下降,使肿瘤细胞产生耐药性[12]。隋华等[13-14]研究采用慢病毒过表达COX-2可介导P-gp的表达从而导致人结肠癌细胞产生多药耐药,另外该作者还通过阻断PI3K/Akt信号通路激活后,发现P-gp的表达水平明显下降,L-OHP对HCT-116/L-OHP敏感性明显上升,故认为COX-2以及PI3K/Akt信号通路的激活也通过介导P-gp而参与了结肠癌化疗耐药。本研究中耐药细胞的P-gp表达水平上调,AB4处理后,表达下降。zDHHC9是Ras基因的激活酶,能调控Ras基因的功能,在结直肠癌细胞中高表达[15]。SMAD4是一种抑癌基因,参与TGF-β信号转导途径,与肿瘤的发生、发展以及侵袭转移密切相关[16-17]。同时也是结直肠癌重要的预后预测分子[18]。最新的研究发现,SMAD4也与结直肠癌的化疗耐药具有相关性,SMAD4缺失的结直肠癌患者通过激活Akt信号通路导致对以5-FU为基础的治疗耐药[19]。通过查询文献发现,在肿瘤组织中,SMAD4异常可能导致P-gp过表达[20],另外通过Oncomine数据库分析数据发现,在耐药结肠癌细胞中P-gp、zDHHC9表达升高,SMAD4下降,且zDHHC9与SMAD4呈负相关。因此,考虑L-OHP耐药与其可能有关,本研究发现耐药细胞株zDHHC9表达明显上调,而SMAD4表达水平下调,经过Tet处理后发现zDHHC9表达下调,SMAD4表达差异无统计学意义,以上可能为逆转耐药的部分机制。
综上所述,AB4及Tet能逆转LoVo/L-OHP耐药细胞对L-OHP的耐药,AB4逆转机制可能与降低P-gp表达有关,Tet逆转机制与降低zDHHC9的表达水平有关。但是有研究发现,不同结直肠癌患者发生L-OHP耐药的机制可能不一样。因此,针对不同耐药细胞筛选个体化用药是下一步的研究方向。
[1] 李敏, 方明治. 结肠癌耐药细胞株LoVo/L-OHP的建立及其耐药机制[J]. 现代肿瘤医学, 2011, 19(10): 1943-1946.
[2] BRENNER H, KLOOR M, POX C P. Colorectal cancer[J]. Lancet, 2014, 383(9927): 1490-1502.
[3] DAHAN L, SADOK A, FORMENTO J L, et al. Modulation of cellular redox state underlies antagonism between oxaliplatin and cetuximab in human colorectal cancer cell lines[J]. Br J Pharmacol, 2009, 158(2): 610-620.
[4] HE J M, WANG F C, QI H B, et al. Down-regulation of alphaⅤ integrin by retroviral delivery of small interfering RNA reduces multicellular resistance of HT29[J]. Cancer Lett, 2009, 284(2): 182-188.
[5] EBERT M P, TÄNZER M, BALLUFF B, et al. TFAP2EDKK4 and chemoresistance in colorectal cancer[J]. N Engl J Med, 2012, 366(1): 44-53.
[6] ZHOU Y, WAN G, SPIZZO R, et al. miR-203 induces oxaliplatin resistance in colorectal cancer cells by negatively regulating ATM kinase[J]. Mol Oncol, 2014, 8(1): 83-92.
[7] VIRAG P, FISCHER-FODOR E, PERDE-SCHREPLER M, et al. Oxaliplatin induces different cellular and molecular chemoresistance patterns in colorectal cancer cell lines of identical origins[J]. BMC Genomics, 2013, 14(1): 480.
[8] 王海侠, 郑新勇, 郜尽, 等. 白头翁皂苷B4体外抑制人肝癌细胞HepG2增殖并诱导其凋亡[J]. 上海交通大学学报(医学版), 2011, 31(10): 1481-1485.
[9] LIANG C Z, LIU B, TAO Y, et al. Tetrandrine induces apoptosis and triggers a caspase cascade in U2-OS and MG-63 cells through the intrinsic and extrinsic pathways[J]. Mol Med Rep, 2014, 9(1): 345-349.
[10] QIN R, SHEN H, CAO Y, et al. Tetrandrine induces mitochondria-mediated apoptosis in human gastric cancer BGC-823 cells[J]. PLoS One, 2013, 8(10): e76486.
[11] SUN Y F, WINK M. Tetrandrine and fangchinoline, bisbenzylisoquinoline alkaloids from Stephania tetrandra can reverse multidrug resistance by inhibiting P-glycoprotein activity in multidrug resistant human cancer cells[J]. Phytomedicine, 2014, 21(8-9): 1110-1119.
[12] CALATOZZOLO C, GELATI M, CIUSANI E, et al. Expression of drug resistance proteins Pgp, MRP1, MRP3, MRP5 and GST-pi in human glioma[J]. J Neurooncol, 2005, 74(2):113-121.
[13] 隋华, 周利红, 刘宣, 等. COX-2介导MDR1/P-gp调控人结肠癌细胞多药耐药的研究[J]. 中国癌症杂志, 2011, 21(4): 241-246.
[14] 隋华, 付晓伶, 潘树芳, 等. PI3K/Akt/NF-κB通路调控ABCB1/P-gp介导的人结肠癌细胞多药耐药的研究[J].中国癌症杂志, 2014, (2): 106-111.
[15] YOUNG E, ZHENG Z Y, WILKINS A D, et al. Regulation of Ras localization and cell transformation by evolutionarily conserved palmitoyl transferases[J]. Mol Cell Biol, 2014, 34(3): 374-385.
[16] FREEMAN T J, SMITH J J, CHEN X, et al. SMAD4-mediated signaling inhibits intestinal neoplasia by inhibiting expression of β-catenin[J]. Gastroenterology, 2012, 142(3): 562-571.
[17] PARK J W, JANG S H, PARK D M, et al. Cooperativity of E-cadherin and Smad4 loss to promote diffuse-type gastric adenocarcinoma and metastasis [J]. Mol Cancer Res, 2014, 12(8): 1088-1099.
[18] ISAKSSON-METTÄVAINIO M, PALMQVIST R, DAHLIN A M, et al. High SMAD4 levels appear in microsatellite instability and hypermethylated colon cancers, and indicate a better prognosis[J]. Int J Cancer, 2012, 131(4): 779-788.
[19] ZHANG B, ZHANG B, CHEN X, et al. Loss of SMAD4 in colorectal cancer induces resistance to 5-fluorouracil through activating Akt pathway[J]. Br J Cancer, 2014, 18, 110(4): 946-957.
[20] 李小荣, 张翼, 杨开焰, 等. TGF-β1及Smad4、VEGF在大肠癌组织中的表达及预后[J]. 实用预防医学, 2008, 15(6): 1730-1732.
Resistance reverse effect of anemoside B4 and tetrandrine on oxaliplatin-resistant human colon cancer cells and the mechanism
LI Min, FANG Mingzhi (Department of Oncology, Nanjing Hospital of Traditional Chinese Medicine, Nanjing Jiangsu 210001, China)
FANG Mingzhi E-mail: fangmingzhi@medmail.com.cn
Background and purpose:Oxaliplatin (L-OHP) is one of the most commonly used chemotherapy drugs in colorectal cancer and L-OHP-resistance is very common in colorectal cancer therapy. This research was to discuss the reversal effect in L-OHP-resistant human colon cancer cell line LoVo/L-OHP by anemoside B4 (AB4) and tetrandrine (Tet) and to clarify their molecular mechanism.Methods:LoVo/L-OHP cells were treated for 48 h by AB4 and Tet at different concentrations to get non-toxic dose. Drug sensitivity was measured by MTT. After the treatment, the cell cycle and apoptosis of the cells were detected. Expression of P-gp mRNA, zDHHC9 mRNA and SMAD4 mRNA were detected by RT-PCR. Expression of P-gp, zDHHC9 and SMAD4 protein were detected by Western blot.Results:The IC50of LoVo/L-OHP for L-OHP was (112.5±23.6) µg/mL, and the IC50decreased to (62.8±21.4) µg/mL (P<0.05) and (58.9±26.3) µg/mL (P<0.05) after the treatment with 0.71 µg/mL AB4 and 0.45 µg/mL Tet (non-toxic dose) separately. The cell cycle experiment showed that the cells in G1stage decreased and in S stage increased but with no statistical significance (P>0.05). The cell apoptosis experiment showed that the apoptotic rate increased after thetreatment with AB4 and Tet with non-toxic dose but with no statistical significance (P>0.05). The RT-PCR experiment showed that the expressions of P-gp mRNA and zDHHC9 mRNA were increased and SMAD4 mRNA was decreased in LoVo/L-OHP cells compared with in LoVo cells (P<0.05), while it was found that P-gp mRNA in LoVo/L-OHP cells was decreased after the treatment with AB4 at non-toxic dose (P<0.05). Western blot experiment showed the protein of P-gp in LoVo/L-OHP cells was decreased after treatment with AB4 (P<0.05), which was accordant to the PCR result. The expression of zDHHC9 protein in LoVo/L-OHP cells was decreased in LoVo/L-OHP cells after treatment with Tet (P<0.05).Conclusion:AB4 and Tet have some reversal effect on resistant to L-OHP in LoVo/L-OHP cells. The molecular mechanism of the resistance reverse effect was related to down-regulation of P-gp for AB4 and down-regulation of zDHHC9 for Tet.
Colorectal cancer; Chemo-resistance; Oxaliplatin; Anemoside B4; Tetrandrine
10.3969/j.issn.1007-3969.2015.01.007
R735.3
A
1007-3639(2015)01-0038-07
2014-09-10
2014-11-27)
南京市医学科技发展青年启动项目(QYK11135)。
方明治 E-mail:fangmingzhi@medmail.com.cn

