厄洛替尼二次治疗晚期非小细胞肺癌患者的临床分析
福建医科大学教学医院,福建省肿瘤医院内科,福建 福州 350014
厄洛替尼二次治疗晚期非小细胞肺癌患者的临床分析
吴标,黄诚,蒋侃,朱芳,郑晓彬,朱凯
福建医科大学教学医院,福建省肿瘤医院内科,福建 福州 350014
背景与目的:厄洛替尼治疗表皮生长因子受体突变的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者疗效显著,但几乎所有患者最终都会出现耐药而导致病情进展。本研究旨在评估二次使用厄洛替尼治疗晚期NSCLC患者的疗效及安全性。方法:回顾性分析了福建省肿瘤医院46例既往厄洛替尼治疗有临床获益的晚期NSCLC患者,经其它药物治疗失败后二次给予厄洛替尼150 mg口服,每日1次,持续用药直至肿瘤进展或出现不可耐受的不良反应,对其临床特点、治疗效果及生存情况进行分析。结果:厄洛替尼二次治疗的客观有效率为28.3%,疾病控制率为60.9%,症状改善率为45.7%,中位无进展生存期为3.6个月,中位总生存期为7.3个月,1年生存率为8.7%。厄洛替尼停用≥6个月的患者中位无进展生存期显著长于停用<6个月的患者(P=0.002)。ECOG评分0~2分患者中位总生存期显著长于ECOG评分>2分的患者(P=0.038)。最常见的不良反应为皮疹和腹泻。结论:初次使用厄洛替尼有临床获益的晚期NSCLC患者,二次使用厄洛替尼仍有可能延长患者的生存时间。
厄洛替尼;非小细胞肺癌;治疗
非小细胞肺癌(non-small cell lung cancer,NSCLC)是常见的恶性肿瘤,该病早期发现困难,多数确诊时已属中晚期,目前主要的治疗手段是全身化疗和分子靶向治疗[1]。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFRTKI)厄洛替尼对晚期EGFR基因突变的患者具有显著疗效[2]。但几乎所有患者最终都会出现肿瘤耐药而导致病情进展,对这部分患者给予二、三线化疗的有效率低,且经多程治疗,一般状况差,对化疗的耐受性也显著下降。目前研究认为对EGFR-TKI初始治疗有效的患者,再次使用EGFR-TKI治疗仍有一定的疗效,而且大多数患者对EGFR-TKI药物耐受良好[3]。我们回顾性分析了福建省肿瘤医院既往使用厄洛替尼治疗有临床获益的晚期NSCLC患者,经其它药物治疗失败后再次给予厄洛替尼治疗,对其临床特点、治疗效果及生存情况进行分析。
1 资料和方法
1.1 临床资料
回顾性分析了福建省肿瘤医院2012年6月—2014年5月既往给予厄洛替尼治疗有临床获益(包括完全缓解、部分缓解和疾病稳定3个月以上)的46例晚期NSCLC患者,经其它药物治疗失败后,二次给予厄洛替尼试验性治疗。所有患者均有细胞学或组织学证实为NSCLC并有完整的临床资料。其中男性25例,女性21例;年龄37~75岁,中位年龄61岁;ECOG评分0~2分39例,3~4分7例;病理类型腺癌36例,鳞癌9例,腺鳞癌1例;EGFR基因19外显子突变19例,21外显子突变10例,未检测17例;无吸烟史32例,有吸烟史14例;根据美国癌症研究联合会癌症分期手册(第七版)NSCLC分期标准[4]进行分期:ⅢB期8例,Ⅳ期38例。
1.2 治疗方法
口服厄洛替尼150 mg,每日1次,用药至肿瘤进展或患者出现不可耐受的不良反应。治疗期间定期检查血常规、肝肾功能及心电图情况,治疗后28 d进行肿瘤影像学检查以评价疗效,以后每1~2个月进行影像学检查评估患者肿瘤情况。
1.3 疗效评价标准
按照美国国立癌症研究所实体瘤疗效评价标准1.1版[5]对肿瘤客观缓解率进行评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progression disease,PD)。客观有效率(objective response rate,ORR)是指CR+PR患者占全组的百分率。疾病控制率(disease control rate,DCR)是指CR+PR+SD患者占全组的百分率。无进展生存期(progression free survival,PFS)是指患者从厄洛替尼二次治疗到疾病进展或死亡的时间。总生存期(overall survival,OS)是指患者从厄洛替尼二次治疗到死亡的时间。
1.4 不良反应评价标准
按照美国国立癌症研究所制定的毒性评价标准(common terminology criteria for adverse events, CTCAE)(第4版)[6]对不良反应进行评估分级。
1.5 统计学处理
采用SPSS 16.0统计软件对数据进行统计分析,应用χ2检验进行疗效和临床特征相关性分析。PFS和OS采用Kaplan-Meier法并进行Logrank检验。双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 初始厄洛替尼治疗的疗效
在初始厄洛替尼治疗有临床获益的46例患者中,PR 37例(80.4%),SD 9例(19.6%),中位PFS为9.9个月(95%CI:8.571~11.229个月)。
2.2 厄洛替尼二次治疗疗效及影响因素
在46例患者中,无CR患者,PR 13例(28.3%),SD 15例(32.6%),PD 18例(39.1%),ORR为28.3%,DCR为60.9%。χ2检验提示厄洛替尼停用≥6个月的患者再次给予厄洛替尼治疗的ORR和DCR均优于厄洛替尼停用<6个月的患者(χ2=4.290,P=0.038;χ2=5.998,P=0.014,表1)。46例患者给予厄洛替尼二次治疗,5例至随访结束时肿瘤情况仍稳定,其余41例患者中出现原发病灶进展16例(39.0%),肺内转移11例(26.8%),胸膜转移8例(19.5%),肝转移6例(14.6%),脑转移5例(12.2%)。
2.3 症状改善情况
在厄洛替尼二次治疗的46例患者中,21例(45.7%)有临床症状改善,表现为咳嗽、咳痰减轻,胸闷、气促好转,体质量增加和ECOG评分改善,症状改善中位时间为13 d。在13例PR患者中,11例(84.6%)症状有改善,在15例SD患者中,7例(46.7%)症状改善,在18例PD患者中,3例(16.7%)症状改善。χ2检验提示,PR+SD患者症状改善率与PD患者相比,差异有统计学意义(χ2=10.014,P=0.002),提示肺癌症状改善与肿瘤控制有关。

表1 46例NSCLC患者的临床特征与疗效的相关性分析Tab. 1 Analysis of the characteristics and response of 46 NSCLC patients
2.4 生存情况分析
本组中位PFS为3.6个月(95%CI:3.048~4.152个月,图1)。Log-rank检验单因素分析显示,厄洛替尼停用≥6个月的患者中位PFS为5.0个月(95%CI:2.274~7.726个月),厄洛替尼停用<6个月的患者中位PFS为3.0个月(95%CI:2.078~3.922个月),差异有统计学意义(χ2=9.935,P=0.002)。患者性别、年龄、ECOG评分、病理类型、吸烟和分期对中位PFS影响差异均无统计学意义(P均>0.05)。随访到2014年9月,有37例患者已死亡,中位OS为7.3个月(95%CI:6.006~8.594个月),1年生存率为8.7% (图2)。Log-rank检验单因素分析显示,ECOG评分0~2分患者中位OS为7.8个月(95%CI:5.988~9.612个月),ECOG评分>2分的患者中位OS为5.8个月(95%CI:2.234~9.366个月),ECOG评分0~2分患者中位OS显著长于ECOG评分>2分的患者(χ2=4.464,P=0.038)。患者性别、年龄、病理类型、吸烟、分期和厄洛替尼停药间隔时间对中位OS影响差异均无统计学意义(P均>0.05)。
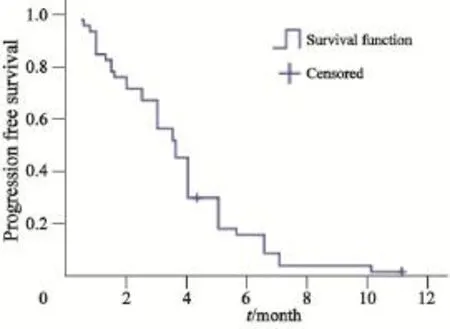
图1 无进展生存时间的Kaplan-Meier曲线Fig. 1 The Kaplan-Meier curve of progression free survival
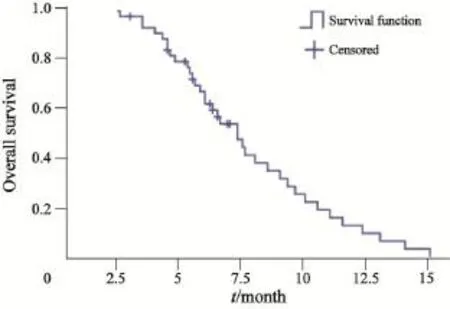
图2 总生存时间的Kaplan-Meier曲线Fig. 2 The Kaplan-Meier curve of overall survival
2.5 不良反应
本组不良反应多为Ⅰ、Ⅱ级,无患者因不可耐受的不良反应退出治疗,未出现间质性肺炎和药物治疗相关性死亡患者。最常见的不良反应为皮疹(23/46),其次是腹泻(13/46)、厌食(10/46)、皮肤干燥(8/46)、转氨酶升高(7/46)及疲乏(4/46,表2)。
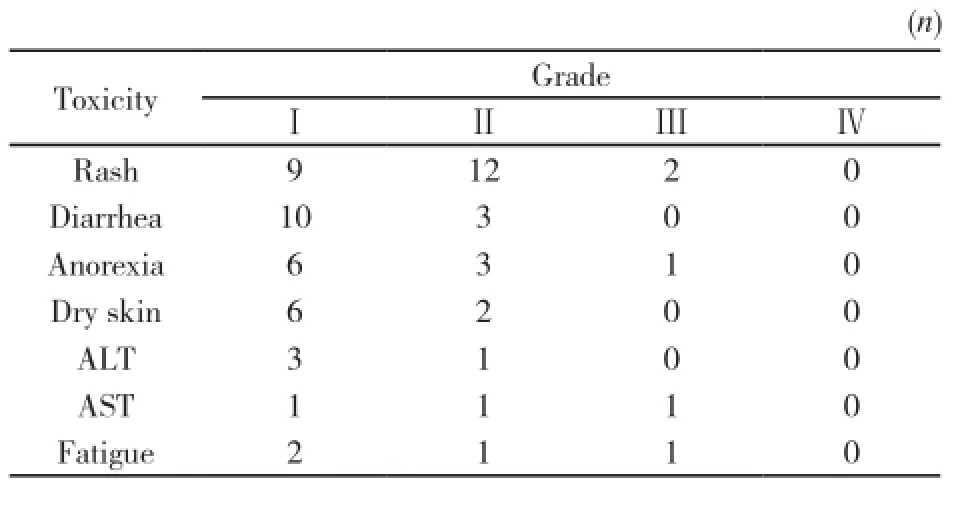
表2 厄洛替尼二次治疗晚期NSCLC的不良反应Tab. 2 The toxicity of erlotinib as the retherapy for advanced NSCLC
3 讨 论
晚期NSCLC已经进入了分子靶向治疗的时代,肺癌驱动基因的发现及相关药物的临床应用,改善了患者生活质量并延长了生存时间,靶向治疗的疗效明显优于传统化疗。EGFR-TKI是目前研究最多、证据最充分的分子靶向治疗药物,广泛应用于晚期NSCLC各个阶段。Zhou等[7]的研究是1项针对EGFR基因突变的晚期NSCLC患者一线治疗的随机、开放、Ⅲ期临床研究,分别有83例接受厄洛替尼治疗和82例接受吉西他滨+卡铂联合化疗患者入组,对厄洛替尼组中的82例和化疗组中的72例患者进行了分析,厄洛替尼组的中位PFS显著长于化疗组(P<0.000 1)。化疗组Ⅲ、Ⅳ级不良反应发生率高于厄洛替尼组。Shepherd等[8]的研究表明厄洛替尼复治晚期NSCLC患者,ORR为8.9%,DCR为45%,中位PFS为2.2个月,中位OS为6.7个月,1年生存率为22%。美国食品和药物管理局(Food and Drug Administration,FDA)于2004年11月批准厄洛替尼用于二线治疗晚期NSCLC患者。Cappuzzo等[9]的研究是针对晚期NSCLC患者,在一线含铂方案化疗后病情未进展患者中开展的1项Ⅲ期研究,共有160个中心884例患者入组,437例患者接受厄洛替尼维持治疗,447例患者接受安慰剂治疗。研究表明,厄洛替尼维持治疗组显著延长PFS和OS。对厄洛替尼有临床获益的患者最终都会出现耐药而导致病情进展,EGFR-TKI获得性耐药涉及多种机制,目前了解较多的主要是T790M突变、MET扩增和ICF-R1的过度表达[10-11]。
多项研究提示初始EGFR-TKI治疗有效的患者病情进展后二次使用EGFR-TKI可能有效,Song等[12]报道了33例EGFR-TKI二次治疗晚期NSCLC患者的疗效,PR 1例,SD 14例,PD 18例,ORR为3%,DCR为45.5%,症状改善率为39.1%,中位PFS为1.5个月,中位OS为7.3个月。李峻岭等[13]报道了18例吉非替尼二次治疗晚期NSCLC患者,PR 1例,SD 11例,PD 6例。DCR为67%,中位PFS为5.16个月,中位OS为12.41个月。Tomizawa等[14]报道了20例吉非替尼二次治疗晚期NSCLC患者的疗效,PR 5例,SD 8例,ORR为25%,DCR为65%,中位OS为10个月。本研究回顾性分析了福建省肿瘤医院46例厄洛替尼二次治疗晚期NSCLC患者,ORR为28.3%,DCR为60.9%,症状改善率为45.7%,中位PFS为3.6个月,中位OS为7.3个月,1年生存率为8.7%。停药厄洛替尼时间≥6个月的患者ORR、DCR和中位PFS均优于停药时间<6个月的患者。EGFR-TIK二次治疗晚期NSCLC获益的机制,不同的研究提出了多个解释。有研究证实,在体外实验中某些细胞毒化疗药物可以通过增加EGFR磷酸化水平,逆转肿瘤细胞耐药,使肿瘤细胞重新获得对EGFR-TIK的敏感性[15-16]。另外,厄洛替尼二次治疗间的全身化疗有可能降低对EGFR-TKI耐药的肿瘤细胞比例。
ECOG评分反应了晚期NSCLC患者的全身状态、并发症和重要脏器功能情况,并且可能决定后续的治疗,对患者的预后是非常重要的[17]。本研究结果同样显示,ECOG评分0~2分患者中位OS显著长于ECOG评分>2分的患者。另外,本研究厄洛替尼二次治疗晚期NSCLC,ORR、DCR和中位PFS均优于上述吉非替尼二次治疗晚期NSCLC的报道[12-14],可能与厄洛替尼的药物特性有关。有研究表明,常规剂量厄洛替尼的血药浓度明显高于吉非替尼,首次使用吉非替尼进展后,给予厄洛替尼治疗仍有一定的疗效[18-19]。本研究为回顾性,而且患者数量有限,难以准确判断厄洛替尼二次治疗晚期NSCLC患者是否优于吉非替尼,有待于进一步研究加以验证。
综上所述,初次使用厄洛替尼有临床获益的晚期NSCLC患者,二次使用厄洛替尼仍有可能延长患者的生存时间。
[1] SIEGEL R, MA J, ZOU Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9-29.
[2] 于慧, 王佳蕾. 晚期非小细胞肺癌的内科治疗[J]. 中国癌症杂志, 2013, 23(2): 155-160.
[3] NISHINO K, IMAMURA F, MORITA S, et al. A retrospective analysis of 335 Japanese lung cancer patients who responded to initial gefitinib treatment[J]. Lung Cancer, 2013, 82(2): 299-304.
[4] GOLDSTRAW P, CROWLEY J, CHANSKY K, et al. The IASLC Lung Cancer Staging Project: proposals for the resion of the TNM stage groupings in the forthcoming (seventh) edition of the TNM classification of malignant tumors[J]. J Thorac Onco, 2007, 2(8): 706-714.
[5] EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised recist guideline (version 1. 1)[J]. Eur J Cancer, 2009, 45(2): 228-247.
[6] CHEN A P, SETSER A, ANADKAT M J, et al. Grading dermatologic adverse events of cancer treatments: the Common Terminology Criteria for Adverse Events version 4. 0[J]. J Am Acad Dermatol, 2012, 67(5): 1025-1039.
[7] ZHOU C, WU Y L, CHEN G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol, 2011, 12(8): 735-742.
[8] SHEPHERD F A, RODRIGUES PEREIRA J, CIULEANU T, et al. Erlotinib in previously treated non small-cell lung cancer[J]. N Engl J Med, 2005, 353(2): 123-132.
[9] CAPPUZZO F, CIULEANU T, STELMAKH L, et al. Erlotinib as maintenance treatment in advanced non-small-cell lung cancer: a multicentre, randomised, placebo-controlled phase 3 study[J]. Lancet Oncol, 2010, 11(6): 521-529.
[10] 韩尚容, 樊境朴, 潘燕, 等. EGFR-TKI 耐药后的治疗策略研究进展[J]. 基础医学与临床, 2014, 34(1): 117-120.
[11] CHONG C R, JÄNNE P A. The quest to overcome resistance to EGFR-targeted therapies in cancer[J]. Nat med, 2013, 19(11): 1389-1400.
[12] SONG Z, YU X, HE C, et al. Re-administration after the failure of gefitinib or erlotinib in patients with advanced nonsmall cell lung cancer[J]. J Thorac Dis, 2013, 5(4): 400-405.
[13] 李峻岭, 郝学志, 王燕, 等. 初始易瑞沙治疗有效的晚期肺腺癌二次使用易瑞沙的疗效分析[J]. 中国肺癌杂志, 2012, 15(1): 44-48.
[14] TOMIZAWA Y, FUJITA Y, TAMURA A, et al. Effect of gefitinib re-challenge to initial gefitinib responder with nonsmall cell lung cancer followed by chemotherapy[J]. Lung Cancer, 2010, 68(2): 269-272.
[15] VAN SCHAEYBROECK S, KARAISKOU-MCCAUL A, KELLY D, et al. Epidermal growth factor receptor activity determines response of colorectal cancer cells to gefitinib alone and in combination with chemotherapy[J]. Clin Cancer Res, 2005, 11(20): 7480-7489.
[16] VAN SCHAEYBROECK S, KYULA J, KELLY D M, et al. Chemotherapy-induced epidermal growth factor receptor activation determines response to combined gefitinib/ chemotherapy treatment in non small cell lung cancer cells[J]. Mol Cancer Ther, 2006, 5(5): 1154-1165.
[17] FINKELSTEIN D M, ETTINGER D S, RUCKDESCHEL J C. Long-term survivors in metastatic non-small cell lung cancer: an Eastern Cooperative Oncology Group Study[J]. J Clin Oncol, 1986, 4(5): 702-709.
[18] LEE D H, KIM S W, SUH C, et al. Phase Ⅱ study of erlotinib as a salvage treatment for non-small cell lung cancer patients after failure of gefitinib treatment[J]. Ann Oncol, 2008, 19(12): 2039-2042.
[19] ZHOU Z T, XU X H, WEI Q, et al. Erlotinib in advanced nonsmall cell lung cancer after gefitinib failure[J]. Cancer Chemother Pharmacol, 2009, 64(6): 1123-1127.
The clinical analysis of retreatment with erlotinib in advanced non-small cell lung cancer
WU Biao,HUANG Cheng, JIANG Kan, ZHU Fang, ZHENG Xiaobin, ZHU Kai (Department of Medical Oncology, Fujian Provincial Cancer Hospital, Fujian Medical University Teaching Hospital, Fuzhou Fujian 350014, China)
HUANG Cheng E-mail: cheng671@sina.com
Background and purpose:It has a significant effect for erlotinib on treatment of patients with epidermal growth factor receptor mutation in advanced non-small cell lung cancer (NSCLC). But almost all patients will eventually progress for the resistance of drug. This study was to evaluate the efficacy and safety of retreatment of erlotinib in patients with advanced NSCLC.Methods:It was a retrospective analysis of the 46 advanced NSCLC patients who previously treated with erlotinib and had clinical benefit. The patients were given erlotinib 150 mg orally once daily after failure to other medications until disease progression or the occurrence of intolerable toxicity. The clinical features, therapeutic effect and survival were analyzed.Results:The objective response rate of retreatment with erlotinib was 28.3%. The disease control rate was 60.9%. The rate of symptom relief was 45.7%. The median progression-free survival was 3.6 months. The median overall survival was 7.3 months. One-year survival rate was 8.7%. The median progression-free survival was significant longer in the patients who stopped taking erlotinib more than 6 months than those less than 6 months (P=0.002). The median overall survival was significant longer in the patients whose ECOG ≤2 than those ECOG >2 (P=0.038). The most common drug-related adverse events were rash and diarrhea.Conclusion:The retreatment of erlotinib could possibly prolong the survival time of patients who previously treated with erlotinib and had clinical benefit.
Erlotinib; Non-small cell lung cancer; Treatment
10.3969/j.issn.1007-3969.2015.01.009
R734.2
A
1007-3639(2015)01-0050-06
2014-10-21
2014-12-23)
国家临床重点专科建设项目资助。
黄诚 E-mail:cheng671@sina.com

