食管鳞状细胞癌组织中CCL26的表达及其临床意义
杨小冬,乔俊静,秦艳茹
1.郑州大学第一附属医院肿瘤科,河南 郑州 450052;
2.郑州市第三人民医院肿瘤科,河南 郑州 450000
食管鳞状细胞癌组织中CCL26的表达及其临床意义
杨小冬1,乔俊静2,秦艳茹1
1.郑州大学第一附属医院肿瘤科,河南 郑州 450052;
2.郑州市第三人民医院肿瘤科,河南 郑州 450000
背景与目的:趋化因子在癌症的发生、发展过程中起着重要的作用,但趋化因子CCL26在食管鳞状细胞癌组织中的表达功能报道甚少。本研究旨在探讨趋化因子CCL26在人食管鳞状细胞癌组织及正常食管黏膜组织中的表达水平,分析其与食管鳞状细胞癌相关临床病理指标之间的关系。方法:利用组织微阵列技术制作组织芯片,采用免疫组织化学ABC法分析197例食管鳞状细胞癌组织和相应癌旁正常食管黏膜组织中趋化因子CCL26的表达水平,并对食管鳞状细胞癌中趋化因子CCL26的表达与患者年龄、性别、临床分期、淋巴结转移及5年生存率等临床病理指标的相关性进行分析。结果:①趋化因子CCL26在食管鳞状细胞癌组织及癌旁正常组织中均有表达,在食管鳞状细胞癌组织中趋化因子CCL26的阳性表达率明显高于癌旁正常组,差异有统计学意义(61.8% vs 20.6%,P<0.05);②趋化因子CCL26的表达与淋巴结转移有关,而与患者的年龄、性别、组织学类型、肿瘤细胞分化程度和大体分型等无关(P>0.05);③趋化因子CCL26阳性表达的食管鳞状细胞癌患者5年生存率明显低于趋化因子CCL26阴性表达的食管鳞状细胞癌患者。结论:趋化因子CCL26高表达可能与食管鳞状细胞癌的发生、发展相关,导致5年生存率下降,检测趋化因子CCL26可能为食管鳞状细胞癌预后判断提供依据。
食管鳞状细胞癌;趋化因子CCL26;组织芯片;免疫组化;预后
食管癌是世界上最常见的消化道恶性肿瘤之一,我国是食管癌的高发国家,尤其太行山一带,如河南省安阳市林州,更是食管癌的高发地区,食管癌组织学类型主要以鳞状细胞癌为主[1]。有调查研究表明,食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)在世界许多国家的5年总生存率大约在15%左右,严重威胁着人类的身心健康[2]。而造成其预后差、生存率低的主要原因之一是缺乏可靠的早期检测指标和个体化的治疗手段[3]。
趋化因子是由白细胞分泌的可溶性小分子(8×103~14×103)蛋白,属于小蛋白类的超家族,因在体内操纵白细胞的移行而被熟知,如中性粒细胞向CXCL8的迁移,嗜酸性粒细胞向CCL11的迁移等。趋化因子和与它同源的G蛋白偶联受体结合,从而介导一系列细胞生物学效应,在调控免疫细胞的分化、发育及定向迁移等方面起到重要的作用[4]。趋化因子与人类的炎性反应、肿瘤的发生、发展密切相关,长期的细菌、病毒等刺激因素导致的慢性炎性反应可以使机体发生癌前病变的概率增加,进而促进肿瘤的形成。同时,趋化因子还可以通过内分泌或旁分泌机制维持肿瘤生长,诱导血管的发生,帮助逃避机体的免疫监测,趋化因子在肿瘤进展中起着至关重要的作用[5-6]。
CCL26也称之为Eotaxin-3,又称巨噬细胞炎性蛋白(macrophage inflammatory protein 4-alpha),该基因位于染色体7q11.2,诱导小细胞因子亚家族A,成员26(SCYA26),是CC类趋化因子家族中的一员,作用于嗜酸性粒细胞、T细胞;受体为CCR3。趋化因子受体及其相应配体已被证明在恶性肿瘤的发生、发展中发挥重要作用,趋化因子CCL26能够介导炎性细胞的趋化、肿瘤细胞的增殖等生理、病理过程,特别是调节肿瘤细胞的生长和转移能力[7-8]。本研究采用免疫组织化学方法检测了趋化因子CCL26在ESCC组织和癌旁正常食管黏膜组织中的表达水平,旨在进一步了解趋化因子CCL26表达水平与ESCC的发生、发展及预后的关系,为研究食管癌的发病、转移、判断预后提供新的参考资料。
1 资料和方法
1.1 临床资料
197例ESCC组织及相应的癌旁正常食管黏膜组织(距离肿块组织5 cm以上)来自2005年1月—2009年12月在河南省林州市人民医院的手术患者,均通过病理确诊,并有完整的病史资料和随访结果。其中男性92例,女性105例;年龄<60岁者112例,≥60岁者85例;高分化32例,中分化116例,低分化49例;TNM分期(2009年AJCC分期)Ⅰ期23例,Ⅱ期106例,Ⅲ 期68例;髓质型105例,溃疡型67例,缩窄型11例,蕈伞型14例;淋巴结转移者86例。食管癌组织标本经过常规4%多聚甲醛固定,石蜡包埋,切片、HE染色。患者术前均未接受任何放疗或化疗,所有标本经组织病理学检查证实为原发性ESCC,癌旁正常食管组织取样范围内不含肿瘤细胞。患者知情并签字知情同意书,符合伦理的要求。
1.2 组织芯片制作
对所收集食管癌患者的组织切片进行形态学观察,选择肿瘤组织及癌旁正常食管组织具有代表性的组织区域,用组织阵列以支架上的X、Y轴刻度尺标记后进行取样。预先制备一个35 mm×25 mm×5 mm大小的受体蜡块,用组织芯片制作仪在受体蜡块上打孔,孔的间距为0.9 mm,直径1.0 mm,孔深约为3~4 mm。用组织芯片仪(广州浩瀚仪器有限公司)在供体蜡块相应位置进行穿刺取样。然后,将用组织芯片仪穿刺所得的微小圆柱形组织植入到预先准备好的受体蜡块上的阵列孔中。
1.3 免疫组织化学检测
采用卵白素-生物素-辣根过氧化氢酶复合物(ABC)法,主要试剂:兔抗人趋化因子CCL26多克隆抗体(Anti-Eotaxin 3抗体,ab115653)购自英国Abcam公司;ABC试剂盒购自德国Vector Laboratories公司,DAB底物试剂盒购自北京中杉金桥生物技术有限公司,小牛冻干血清蛋白(BSA)购自美国Sigma公司。用生产第二抗体的正常动物血清封闭非特异性免疫球蛋白反应,并省略第一抗体作为空白对照,采用已知的阳性切片作为阳性对照。严格按照试剂盒的说明书步骤操作。主要步骤如下:组织切片常规脱蜡至水,PBS冲洗3次(每次5 min,下同);3% H2O2室温温育20 min,PBS洗3次;滴加正常羊血清,室温温育20 min,封闭;加一抗,兔抗人趋化因子CCL26多克隆抗体(1∶100稀释),4 ℃冰箱温育过夜,PBS洗3次;滴加第二抗体(羊抗兔IgG-Biotin),温育45 min(1∶200,稀释),PBS洗3次;ABC室温温育60 min(使用前30 min配制),PBS洗3次;滴加DAB显色剂,H2O2温育2~10 min,苏木精复染,显微镜下观察结果;然后酒精梯队脱水、二甲苯透明,中性树胶封片。阳性细胞标准为细胞胞质出现黄棕色染色颗粒,显微镜高倍镜(×200)下计数至少5个随机视野。按阳性细胞在总细胞中所占比例和着色强度分别进行记分,①按阳性细胞百分率记分:比例<5%为0分,5%~<25%为1分,25%~<50%为2分,50%~<75%为3分,≥75%为4分;②按着色强度记分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。最后两部分相乘得总分,总分0~1分为阴性,≥2分为阳性。
1.4 统计学处理
采用SPSS 17.0统计软件进行统计分析。分类资料采用 χ2检验,采用Kaplan-Meier法分析生存率,比较2组间生存率的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 趋化因子CCL26在ESCC及癌旁正常食管组织中的表达
在197例ESCC与其相对应的癌旁正常食管黏膜组织中,有32例出现脱片、染色不佳、肿瘤组织的细胞数少于100等无效检测,即有效检测患者为165例。趋化因子CCL26在165例食管鳞癌组织中呈中到强染色(图1A),表达阳性率为61.8%(102/165),癌旁正常食管黏膜组织中,呈较弱染色或无染色(图1B),表达阳性率为20.6%;趋化因子CCL26在ESCC中的表达明显高于癌旁正常食管组织,2组间比较,差异有统计学意义(P<0.05,表1)。

图1 趋化因子CCL26在ESCC和相应癌旁正常组织黏膜中表达差异Fig. 1 The difference of CCL26 expression in ESCC and the corresponding normal tissues adjacent to carcinoma mucosa

表1 趋化因子CCL26在ESCC组织和正常组织中的表达Tab. 1 Expression of CCL26 in ESCC and paraneoplastic normal esophageal tissues
2.2 趋化因子CCL26与食管癌临床病理参数的关系
本研究发现,在ESCC中,趋化因子CCL26的表达水平与年龄、性别、肿瘤细胞分化程度、TNM分期和大体分型无相关(P>0.05),而趋化因子CCL26的阳性表达率和淋巴结转移相关,有淋巴结转移的阳性表达率为77.6%(52/67),无淋巴结转移的阳性表达率为59.2%(58/98),2者比较差异有统计学意义(P<0.05,表2)。

表2 趋化因子CCL26表达与ESCC临床病理参数的关系Tab. 2 CCL26 expression in ESCC and its relationship with clinical pathological parameters(n=165)
2.3 趋化因子CCL26表达与ESCC患者5年生存率的关系
Kaplan-Meier生存率分析显示,趋化因子CCL26阳性表达的ESCC患者5年生存率明显低于趋化因子CCL26阴性表达的ESCC患者(图2)。
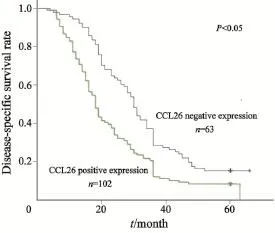
图2 趋化因子CCL26阳性表达患者和阴性表达患者的5年生存率曲线图Fig. 2 The 5-year survival rate curves of CCL26 positive patients and negative patients
3 讨 论
本研究通过组织芯片技术和免疫组化技术分析了ESCC组织与相应癌旁正常食管组织间趋化因子CCL26的表达差异,结果表明趋化因子CCL26在ESCC上呈高表达,并在此基础上探讨了趋化因子CCL26的表达水平与ESCC临床病理参数以及患者5年生存率的关系。
趋化因子种类众多,目前发现的趋化因子有50余种,按照半胱氨酸残基的数量和位置可将趋化因子分为4类:CXC、CC、C、CX3C 4个亚类[9]。自1988年发现第一个趋化因CCL2(MCP-1)以来,趋化因子及其受体的结构、功能及在体内的作用已经成为众多学者研究的热点[10]。趋化因子及其受体相互作用,参与细胞的生长、发育、分化及凋亡等多种生理过程,并在炎性反应、病原体感染、创伤修复及肿瘤形成和转移等方面发挥广泛的生理和病理作用[11-12]。不同的趋化因子作用也不尽相同,有些趋化因子可以促进细胞的增殖,抑制凋亡,诱导血管生成等;而另一些趋化因子及其受体却能增强机体的免疫功能,减少肿瘤血管生成,从而抑制肿瘤生长。
CC趋化因子由于其白细胞迁移功能,在炎性反应、淋巴细胞归巢及免疫反应等方面起着重要的作用[13-14]。趋化因子CCL26是CCR3的激动剂,但同时也是CCR1、CCR2、CCR5的拮抗剂,尤其对于CCR2(一个由巨噬细胞和单核细胞表达的重要的促炎趋化因子受体),有资料证明趋化因子CCL26能阻止单核细胞趋化蛋白MCP-1(CCR2的主要配体)反应,还有报道称某些IL-4和某些促炎细胞因子,如TNF-α、IL-1β和IFN-γ可以促进趋化因子CCL26在人类单核细胞的合成,因此推断,趋化因子CCL26在炎性反应过程中可能起到重要的调节作用[15]。趋化因子CCL26基因的单核苷酸多态性和食管炎的发病增加有关,在嗜酸细胞性食管炎的病理活检中,我们可以发现趋化因子CCL26的表达是明显增加的,这和某项研究一致,该研究[16-18]表明趋化因子CCL26在嗜酸细胞性食管炎中呈高表达,并参与食管炎的一系列生理、病理过程,而反复的慢性炎性反应刺激会使发生癌前病变的概率大大增加。虽然趋化因子CC基因的遗传多态性与患食管癌风险之间的直接关系还鲜见报道,但这些基因的遗传变异和自身免疫性疾病等有关,这也构成了罹患食管癌的危险因素。
众所周知,转移是恶性肿瘤的主要生物学特征之一,在恶性肿瘤的发生、发展过程中,肿瘤细胞是很容易发生转移的,如淋巴结转移、远处脏器转移等,这也是肿瘤患者失去最佳治疗时机的重要原因之一,成为影响治疗成功的重要障碍。然而,肿瘤转移是一个复杂、多步骤的过程,趋化因子及其相应的受体在恶性肿瘤的转移过程中扮演着重要的角色[19]。目前,越来越多的趋化因子与趋化因子受体被证实与恶性肿瘤相关,趋化因子及相应的受体在恶性肿瘤中的作用越来越引起人们的重视,这给肿瘤的治疗带来新的思路,并显示出了良好的应用前景。
本研究通过对165例ESCC组织中趋化因子CCL26的表达水平进行研究发现,趋化因子CCL26在ESCC中呈高表达,明显高于癌旁正常组织,2组差异有统计学意义(P<0.05),由此推断,趋化因子CCL26的高表达可能在ESCC的发生、发展中发挥着重要的作用。另外,通过趋化因子CCL26表达与ESCC临床病理参数的关系及5年生存曲线图表明,ESCC中趋化因子CCL26的表达与组织学类型、分化程度及TNM分期等无明显相关,而与淋巴结转移有关,趋化因子CCL26在淋巴结转移阳性患者表达高于无淋巴结转移患者,2者差异有统计学意义;同时,数据提示趋化因子CCL26阳性表达的ESCC患者5年生存率较趋化因子CCL26阴性表达患者的低,趋化因子CCL26阳性表达的ESCC可能具有更大的侵袭能力和转移能力。由此推断,ESCC患者的趋化因子CCL26的表达情况可能作为临床预后指标之一,检测趋化因子CCL26表达对ESCC的诊断预后有一定的临床价值。但是,由于趋化因子受体CCR3在ESCC中的作用常常有免疫细胞的参与,能通过免疫应答来抑制肿瘤血管的生成,癌细胞的生长、转移等[20],趋化因子CCL26及其受体CCR3效应的作用发挥可能受到多种因素的影响;除此之外,在ESCC中,趋化因子CCL26的异常表达还受STAT6(信号转导和转录激活因子)或者更多信号通路来调控[21],这也提示趋化因子CCL26发挥作用有其复杂性。因此,对ESCC中趋化因子CCL26高表达的机制以及其信号通路还需做进一步的研究。
[1] LEHRBACH D M, NITA M E, CECCONELLO I. Molecular aspects of esophageal squamous cell carcinoma carcinogenesis[J]. Arq Gastroenterol, 2003, 40(4): 256-261.
[2] PORTALE G, HAGEN J A, PETERS J H, et al. Modern 5-year survival of resectable esophageal adenocarcinoma: single institution experience with 263 patients[J]. J Am Coll Surg, 2006, 202(4): 588-596.
[3] LAMBERT R, HAINAUT P. The multidisciplinary management of gastrointestinal cancer epidemiology of esophagogastric cancer[J]. Best Pract Res Clin Gastroenterol, 2007, 21(6): 921-945.
[4] ROT A, VON ANDRIAN U H. Chemokines in innate and adaptive host defense: basic chemokinese grammar for immune cells[J]. Annu Rev Immunol, 2004, 22: 891-928.
[5] ALLAVENA P, GERMANO G, MARCHESI F, et al. Chemokines in cancer related inflammation[J]. Exp Cell Res, 2011, 317(5): 664-673.
[6] LAZENNEC G, RICHMOND A. Chemokines and chemokine receptors: new insights into cancer-related inflammation[J]. Trends Mol Med, 2010, 16(3): 133-144.
[7] ROLLINS B J. Inflammatory chemokines in cancer growth and progression[J]. Eur J Cancer, 2006, 42(6): 760-767.
[8] LIN Z Y, CHUANG Y H, CHUANG W L. Cancer-associated fibroblasts up-regulate CCL2, CCL26, IL6 and LOXL2 genes related to promotion of cancer progression in hepatocellular carcinoma cells[J]. Biomed Pharmacother, 2012, 66(7): 525-529.
[9] 邱智泉, 谭蔚锋, 张柏和, 等. 趋化因子CCL20与恶性肿瘤之间的关系[J]. 肿瘤, 2011, 31(10): 961-963.
[10] 吴凤霞, 袁国华. 趋化因子及其受体研究进展[J]. 川北医学院学报, 2008, 23(3): 297-300.
[11] ACHARYYA S, OSKARSSON T, VANHARANTA S, et al. A CXCL1 paracrine network links cancer chemoresistance and metastasis[J]. Cell, 2012, 150(1): 165-178.
[12] FACCIABENE A, PENG X, HAGEMANN I S, et al. Tumour hypoxia promotes tolerance and angiogenesis via CCL28 and T(reg) cells[J]. Nature, 2011, 475(7355): 226-230.
[13] ROSSI D, ZLOTNIK A. The biology of chemokines and their receptors[J]. Annu Rev Immunol, 2000, 18: 217-242.
[14] SCHWARZ M K, WELLS T N. New therapeutics that modulate chemokine networks[J]. Nat Rev Drug Discov, 2002, 1: 347-358.
[15] STUBBS V E, POWER C, PATEL K D. Regulation of eotaxin-3/CCL26 expression in human monocytic cells[J]. Immunology, 2010, 130(1): 74-82.
[16] LUCENDO A J, DE REZENDE L, COMAS C, et al. Treatment with topical steroids downregulates IL-5, eotaxin-1/CCL11, and eotaxin-3/CCL26 gene expression in eosinophilic esophagitis [J]. Am J Gastroenterol, 2008, 103(9): 2184-2193.
[17] BLANCHARD C, WANG N, STRINGER K F, et al. Eotaxin-3 and a uniquely conserved gene-expression profile in eosinophilic esophagitis [J]. J Clin Invest, 2006, 116(2): 536-547.
[18] GUPTA S K, FITZGERALD J F, KONDRATYUK T, et al. Cytokine expression in normal and inflamed esophageal mucosa: a study into the pathogenesis of allergic eosinophilic esophagitis [J]. J Pediatr Gastroenterol Nutr, 2006, 42(1): 22-26.
[19] 龚迪和, 丁克峰. 趋化因子CCL28在乳腺癌中的表达及意义[J]. 中国癌症杂志, 2014, 24(4): 304-309.
[20] 韩堃, 黎燕, 陈国江. 趋化因子及其受体在肿瘤转移中作用的研究进展[J]. 国家药学研究杂志, 2012, 39(5): 386-390.
[21] KRISHNAMURTHY P, SHERRILL J D, PARASHETTE K, et al. Correlation of increased PARP14 and CCL26 expression in biopsies from children with eosinophilic esophagitis [J]. J Allergy Clin Immunol, 2014, 133(2): 577-580.
Expression of CCL26 in esophageal squamous cell carcinoma tissues and its clinical significance
YANG Xiaodong1, QIAO Junjing2, QIN Yanru1(1.Department of Clinical Oncology, the First Affiliated Hospital, Zhengzhou University, Zhengzhou Henan 450052, China; 2.Department of Oncology, the Third Hospital of Zhengzhou, Zhengzhou Henan 450000, China)
QIN Yanru E-mail: yanruqin@163.com
Background and purpose:Chemokines play an important role in cancer occurrence and development. However, little about the function of CCL26 in esophageal squamous cell carcinoma (ESCC) is reported. This study was designed to observe and study the expression of chemokine CCL26 in ESCC tissues and to analyze their association with pathological features of ESCC.Methods:Expressions of chemokine CCL26 in 197 ESCC tissues and their corresponding paraneoplastic normal esophageal tissues were determined by tissue array and immunohistochemistry (IHC) technique, and its correlations to age, gender, lymph nodes metastasis, TNM stage, general classification and 5-year survival rate of ESCC patients were further analyzed.Results:①CCL26 was expressed in both ESCC and paraneoplastic normal esophageal tissues. The expression of CCL26 in ESCC tissues was significantly higher than that in paraneoplastic normal esophageal tissues (61.8% vs 20.6%, P<0.05). ②The expression of CCL26 was correlated with lymph node metastasis, but not correlated with age, gender, tumor cell differentiation, and general classification (P>0.05). ③Survival analysis showed that the abnormal expression of CCL26 was associated with 5-year survival rate of patients with ESCC. The 5-year survival rate of ESCC patients with CCL26 positive expression was obviously lower than that of ESCC patients with CCL26 negative expression.Conclusion:CCL26 upexpression might play an important role in the progression and development of ESCC patients. The high level of CCL26 expression is correlated with lymph node metastasis and poor survival. Detection of CCL26 expression mayhave important prognostic values in ESCC patients.
Esophageal squamous cell carcinoma; CCL26; Tissue array; Immunohistochemistry; Prognosis
10.3969/j.issn.1007-3969.2015.01.003
R735.1
A
1007-3639(2015)01-0013-06
2014-09-29
2014-12-31)
河南省卫生厅基金资助项目(2011020021);河南省科技厅基金资助项目(112102310618)。
秦艳茹 E-mail:yanruqin@163.com

