采用常规电泳设备建立CLARITY透明脑技术
王大炜,程韵,王婷婷,陈晓萍
浙江工业大学 生物与环境工程学院,浙江 杭州 310032
2013 年5 月,Deisseroth[1]等在《Nature》上报道了一种名为“CLARITY”的全新脑组织形态分析技术,通过构建三维多孔水凝胶网络和选择性洗脱膜脂分子,得到了一种通澈透明的脑结构模型,这种新型模型能在完整脑原位呈现立体的神经突触与神经纤维投射网络、亚细胞结构、蛋白质/核酸/神经递质的精细结构,在脑结构与功能研究中具有重要应用前景,因而被认为是2013年全球重要的科技进展[2]。
CLARITY 技术明显改善和突破了传统组织形态学研究技术的局限与不足。在传统的组织形态学研究技术中,细胞表面与内部的膜脂以及细胞连接结构组成折光屏障,阻挡光线穿透组织细胞,因而不能形成直观透视图像,需要将组织进行切片,逐片分析其形态结构[3-8]。近年来,一些科学家通过对组织制片过程中预处理方法的改进,结合计算机图像处理技术,实现了部分组织结构的立体成像,如大脑海马CA1区神经元的3D成像,但并未从根本上解决问题[9-11]。CLARITY 技术则是采用丙烯酰胺单体在脑组织内聚合形成水凝胶,利用聚丙烯酰胺水凝胶的生物特性,结合和固定组织细胞中的蛋白质与核酸,选择性洗脱阻挡光线通透的脂分子,从而呈现出保持了原有组织细胞形态的三维立体通透图像[1,12]。
CLARITY 技术中对脂分子的选择性洗脱在电泳条件下进行,在Deisseroth 的方法中,作者自制了专用的脑组织电泳装置(electrophoretic tissue clearing,ETC),以高浓度的十二烷基磺酸钠(sodium dodecyl sulfate,SDS)溶液作为电泳缓冲液和洗脱溶液。考虑到在国内普通实验室开展相关技术的设备局限性,我们根据CLARITY 技术原理,利用普通生物实验室常用的电泳装置,对操作流程稍做改变,在自己实验室初步建立了这项技术。
1 材料和方法
1.1 材料
20周龄雌性ICR小鼠购自浙江省医学实验动物中心,体重35~40 g,饲养室温度(20±2)℃,湿度50%~60%,12 h/12 h昼夜光周期,自由摄食和饮水。
丙烯酰胺(99.9%)、双丙烯酰胺(99%)购自生工生物工程(上海)股份有限公司;VA044 引发剂(98.0%)购自上海抚生实业有限公司;多聚甲醛(95%)购自Sigma 公司;SDS(化学纯)购自上海英鹏化学试剂有限公司;硼酸(分析纯)购自太仓美达试剂有限公司;细胞过滤器(40μm 孔径)购自上海卧宏生物科技有限公司;DYY-8C 型电泳仪、DYCP-31A型电泳槽购自北京六一仪器厂。
水凝胶预反应液:4%多聚甲醛,4%丙烯酰胺,0.05%双叉丙烯酰胺,0.25% VA044 引发剂,溶于0.01 mol/L 磷酸盐缓冲液(pH7.4)中,新鲜配制,预冷至4℃。
电泳/洗涤缓冲液:4% SDS 溶于200 mmol/L 硼酸盐缓冲液(pH8.5),室温保存,使用前预温至50℃。
1.2 脑室灌注
小鼠皮下注射40 mg/kg 戊巴比妥钠溶液,待其完全麻醉后,将小鼠平躺置于冰上,在胸腹部剪开暴露心脏,用7 号输液针头插入左心室,同时在右心耳剪开小口作为液体流出口。先缓缓灌注50 mL冰冷的磷酸盐缓冲液,再灌注预冷的水凝胶预反应液30 mL,迅速剥离完整脑组织,用冰冷的磷酸盐缓冲液冲洗后置于盛有水凝胶预反应液的小烧杯中,保鲜膜封口,于4℃冰箱内放置3 d,使水凝胶预反应液慢慢渗入鼠脑。
1.3 水凝胶包埋
将4℃反应3 d 的小烧杯取出,于40℃水浴中孵育3 h,待聚合反应结束,取出烧杯,自然冷却至室温,从水凝胶块中剥出完整鼠脑,于50℃电泳/洗涤缓冲液中浸泡24 h,12 h 换液一次,以去除鼠脑内残留的多聚甲醛和引发剂等物质。
1.4 透明化
将浸泡于电泳/洗涤缓冲液的鼠脑移至细胞过滤器,固定于电泳槽的负极凹槽内,加入足量缓冲液,在水温50℃、电压40 V、电流150 mA 条件下电泳洗涤,每天更换50%缓冲液,每隔2 d观察、拍照。
2 结果
2.1 脑组织的水凝胶包埋
如图1 所示,多聚甲醛固定、水凝胶包埋后的脑组织呈乳白色不透明状,质地柔软富有弹性,周围的水凝胶透明无色。脑组织与周围的聚丙烯酰胺凝胶相互交融成为一体,刀片切割后成为水凝胶块。
2.2 脑组织的透明化进程
在SDS 电泳洗涤条件下,脑组织中的脂类物质被逐步置换去除,脑组织也逐渐变得透明。如图2所示,在洗涤开始前,脑组织呈现均匀不透明的乳白色;2 d 后,周边部的乳白色颜色开始减退,但中心部分无明显变化;4 d 时,周边部分开始呈现半透明,而中心部分仍为乳白色不透明状;6 d 时,周边半透明区域进一步扩大,而中心乳白色不透明区域进一步缩小;8 d 时,中心乳白色不透明区域已基本消除,整个脑组织呈现为半透明状态,周边区域透明程度增加;10 d 时,周边透明区域扩大,中心半透明区域逐渐缩小。在整个透明化过程中,由于水凝胶吸水溶胀的作用,脑组织出现了一定程度的膨胀。
3 讨论
CLARITY 技术的基本流程包括多聚甲醛组织固定、聚丙烯酰胺凝胶包埋、电泳洗涤等3 个步骤。与常规组织形态学研究技术不同,CLARITY 技术将脑组织包埋于无色透明的聚丙烯酰胺中,这种纳米级别的立体网络既能物理性支撑柔软的脑组织,同时还能原位结合蛋白质、核酸等大分子[13-15]。在洗涤阶段,高浓度的SDS 构成脂-水交融环境,分散膜脂分子成为带负电荷颗粒,在电场作用下被逐步从脑组织中交换去除,而蛋白质、核酸因结合于水凝胶网络保留在原位[16-17]。因此,CLARITY 最主要的特点在于:①运用水凝胶网络选择性去除脂类;②ETC 装置提供强电场洗涤环境。
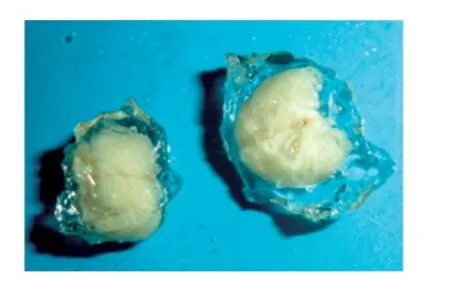
图1 水凝胶包埋后的脑组织
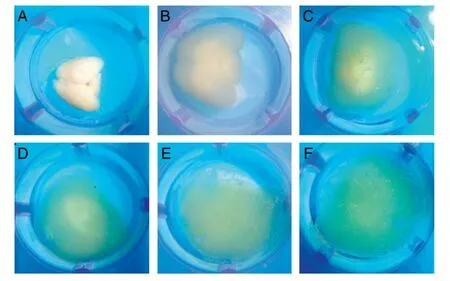
图2 鼠脑的透明化过程

图3 CLARITY技术的基本步骤
Deisseroth 的实验采用了自制电泳装置,它电泳间距短,电场力强,并带有电泳/洗涤液持续流动交换装置。由于该设备自行制备有一定技术要求,我们想到了利用实验室中的普通平板电泳装置,在对有关技术参数进行适当调整后,开展本项实验。
我们首先对新鲜脑组织进行了水凝胶包埋,通过脑室灌注水凝胶预反应液和低温缓慢聚合反应,丙烯酰胺、双叉丙烯酰胺、引发剂等凝胶前体物质逐渐渗入脑组织,在脑中逐渐聚合成富有弹性的水凝胶结构。由于脑组织中脂类物质具有强的可见光折光能力,组织块呈现白色不透明状态。在接下来的电泳洗脱中,膜脂分子被SDS分散,形成带有负电荷的颗粒,在电场作用下向正极泳动而被逐渐去除,脑组织也逐渐变得透明。
与Deisseroth 的实验相比,我们用常规电泳仪代替ETC装置,电场力较弱,电泳洗涤液的更换也只能定时进行而不是持续交换,因而电泳洗涤效果略差,需要更长的时间才能完成透明化过程。CLARITY作为新兴技术,目前还存在组织块膨胀、实验周期太长等一系列问题[1,12],我们正在继续探讨,进一步优化技术条件。
脑科学研究目前面临重要的发展机遇。2013年4 月,美国政府启动脑科学研究计划(Brain Activity Map Project),欧盟近期也有类似计划。以脑神经网络为核心的脑结构与功能研究正在快速发展,成为新兴热点领域[18-20]。作为能够直观立体显示神经网络连接的新型形态学研究技术,CLARITY 在脑结构、功能、神经精神疾病病理机制研究中具有重要应用价值。我们的研究基于普通实验室的设备条件,有助于CLARITY技术的推广。
[1]Chung K,Wallace J,Kim S Y,et al.Structural and molecular interrogation of intact biological systems[J].Nature,2013,497(7449):332-337.
[2]van Noorden R,Tollefson J,Hayden E C,et al.365 days:2013 in review[J].Nature,2013,504(7480):344-349.
[3]Denk W,Horstmann H.Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure[J].PLoS Biol,2004,2(11):e329.
[4]Micheva K D,Smith S J.Array tomography:a new tool for imaging the molecular architecture and ultrastructure of neural circuits[J].Neuron,2007,55(1):25-36.
[5]Micheva K D,Busse B,Weiler N C,et al.Single-synapse analysis of a diverse synapse population:proteomic imaging methods and markers[J].Neuron,2010,68(4):639-653.
[6]Bock D D,Lee W C,Kerlin A M,et al.Network anatomy and in vivo physiology of visual cortical neurons[J].Nature,2011,471(7337):177-182.
[7]Briggman K L,Helmstaedter M,Denk W.Wiring specificity in the direction-selectivity circuit of the retina[J].Neuron,2010,68(4):639-653.
[8]Ragan T,Kadiri L R,Venkataraju K U,et al.Serial two-photon tomography for automated ex vivo mouse brain imaging[J].Nat Methods,2012,9(3):255-258.
[9]Dodt H U,Leischner U,Schierloh A,et al.Ultramicroscopy:three-dimensional visualization of neuronal networks in the whole mouse brain[J].Nat Methods,2007,4(4):331-336.
[10]Erturk A,Mauch C P,Hellal F,et al.Three-dimensional imaging of the unsectioned adult spinal cord to assess axon regeneration and glial responses after injury[J].Nat Med,2011,18(1):166-171.
[11]Hama H,Kurokawa H,Kawano H,et al.Scale:a chemical approach for fluorescence imaging and reconstruction of transparentmouse brain[J].Nat Neurosci,2011,14(11):1481-1488.
[12]Chung K,Deisseroth K.Clarity for mapping the nervous system[J].Nat Methods,2013,10(6):508-513.
[13]Gil E S,Hudson S M.Stimuli-reponsive polymers and their bioconjugates[J].Prog Polym Sci,2004,29:1173-1222.
[14]Gupta P,Vermani K,Garg S.Hydrogels:from controlled release to pH-responsive drug delivery[J].Drug Discov Today,2002,7(10):569-579.
[15]Peppas N A,Hilt Z J,Khademhosseini A,et al.Hydrogels in biology and medicine:from molecular principles to bionanotechnology[J].Adv Mater,2006,18(11):1345-1360.
[16]Sykova E,Nicholson C.Diffusion in brain extracellular space[J].Physiol Rev,2008,88(4):1277-1340.
[17]Hamidi M,Azadi A,Rafiei P.Hydrogel nanoparticles in drug delivery[J].Adv Drug Deliver Rev,2008,60(15):1638-1649.
[18]Deisseroth K.Optogenetics and psychiatry:applications,challenges,and opportunities[J].Biol Psychiatry,2012,71(12):1030-1032.
[19]Alivisatos A P,Chun M,Church G M,et al.The Brain Activity Map Project and the challenge of functional connectomics[J].Neuron,2012,74(6):970-974.
[20]Alivisatos A P,Chun M,Church G M,et al.The Brain Activity Map[J].Science,2013.339(6125):1284-1285.

